NeuMoDx SARS-CoV-2 Test Strip BRUKSANVISNING
|
|
|
- Karen Margrethe Helland
- 3 år siden
- Visninger:
Transkript
1 h V i 38 FORSIKTIG: Bare til amerikansk eksport Til in vitro-diagnostikk med NeuMoDx 288 og NeuMoDx 96 Molecular Systems Oppdateringer finnes på: Detaljerte anvisninger finnes i brukerhåndboken for NeuMoDx 288 Molecular System, art.nr Detaljerte anvisninger finnes i brukerhåndboken for NeuMoDx 96 Molecular System, art.nr Rx only TILTENKT BRUK NeuMoDx SARS-CoV-2 Assay implementert på NeuMoDx 288 Molecular System og NeuMoDx 96 Molecular System (NeuMoDx Molecular System(s)) er en rask, automatisert, kvalitativ in vitro-sanntids-rt-pcr-diagnostisk test for direkte detektering av SARS-CoV-2-koronavirus-RNA fra nasofaryngeale prøver, orofaryngeale prøver eller nasale avstrykprøver i transportmedium fra personer med tegn og symptomer på infeksjon som er mistenkt å ha COVID-19. NeuMoDx SARS-CoV-2 Assay er ment å brukes i kliniske laboratorier og sykehus av kvalifisert helsepersonell. Resultatene er for identifisering av 219-nCoV-RNA. 219-nCoV-RNA er generelt detekterbart i nasofaryngeale, orofaryngeale eller nasale avstrykprøver i transportmedium under den akutte infeksjonsfasen. Positive resultater indikerer forekomst av SARS-CoV-2-RNA. Klinisk korrelasjon med pasienthistorikk og annen diagnostisk informasjon er nødvendig for å bestemme pasientens infeksjonsstatus. Laboratorier i USA og amerikanske territorier er pålagt å rapportere alle positive resultater til vedkommende folkehelsemyndigheter. Negative resultater utelukker ikke 219-nCoV-infeksjon og bør ikke brukes som eneste grunnlag for pasientbehandlingsbeslutninger. Negative resultater må kombineres med kliniske observasjoner, pasienthistorikk og epidemiologisk informasjon. NeuMoDx SARS-CoV-2 Assay skal bare brukes av kvalifisert klinisk laboratoriepersonale med spesifikk anvisning og opplæring i teknikkene for sanntids-pcr og in vitro-diagnostiske prosedyrer. SAMMENDRAG OG FORKLARING Nasofaryngeale, orofaryngeale eller nasale avstryk tas i Copan Universal Transport Medium (UTM-RT ) System eller BD Universal Viral Transport System (UVT). For å klargjøre for testing er primærprøvetakingsrøret (med avstryk fjernet og hette tatt av), en ren alikvot av prøvemediet eller en alikvot av transportmediet forbehandlet med NeuMoDx Viral Lysis Buffer i et sekundærprøverør utstyrt med strekkode og lastet inn på NeuMoDx System ved hjelp av en angitt prøverørstransportør, og deretter starter behandling automatisk. For hver prøve aspireres en 4 µl alikvot av NeuMoDx System og blandes med NeuMoDx Lysis Buffer 3 (direkte prøver) eller NeuMoDx Lysis Buffer 2 (forbehandlede prøver). NeuMoDx Sy stem utfører automatisk alle nødvendige trinn for å ekstrahere målnukleinsyren, klargjøre det isolerte RNA-et for sanntids omvendt transkripsjonpolymerasekjedereaksjon (RT-PCR) og eventuelt amplifisere og detektere amplifikasjonsproduktene: Det ikke-strukturelle protein 2 (NSP2)-genet og SARS-CoV-2 genomets N-gen. NeuMoDx SARS-CoV-2 Assay omfatter en RNA-prøveprosesskontroll (Sample Process Control, SPC2) for å overvåke forekomst av potensielle hemmende stoffer og NeuMoDx System- eller reagenssvikt som kan oppstå under ekstraksjons- og amplifikasjonsprosessen. PROSEDYREPRINSIPPER NeuMoDx SARS-CoV-2 Assay kombinerer automatisert RNA-ekstraksjon og -amplifikasjon/-detektering ved sanntids-rt-pcr. Nasofaryngeale, orofaryngeale eller nasale avstrykprøver tas på Copan UTM-RT System eller BD UVT System. Det finnes to arbeidsflyter for prøveklargjøring med NeuMoDx SARS-CoV-2 Assay. Den direkte arbeidsflyten gjør det mulig å laste avstrykprøvetakingsrøret eller en alikvot av transportmediet i et sekundærrør inn på NeuMoDx System for behandling uten videre handling. Alternativt forbehandles avstrykprøvemediet med NeuMoDx Viral Lysis Buffer før det plasseres på NeuMoDx System for behandling. NeuMoDx System starter automatisk behandling ved å aspirere en alikvot av avstrykmediet og blande den med NeuMoDx Lysis Buffer og stoffene i NeuMoDx Extraction Plate. NeuMoDx System automatiserer og integrerer RNA-ekstraksjon og -konsentrasjon, reagensklargjøring og nukleinsyreamplifikasjon/-detektering av målsekvensene ved hjelp av sanntids-rt-pcr. Den inkluderte prøveprosesskontrollen (Sample Process Control, SPC2) overvåker forekomst av hemmende stoffer og system-, prosess- eller reagenssvikt. Ingen operatørtiltak er nødvendige straks prøven er lastet inn på NeuMoDx System. NeuMoDx System bruker en kombinasjon av varme, lytisk enzym og ekstraksjonsreagenser til automatisk å utføre lysering, RNA-ekstraksjon og fjerning av hemmere. De frisatte nukleinsyrene innfanges av mikrosfærer med magnetisk affinitet. Mikrosfærene, med bundet nukleinsyre, lastes inn i NeuMoDx Cartridge der de ubundne elementene vaskes vekk med NeuMoDx Wash Reagent. Det bundne RNA-et elueres deretter ved hjelp av NeuMoDx Release Reagent. NeuMoDx System bruker det eluerte RNA-et til å rehydrere egenutviklede NeuDry amplification reagents som inneholder alle elementene som kreves for amplifikasjon av SARS-CoV-2- og SPC2-målene. Dette muliggjør samtidig amplifikasjon og detektering av både mål- og kontroll-rna-sekvenser. Etter rekonstitusjon av de tørkede RT-PCR-reagensene overfører NeuMoDx System den klargjorte RT-PCR-ferdigblandingen til ett PCR-kammer (per prøve) på NeuMoDx Cartridge. Omvendt transkripsjon, amplifikasjon og detektering av kontroll- og målsekvensene (hvis de er til stede) skjer i PCR-kammeret. NeuMoDx Cartridge er ment å inneholde amplikonet etter RT-PCR, noe som praktisk talt eliminerer risikoen for kontaminasjon etter amplifikasjon. S. 1 av 15
2 De amplifiserte målene detekteres i sanntid ved hjelp av hydrolyseprobekjemi (vanligvis kalt TaqMan -kjemi) ved bruk av fluorogene oligonukleotidprobemolekyler som er spesifikke for amplikonene for respektive mål. TaqMan-prober består av en fluorofor som er kovalent bundet til 5 -enden av oligonukleotidproben og en slukker i 3 -enden. Mens proben er intakt, er fluoroforen og slukkeren i nærheten, noe som fører til at slukkermolekylet undertrykker fluorescensen sluppet ut av fluoroforen via Försters resonansenergioverføring (Förster Resonance Energy Transfer, FRET). TaqMan-prober er utformet slik at de hybridiserer innenfor en DNA-region amplifisert av et spesifikt sett primere. Idet Taq DNA-polymerase forlenger primeren og syntetiserer den nye strengen, degraderer 5 til 3 eksonukleaseaktivitet av Taq DNA-polymerasen proben som har annealert til malen. Degradering av proben frisetter fluoroforen og bryter nærheten til slukkeren, noe som dermed overkommer slukkingseffekten på grunn av FRET og tillater detektering av fluoroforen. Det resulterende fluorescenssignalet detektert i NeuMoDx System kvantitativ RT-PCR termosykler er direkte proporsjonalt med den frisatte fluoroforen og kan korreleres til mengden mål som er til stede. En TaqMan-probe merket med en FAM-fluorofor (47/51 nm) brukes til å detektere NSP2-målet, og en TaqMan-probe merket med en HEX-fluorofor (53/555 nm) brukes til å detektere N-genmålet. For detektering av SPC2 er TaqMan-proben merket med en fjernrød fluorofor (68/715 nm). NeuMoDx System-programvaren overvåker fluorescenssignalet fra TaqMan-probene i slutten av hver amplifikasjonssyklus. Når amplifikasjon er fullført, analyserer NeuMoDx System-programvaren dataene og rapporterer et resultat (POSITIVE (Positivt) / NEGATIVE (Negativt) / INDETERMINATE (Ubestemt) / UNRESOLVED (Uløst)). REAGENSER/FORBRUKSARTIKLER Medfølgende materiale REF Innhold Tester per enhet Tester per pakke 38 Tørkede RT-PCR-reagenser som inneholder SARS-CoV-2-spesifikke TaqMan -prober og -primere, SPC2-spesifikke TaqMan -prober og -primere Ytterligere materialer som er nødvendige, men ikke følger med (fås separate fra NeuMoDx) REF Innhold NeuMoDx Cartridge 2 NeuMoDx Extraction Plate 4 NeuMoDx Wash Reagent 42 NeuMoDx Release Reagent 45 (Valgfritt*) NeuMoDx Lysis Buffer 2 46** NeuMoDx Lysis Buffer (Valgfritt*) NeuMoDx Viral Lysis Buffer Hamilton CO-RE-spisser (3 µl) med filtre Hamilton CO-RE-spisser ( µl) med filtre *Kreves bare hvis et forbehandlingstrinn ønskes for lysering utenfor systemet før prøver lastes inn. Se avsnittet «Bruksanvisning». **Kreves bare for direkte behandling av rene prøver. Se avsnittet «Bruksanvisning» nedenfor. Avstryk og transportmedium (ikke inkludert) Prøvetype Prøvetakingsenheter Anbefalt prøvetakingsenhet Anbefalt avstryk Nasofaryngealt avstryk Orofaryngealt avstryk Nasalt avstryk Plastapplikator med sterile rayon- og polyester-vattavstryk og nylon-vattavstryk samlet inn i UTM : Universal Transport Medium (Copan Diagnostic Inc, CA) eller UVT BD Universal Transport Medium System (UVT) (BD, NJ) 3 ml / 1 ml Universal Transport Medium (Copan UTM-RT ) eller Universal Viral Transport System (BD UVT) Nødvendige instrumenter NeuMoDx 288 Molecular System [REF 5] eller NeuMoDx 96 Molecular System [REF 52] Flexible Minitip Size Nylon Flocked Swab (Copan) eller Flexible minitip flocked swab (BD) S. 2 av 15
3 Y F 4:l28: F ADVARSLER OG FORHOLDSREGLER NeuMoDx SARS-CoV-2 Assay er bare til in vitro-diagnostikk på NeuMoDx Systems. Prøver skal alltid håndteres som om de er smittefarlige og i samsvar med sikre laboratorieprosedyrer, f.eks. beskrevet i Biosafety in Microbiological and Biomedical Laboratories 1 og i CLSI-dokument M29-A4. 2 Et positivt resultat indikerer forekomst av SARS-CoV-2-RNA. Laboratorier i USA og amerikanske territorier er pålagt å rapportere alle positive resultater til vedkommende helsemyndigheter. NeuMoDx SARS-CoV-2 Assay er begrenset til bruk av personale med opplæring i bruk av NeuMoDx System og i håndtering av smittefarlige materialer. Bruk aldri reagensene eller forbruksartiklene etter angitt utløpsdato. Ikke bruk reagenser hvis sikkerhetsforseglingen er brutt, eller hvis emballasjen er skadet ved ankomst. Ikke bruk forbruksartikler eller reagenser hvis beskyttelsesposen er åpen eller ødelagt ved ankomst. Minste prøvevolum av sekundære alikvoter er avhengig av rørstørrelsen/prøverørstransportøren som definert nedenfor. Volum under spesifisert minimum kan føre til feilen Quantity Not Sufficient (Mengde ikke tilstrekkelig). Bruk av prøver som er lagret ved feil temperatur eller lenger enn de angitte lagringstidene, kan gi ugyldige eller feilaktige resultater. Unngå mikrobe- og ribonuklease (RNase)-kontaminasjon av alle reagenser og forbruksartikler. Bruk av sterile, RNase-frie engangsoverføringspipetter med aerosolbarrierer anbefales når du bruker sekundærrør. Bruk en ny pipette for hver prøve. For å unngå kontaminasjon må du ikke håndtere eller bryte fra hverandre eventuell NeuMoDx Cartridge etter amplifikasjon. Ikke hent opp NeuMoDx Cartridges fra container for biologisk farlig avfall (NeuMoDx 288 Molecular System) eller beholder for biologisk farlig avfall (NeuMoDx 96 Molecular System) under noen omstendigheter. NeuMoDx Cartridge er beregnet på å hindre kontaminasjon. I tilfeller der PCR-tester med åpne rør også gjennomføres av laboratoriet, må det påses at NeuMoDx SARS-CoV-2 Test Strip, de ytterligere forbruksartiklene og reagensene som kreves for testing, personlig verneutstyr som hansker og laboratoriefrakker og NeuMoDx System ikke er kontaminert. Bruk rene, pulverfrie nitrilhansker ved håndtering av NeuMoDx-reagenser og -forbruksartikler. Sørg for ikke å berøre den øvre overflaten av NeuMoDx Cartridge, folieforseglingsoverflaten på NeuMoDx SARS-CoV-2 Test Strip og NeuMoDx Extraction Plate, eller den øvre overflaten på NeuMoDx Lysis Buffer-beholdere. Håndtering av forbruksartiklene og reagensene må utføres bare ved å berøre sideoverflatene. Sikkerhetsdatablader kan fås på anmodning. Vask hendene grundig når testen er fullført. Ikke pipetter gjennom munnen. Ikke røyk, drikk eller spis i områder der prøver eller reagenser blir håndtert. Kasser ubrukte reagenser og avfall i samsvar med lokale, regionale og nasjonale bestemmelser. PRODUKTLAGRING, -HÅNDTERING OG -STABILITET NeuMoDx SARS-CoV-2 Test Strips er stabile i primæremballasjen innenfor angitt utløpsdato på produktetiketten når de lagres mellom 4 og 28 C. Ikke bruk forbruksartikler og reagenser etter angitt utløpsdato. Ikke bruk testprodukt hvis primær- eller sekundæremballasjen er visuelt kompromittert. Ikke last inn igjen testprodukter som tidligere er lastet inn på et annet NeuMoDx System. Når NeuMoDx SARS-CoV-2 Test Strip er lastet inn, kan den forbli på NeuMoDx System i 14 dager. Gjenværende holdbarhet for innlastede teststrimler spores av programvaren og rapporteres til brukeren i sanntid. Systemet vil be om at en teststrimmel som har vært i bruk utenfor den tillatte perioden, blir fjernet. EKSEMPLARTAKING, -TRANSPORT OG -LAGRING Håndter alle prøver som om de vil kunne overføre smittefarlige stoffer. Prøver bør tas ved hjelp av Copan UTM-RT System eller BD UVT System. Følg produsentens anvisninger for prøvetaking, -transport og -oppbevaring: Prøvers stabilitet for behandling med NeuMoDx SARS-CoV-2 Assay er ikke evaluert. På grunnlag av bruksanvisningen for Copan UTM-RT System kan følgende angis: o Etter prøvetaking bør prøven oppbevares ved 2 25 C og behandles innen 48 timer. o Hvis levering og behandling overskrider 48 timer, bør prøver transporteres på tørris, og straks de ankommer til laboratoriet, fryses ved -7 C eller kaldere. NeuMoDx SARS-CoV-2 Assay muliggjør to forskjellige arbeidsflyter, avhengig av brukerens/laboratoriets preferanse: Arbeidsflyt 1: DIREKTE avstrykprøver lastes direkte inn på NeuMoDx System i primærprøvetakingsrør eller sekundærprøverør -eller- Arbeidsflyt 2: FORBEHANDLING avstrykprøver forbehandles med NeuMoDx Viral Lysis Buffer før de lastes inn på NeuMoDx System i primærprøvetakingsrør eller sekundærprøverør S. 3 av 15
4 Testklargjøring arbeidsflyten DIREKTE Merk: La alle prøver nå romtemperatur (15 til 3 C) før de behandles. 1. Sett prøvestrekkodeetiketten på et prøverør som er kompatibelt med NeuMoDx System. Prøvetakingsrøret for primæravstryk kan merkes og plasseres direkte i en 24-rørs prøverørstransportør med hette og avstryk fjernet. Alternativt kan en alikvot av transportmediet overføres til et sekundærrør med strekkode og plasseres i en 32-rørs prøverørstransportør. 2. Hvis prøven testes i primærprøvetakingsrøret, plasserer du røret med strekkode i en prøverørstransportør og sikrer at hetten tas av og avstryket fjernes før røret lastes inn på NeuMoDx System. 3. Hvis du bruker et sekundærrør, overfører du en alikvot av transportmediet til prøverøret med strekkode som er kompatibelt med NeuMoDx System i henhold til volumene angitt nedenfor: Prøverørstransportør (32-rørs): mm i diameter og 6 12 mm i høyde, minste fyllevolum 55 µl Prøverørstransportør (24-rørs): 14,5 18 mm i diameter og 6 12 mm i høyde, minste fyllevolum µl Prøverørstransportør for lavt volum (32-rørs): 1,5 ml mikrosentrifugerør med konisk bunn; minste fyllevolum 5 µl Testklargjøring arbeidsflyten FORBEHANDLING Merk: La alle prøver nå romtemperatur (15 til 3 C) før de behandles. ADVARSEL: Forbehandling av avstrykprøver med NeuMoDx Viral Lysis Buffer garanterer ikke at eventuelle tilstedeværende virus inaktiveres. Alle prøver bør håndteres som om de kan overføre smittefarlige stoffer. 1. Forbehandle prøvetransportmediet med et 1 : 1-volum NeuMoDx Viral Lysis Buffer. Dette kan utføres i prøvetakingsrøret for primæravstryk hvis transportmediets volum er kjent. Alternativt kan forbehandling utføres i et sekundærrør ved å kombinere en alikvot av transportmediet med et likt volum NeuMoDx Viral Lysis Buffer. Den resulterende blandingen bør oppfylle kravene til minstevolum angitt nedenfor. 2. Bland forsiktig med pipette for å sikre jevn fordeling av NeuMoDx Viral Lysis Buffer. 3. Hvis prøven testes i primærprøvetakingsrøret, plasserer du røret med strekkode i en prøverørstransportør og sikrer at hetten tas av og avstryket fjernes før røret lastes inn på NeuMoDx System. 4. Hvis du bruker et sekundærrør, overfører du en alikvot av transportmedielysatet til prøverøret med strekkode som er kompatibelt med NeuMoDx System i henhold til volumene angitt nedenfor: Prøverørstransportør (32-rørs): mm i diameter og 6 12 mm i høyde, minste fyllevolum 55 µl Prøverørstransportør (24-rørs): 14,5 18 mm i diameter og 6 12 mm i høyde, minste fyllevolum µl Prøverørstransportør for lavt volum (32-rørs): 1,5 ml mikrosentrifugerør med konisk bunn; minste fyllevolum 5 µl Bruk av NeuMoDx System Detaljerte anvisninger finnes i brukerhåndboken for NeuMoDx 288 og 96 Molecular Systems. 1. Last testorden inn på NeuMoDx System i henhold til arbeidsflyten som brukes til testklargjøring: Ubehandlede, rene avstrykprøver klargjort ved hjelp av arbeidsflyten DIREKTE testes ved å definere prøven som Transport Medium (Transportmedium) Prøver forbehandlet ved hjelp av arbeidsflyten FORBEHANDLING testes ved å definere prøven som User-Specified 1 (Brukerdefinert 1) 2. Fyll opp én eller flere teststrimmeltransportører med NeuMoDx SARS-CoV-2 Test Strip(s), og bruk trykkskjermen til å laste teststrimmeltransportøren(e) inn i NeuMoDx System. 3. Hvis NeuMoDx System-programvaren ber om det, legger du til de nødvendige forbruksartiklene på systemet (NeuMoDx Cartridges, NeuMoDx Extraction Plates, NeuMoDx Lysis Buffer 2, NeuMoDx Lysis Buffer 3, CO-RE-spisser) på forbruksartikkeltransportører på NeuMoDx System og bruker trykkskjermen til å laste inn transportør(er) i NeuMoDx System, avhengig av hva som er relevant. 4. Hvis NeuMoDx System-programvaren ber om det, må du bytte NeuMoDx Wash Reagent og/eller NeuMoDx Release Reagent, avhengig av hva som er relevant. 5. Hvis NeuMoDx System-programvaren ber om det, må du tømme primingavfallet, container for biologisk farlig avfall (bare NeuMoDx 288 Molecular System), beholderen for spissavfall (bare NeuMoDx 96 Molecular System) eller beholder for biologisk farlig avfall (bare NeuMoDx 96 Molecular System), avhengig av hva som er relevant. 6. Last prøven(e) inn i en prøverørstransportør, og kontroller at hettene er tatt av alle rørene. Plasser prøverørtransportøren(e) på autoinnlasterhyllen, og bruk trykkskjermen til å laste transportøren(e) inn i NeuMoDx System. Dette starter behandling av de innlastede prøvene for de identifiserte testene, forutsatt at en gyldig testordre finnes på systemet. S. 4 av 15
5 BEGRENSNINGER NeuMoDx SARS-CoV-2 Assay er bare evaluert for bruk på NeuMoDx Molecular Systems. NeuMoDx SARS-CoV-2 Assay er ment å detektere SARS-CoV-2-RNA i nasofaryngeale, orofaryngeale og nasale avstrykprøver tatt med Copan UTM-RT System (UTM-RT ) eller BD Universal Viral Transport System (UVT). Bruk av NeuMoDx SARS-CoV-2 Assay med andre prøvetyper er ikke vurdert, og ytelsesegenskapene er ukjent. Pålitelige resultater er avhengig av riktig prøvetaking, -håndtering og -oppbevaring. Feilaktige resultater kan skyldes feil prøvetaking, -håndtering og -oppbevaring, teknisk feil eller prøverørsforveksling. I tillegg kan falskt negative resultater forekomme fordi antallet viruspartikler i prøven er under detekteringsgrensen for NeuMoDx SARS-CoV-2 Assay. Hvis både SARS-CoV-2-målene og SPC2-målet ikke amplifiseres, rapporteres det et ugyldig resultat (Indeterminate (Ubestemt) eller Unresolved (Uløst)), og testen bør gjentas. Delesjoner eller mutasjoner i regionene som NeuMoDx SARS-CoV-2 Assay har som mål, kan påvirke detektering og føre til et feilaktig resultat. Et positivt resultat viser ikke nødvendigvis forekomst av levedyktige SARS-CoV-2. Et positivt resultat for begge målene indikerer imidlertid forekomst av SARS-CoV-2-RNA. Resultater fra NeuMoDx SARS-CoV-2 Assay bør brukes som et supplement til kliniske observasjoner og andre opplysninger som er tilgjengelige for legen. God laboratoriepraksis, herunder skifte av hansker mellom håndtering av pasientprøver, anbefales for å unngå kontaminasjon. RESULTATER Tilgjengelige testresultater kan vises i eller skrives ut fra fanen Results (Resultater) i vinduet Results (Resultater) på trykkskjermen på NeuMoDx System. Et testresultat betegnes Positive (Positivt, POS), Negative (Negativt, NEG), Indeterminate (Ubestemt, IND) eller Unresolved (Uløst, UNR) basert på amplifikasjonsstatusen for målet og prøveprosesskontrollen (Sample Process Control, SPC2). Kriterier for en positiv eller negativ betegnelse er angitt i NeuMoDx SARS-CoV-2-analysedefinisjonsfilen (Assay Definition File, ADF) som er installert på NeuMoDx System. Resultater rapporteres basert på ADF-beslutningsalgoritmen sammenfattet i tabell 1 nedenfor. Tabell 1. Tolkning av NeuMoDx SARS-CoV-2 Assay-resultater SAMLET RESULT POS MÅL 1 (NSP2-gen) FAM AMPLIFIED (AMPLIFISERT) [4 Ct < 12 AND (OG) EPR 1,2 AND (OG) EP 7] (12 Ct 4 AND (OG) EP 7) N/A () MÅL 2 (N-gen) HEX N/A () AMPLIFIED (AMPLIFISERT) [4 Ct < 12 AND (OG) EPR 1,5 AND (OG) EP ] (12 Ct 4 AND (OG) EP >) NOT AMPLIFIED (IKKE AMPLIFISERT) N/A () (4 < Ct < 12 AND (OG) EPR < 1,5) (12 Ct 4 AND (OG) EP < ) [Ct > 4] PROSESSKONTROLL (SAMPLE PROCESS CONTROL, SPC2) Q-75 N/A () Tolkning SARS-CoV-2-RNA detektert** NEG NOT AMPLIFIED (IKKE AMPLIFISERT) N/A () (4 < Ct < 12 AND (OG) EPR < 1,2) (12 Ct 4 AND (OG) EP < 7) [Ct > 4] AMPLIFIED (AMPLIFISERT) (24 Ct 33 AND (OG) EP ) SARS-CoV-2-RNA ikke detektert IND* NOT AMPLIFIED/System Errors Noted (IKKE AMPLIFISERT / systemfeil oppdaget) Alle målresultater var ugyldige. Test prøve på nytt Alle målresultater var UNR* NOT AMPLIFIED/ System Errors Noted (IKKE AMPLIFISERT / ingen systemfeil oppdaget) ugyldige. Test prøve på nytt *Systemet er utstyrt med automatisk funksjon for Rerun (Ny kjøring) / Repeat (Gjentatt) testing som sluttbrukeren kan velge å bruke for å sikre at en prøve med et resultat av typen IND (Ubestemt) / UNR (Uløst) automatisk behandles på nytt for å minimere forsinkelser i resultatrapporteringen. **En gjentatt test kan utføres om ønskelig hvis bare ett av de to SARS-CoV-2-målene blir amplifisert. S. 5 av 15
6 Et positivt resultat kan rapporteres for prøver som gir en differensialamplifikasjonsstatus, hvor bare ett av målene mål 1 (NSP2-gen) eller mål 2 (N-gen) amplifiseres. Dette kan skje på grunn av 1) en prøve ved konsentrasjoner nær eller under testens detekteringsgrense, 2) en mutasjon i en av målregionene eller 3) andre faktorer. Ved en positiv test der bare ett av målene amplifiseres, kan det vurderes å gjenta testingen hvis SPC2-kontrollen er negativ. Hvis resultatet av den gjentatte testingen også er det samme, må det utføres ytterligere bekreftelsestesting hvis det er klinisk indisert. Ugyldige resultater Hvis et NeuMoDx SARS-CoV-2 Assay utført på NeuMoDx System ikke gir et gyldig resultat, rapporteres det som enten Indeterminate (Ubestemt) eller Unresolved (Uløst) basert på typen feil som har oppstått, og testen bør gjentas for å oppnå et gyldig resultat. Et resultat av typen Indeterminate (Ubestemt) rapporteres hvis det detekteres en NeuMoDx System-feil under prøvebehandling. Hvis det rapporteres et resultat av typen Indeterminate (Ubestemt), anbefales det å gjenta testen. Et resultat av typen Unresolved (Uløst) rapporteres hvis ingen mål detekteres og det ikke er noen amplifikasjon av prøveprosesskontrollen, noe som angir mulig reagenssvikt eller forekomst av hemmere. Hvis det rapporteres et resultat av typen Unresolved (Uløst), anbefales det å gjenta testen som et første trinn. Hvis den gjentatte testen underkjennes, kan en fortynnet prøve brukes til å dempe effekten av eventuell hemming. Kvalitetskontroll 1. Kontrollmateriale leveres ikke av NeuMoDx Molecular, Inc. Egnede kontroller må velges og valideres av laboratoriet. Merk at kontrollene må oppfylle samme minstekrav til volum som kliniske prøver angitt ovenfor basert på prøverørstransportørens størrelse. Følgende anbefales som kontrollmateriale: Positive kontroller: o 5 µl NATtrol SARS-CoV-2 (recombinant) Stock (ZeptoMetrix katalognr ) i 1 ml BD UVT-medium. o 5 µl 219-nCoV_N_Positive Control (Integrated DNA Technologies katalognr. 6625) i 1 ml BD UVT-medium. o BD UVT-medium tilsatt 2 kopier/ml SARS-CoV-2-genomisk RNA (BEI Resources NR-52285) og 2 µg/ml gjær-trna (ThermoFisher katalognr. AM7119). Merk: Dette alternativet bør bare brukes når kontroller klargjøres med arbeidsflyten FORBEHANDLING. o Fortynnet klinisk positiv prøve. Negativ kontroll: BD UVT-medier eller tilsvarende. 2. Hvis kontroller behandles, må de merkede kontrollene plasseres i en prøverørstransportør og trykkskjermen brukes til å laste transportøren inn i NeuMoDx System fra autoinnlasterhyllen. Når kontrollene er definert, gjenkjenner NeuMoDx System strekkodene og starter å behandle kontrollene. 3. Det anbefales at brukere behandler et sett positive og negative kontroller hver 24. time og før pasientprøver behandles. 4. Spesifikke primere og spesifikk probe for prøveprosesskontrollen (Sample Process Control, SPC2) er inkludert i hver NeuMoDx SARS-CoV-2 Test Strip. Denne prøveprosesskontrollen gjør det mulig for NeuMoDx System å overvåke effekten av RNA-ekstraksjonen og RT-PCR-amplifikasjonsprosessene. 5. Før RT-PCR utfører NeuMoDx System automatisk en FILL CHECK (Påfyllingskontroll) for å sikre at PCR-kammeret er fylt med løsning og inneholder en tilstrekkelig mengde fluorescerende probe. 6. NeuMoDx System-programvaren overvåker kontinuerlig sensorer og aktuatorer på systemet for å sikre at systemet fungerer sikkert og effektivt. 7. Flere gjenopprettingsmoduser for fluidikkfeil er implementert ved aktiv overvåking av aspirasjons- og overføringsoperasjoner for å sikre at systemet enten kan fullføre behandlingen av alle prøver på en sikker og effektiv måte eller oppgi en relevant feilkode. 8. NeuMoDx System er utstyrt med automatisk funksjon for Rerun (Ny kjøring) / Repeat (Gjentatt) testing som sluttbrukeren kan velge å bruke for å sikre at en prøve med et resultat av typen INVALID (Ugyldig) automatisk behandles på nytt for å minimere forsinkelser i resultatrapporteringen. 9. Et Positive (Positivt) testresultat som rapporteres for en negativ kontrollprøve, angir et prøvekontaminasjonsproblem. Se brukerhåndboken for NeuMoDx 288 eller 96 Molecular System for feilsøkingstips. 1. Et Negative (Negativt) resultat rapportert for en positiv kontrollprøve kan indikere at det er et reagens- eller NeuMoDx System-relatert problem. Se brukerhåndboken for NeuMoDx 288 eller 96 Molecular System for feilsøkingstips. YTELSESEGENSKAPER Analytisk sensitivitet Detekteringsgrensen (Limit of Detection, LoD) for NeuMoDx SARS-CoV-2 Assay ble bestemt ved å teste en fortynningsserie av grupperte negative kliniske nasofaryngeale avstrykprøver tilsatt SARS-CoV-2-genomisk RNA (BEI Resources NR-52285) og behandlet ved hjelp av begge arbeidsflytene, DIREKTE og FORBEHANDLING. Minst tjue replikater av hver fortynning ble evaluert på begge NeuMoDx Systems for hver arbeidsflyt. LoD ble bestemt til å være 15 kopier/ml. S. 6 av 15
7 Tabell 2. Detekteringsrate og detekteringsgrense for SARS-CoV-2 på NeuMoDx 96 Molecular System: Arbeidsflyten Forbehandling LoD for SARS-CoV-2: N96, arbeidsflyten Forbehandling Målnivå Gyldige resultater Positiv for NSP2-gen Positiv for N-gen Detekteringsrate for NSP2-gen n n Detekteringsrate for N-gen Rate for amplifikasjon av begge mål 25 cp/ml ,7 % 22 3,9 % % 15 cp/ml ,5 % 2 31, % % 5 cp/ml 24 % 22 31,8 91,7 % % Negativ 3 % % % LoD for N96: 15 cp/ml [laveste målnivå som viser > 95 % detekteringsrate for begge mål] Tabell 3. Detekteringsrate og detekteringsgrense for SARS-CoV-2 på NeuMoDx 288 Molecular System: Arbeidsflyten Forbehandling LoD for SARS-CoV-2: N288, arbeidsflyten Forbehandling Målnivå Gyldige resultater Positiv for Positiv for N-gen NSP2-gen Detekteringsrate for NSP2-gen n n Detekteringsrate for N-gen Rate for amplifikasjon av begge mål 25 cp/ml ,1 % 21 31,4 % % 15 cp/ml ,7 % 26 31,2 % % 5 cp/ml ,2 52,4 % 2 32,2 95,2 % 52,4 % Negativ 2 % % % LoD for N288: 15 cp/ml [laveste målnivå som viser > 95 % detekteringsrate for begge mål] Tabell 4. Detekteringsrate og detekteringsgrense for SARS-CoV-2 på NeuMoDx 96 Molecular System: Arbeidsflyten Direkte LoD for SARS-CoV-2: N96, arbeidsflyten Direkte Målnivå Gyldige resultater Positiv for Positiv for N-gen NSP2-gen Detekteringsrate for NSP2-gen n n Detekteringsrate for N-gen Rate for amplifikasjon av begge mål 4 cp/ml 24 23* 32,4 95,8 % 24 31,1, % 95,8 % 25 cp/ml ,, % 24 31,7, %, % 15 cp/ml ,4, % 24 32,4, %, % 5 cp/ml ,6 5, % 18 32,8 75, % 41,7 %** Negativ 22 % % % LoD for N96: 15 cp/ml [laveste målnivå som viser > 95 % detekteringsrate for begge mål] *Denne prøven viste dessuten svak SPC2-amplifikasjon, og mangelen på amplifikasjon ble antatt å være en artefakt av systembehandling. Dette støttes av en % detekteringsrate ved samme målkonsentrasjon i RPT-855B (klinisk evaluering). For denne studien oppnås dessuten en % detekteringsrate ved de lavere konsentrasjonene 25 cp/ml og 15 cp/ml. ** 1 av 24 prøver fikk begge målene påvist ved 5 cp/ml, for en samlet positivitetsrate på 41,7 % S. 7 av 15
8 Tabell 5. Detekteringsrate og detekteringsgrense for SARS-CoV-2 på NeuMoDx 288 Molecular System: Arbeidsflyten Direkte Målnivå Gyldige resultater LoD for SARS-CoV-2: N288, arbeidsflyten Direkte Positiv for NSP2-gen Detekteringsrate Positiv for N-gen for NSP2-gen n n Detekteringsrate for N-gen Rate for amplifikasjon av begge mål 4 cp/ml ,8, % 24 31,7, %, % 25 cp/ml ,, % 24 32,, %, % 15 cp/ml ,5 95,5 % 22 32,4, % 95,5 % 5 cp/ml ,3 83,3 % 24 33,4, % 83,3 % Negativ 24, %, %, % LoD for N288: 15 cp/ml [laveste målnivå som viser > 95 % detekteringsrate for begge mål] Inklusivitet Inklusiviteten til NeuMoDx SARS-CoV-2 Assay ble evaluert ved in silico-analyse som tilordner analyseprimerne og -probene til alle tilgjengelig e SARS-CoV-2-sekvenser (n = 96) i NCBI-databasen per 14. mars 22. Regionene på testens primere og prober ble sammenlignet med in silico-analyse for å verifisere sekvenshomologi med sirkulerende SARS-CoV-2-stammer. NeuMoDx SARS-CoV-2 Assay hadde % homologi med alle unntatt én sekvens for NSP2-genet (mål 1). Denne ene sekvensen ble funnet å ha ett uoverensstemmende nukleotid i den venstre primeren uten forutsett påvirkning på analysens ytelse. Homologi mellom N-genets (mål 2) primere og probe ble funnet å være % for alle de tilgjengelige sekvensene. Kryssreaktivitet NeuMoDx SARS-CoV-2 Assay ble evaluert in silico for mulige kryssreaksjoner med mikroorganismene som vises i tabell 6 ved individuelt å tilordne primerne og probene for NeuMoDx SARS-CoV-2 Assay til sekvenser i NCBI-databasen. Ingen av de analyserte sekvensene viste homologi for primerne eller proben for NSP2-genet (mål 1). Haemophilus influenzae (CP672.1) viste homologi med den venstre primeren for N-genet (mål 2), men hadde ingen vesentlig homologi med den høyre primeren og proben. Likeledes viste SARS-koronavirus (AY ) homologi for den venstre primeren og proben for N-genet, men ingen vesentlig homologi for den høyre primeren. Pseudomonas aeruginosa (CP438.1) viste homolog i for den venstre SPC2-primeren, men ikke for noen av SARS-CoV-2-målene.In silico-analyse viste derfor ingen sannsynlig kryssreaktivitet for noen av de evaluerte sekvensene. Ytterligere våttesting ble utført for å bekrefte at H. influenzae og P. aeruginosa ikke utgjorde noen risiko for kryssreaktivitet eller mikrobiell interferens, der resultatene presenteres i tabell 7 og 8. Tabell 6. In silico-analyse for kryssreaktive organismer Organisme NCBI GenBankaksesjonsnumre Organisme NCBI GenBankaksesjonsnumre Humant koronavirus 229E KF Influensa B MK KF Enterovirus JF Humant koronavirus OC43 KX Respiratorisk syncytialvirus JN KF Rhinovirus NC_149.1 Humant koronavirus HKU1 KF Chlamydia pneumoniae NZ_LN MH Haemophilus influenzae CP672.1 Humant koronavirus NL63 KF Legionella pneumophila CP KF Mycobacterium tuberculosis AP SARS-koronavirus AY Streptococcus pneumoniae CP Streptococcus pyogenes AE MERS-koronavirus MH Bordetella pertussis CP Adenovirus AC_17.1 Mycoplasma pneumoniae CP Humant metapneumovirus (hmpv) KJ Pneumocystis jirovecii (PJP) MH Parainfluensavirus 1 KX Candida albicans NC_ Parainfluensavirus 2 KM Pseudomonas aeruginosa CP438.1 Parainfluensavirus 3 KF Staphylococcus epidermis KY Parainfluensavirus 4 KF Streptococcus salivarius CP Influensa A MH S. 8 av 15
9 Tabell 7. Kryssreaktivitet og interferenstesting for H. Influenzae PRØVE Gyldige resultater Antall positivt N-gen % positivt N-gen (gult) Ct-snitt N-gen Antall positivt NSP2-gen % positivt NSP2-gen (grønt) Ct-snitt NSP2-gen SPC2 Ct snitt Kryssreaktivitet Interferens Ren UVT (Kontroll, negativ) UVT+H. Influenzae (7,2E6 CFU/ml) Ren UVT + SARS- CoV-2 RNA (75 kopier/ml) (Kontroll, positiv) UVT+H. Influenzae (7,2E6 CFU/ml) + SARS-CoV-2 RNA (75 kopier/ml) 3 % % 27,7 3 % % 28,3 3 3 % 32,3 3 % 34,5 27,8 3 3 % 32,45 3 % 33,98 27,7 Tabell 8. Kryssreaktivitet og interferenstesting for P. aeruginosa PRØVE Gyldige resultater N-gen (HEX) NSP2-gen (FAM) SPC2 (fjernrød) Pos. % pos. Pos. % pos. Kryssreaktivitet UVT+P. aeruginosa (1 E 6 CFU/ml) 3 % % 27,5 Interferens Ren UVT (kontroll) Positiv UVT + P. aeruginosa (1 E 6 CFU/ml) + SARS-CoV-2 RNA (45 kopier/ml) 3 3 % 3,3 3 % 32, 26,9 3 3 % 3,4 3 % 32, 27, Interfererende stoffer NeuMoDx SARS-CoV-2 Assay ble evaluert for mottakelighet for interferens forårsaket av stoffer som potensielt er assosiert med innsamling av nasofaryngeale avstrykprøver. Resterende kliniske negative nasofaryngeale avstrykprøver ble tilsatt SARS-CoV-2-genomisk RNA (BEI Resources NR-52285) ved 5X LoD og behandlet i nærvær og fravær av stoffene som vises nedenfor i tabell 9. Ingen stoffer inkludert i testingen påvirket analyseytelsen. Tabell 9. Stoffer testet for mulig interferens Stoff Konsentrasjon* Endogen Mucin Blod,5 % (w/v) 2 % (v/v) Afrin Original (oksymetazolin) 15 % (v/v) Zicam Cold Remedy Nasal Spray 5 % (v/v) Flonase Allergy Relief (flutikason) 5 % (v/v) Beklometason 1 mg/ml Mupirocin 11,4 mg/ml Relenza (zanamivir) 5,25 mg/ml Tamiflu (oseltamivir) 7,5 mg/ml Tobramycin 1,8 mg/ml *Merk: De viste konsentrasjonene er de konsentrasjonene som brukes til å mette avstryk før konstruerte positive kliniske prøver doseres med interfererende stoff. De representerer derfor det nivået på avstrykinnsamlingsstedet som kan tolereres. Eksogen S. 9 av 15
10 Reproduserbarhet Reproduserbarhet i laboratoriet for NeuMoDx SARS-CoV-2 Assay ble kontrollert med retrospektiv analyse av ytelse ved hjelp av negative og konstruerte positive kliniske nasofaryngeale avstrykprøver. Dataene sammenfattet i tabell 1a c representerer testing utført av flere operatører på to instrumenter i løpet av en tre dagers periode. Resultater av prøver klargjort med begge arbeidsflytene, DIREKTE og FORBEHANDLING, er gjengitt. SARS-CoV-2-nivå (cp/ml) Tabell 1a. Samlet reproduserbarhet og presisjon med NeuMoDx SARS-CoV-2 Assay N-mål NSP2-mål SPC2 N % positiv Ct-snitt Ct %CV % positiv Ct-snitt Ct %CV % positiv Ct-snitt Ct %CV 2 16 % 29,3 2,1 % % 3,7 2,4 % % 27,1 2,1 % 14 % 29,9 2,1 % % 31,2 2,6 % % 27,1 2,3 % 5 28 % 3,9 2,2 % % 32, 2,8 % % 27,3 1,6 % 4 77 % 31,2 2,1 % 99 % 32,4 2,2 % % 27,2 1,7 % % 31,5 2,1 % % 32,4 2,6 % % 27,4 1,6 % % 31,1 1,8 % % 31,6 1,7 % % 27,1 2, % 178 % % % 27,5 2,6 % Tabell 1b. Reproduserbarhet og presisjon med NeuMoDx SARS-CoV-2 Assay NeuMoDx 288 Molecular System NeuMoDx 96 Molecular System Mål Nivå (cp/ml) N % positiv Ct-snitt Ct %CV N % positiv Ct-snitt Ct %CV 2 12 % 29,3 2,3 % 4 % 29,3 1,4 % 11 % 3, 2, % 3 % 29,5 1,6 % N-mål 5 21 % 3,8 2,2 % 7 % 31,1 1,7 % 4 46 % 31,2 2,3 % 31 % 31,1 1,9 % % 31,7 2, % 46 % 31,3 2, % % 31,2 1,6 % 2 % 31, 1,9 % 2 12 % 3,7 2,3 % 4 % 3,8 2,6 % 11 % 31,3 2,5 % 3 % 26,8,4 % NSP2-mål 5 21 % 31,9 2,9 % 7 % 32,1 2, % 4 46 % 32,4 2,4 % % 32,3 2, % % 32,6 2,3 % 46 % 32,3 2,8 % % 31,7 1,8 % 2 % 31,5 1,6 % S. 1 av 15
11 Tabell 1c. Samlet reproduserbarhet og presisjon med NeuMoDx SARS-CoV-2 Assay Arbeidsflyten DIREKTE Arbeidsflyten FORBEHANDLING Mål Nivå (cp/ml) N % positiv Ct-snitt Ct %CV N % positiv Ct-snitt Ct %CV N-mål NSP2-mål 2 8 % 29,7,8 % 8 % 28,8 1,9 % 7 % 3,5,7 % 7 % 29,4 1,2 % 5 15 % 31,3 1,3 % 13 % 3,3 1,4 % 4 63 % 31,4 1,8 % 14 % 3,3 1, % % 31,9 1,5 % 43 % 31,1 2, % 2 8 % 31,2 1,3 % 8 % 3,1 1,9 % 7 % 31,9,6 % 7 % 3,4 1,5 % 5 15 % 32,6 1,6 % 13 % 31,3 2,2 % % 32,6 1,6 % 14 % 31,4 2, % % 33, 1,8 % 43 % 31,9 2,2 % Klinisk ytelse Ytelsen til NeuMoDx SARS-CoV-2 Assay ble evaluert med resterende kliniske nasofaryngeale avstrykprøver ved hjelp av et panel med 82 negative kliniske prøver og 87 konstruerte positive kliniske prøver tidligere sendt til testing for influensa og/eller respiratorisk syncytialvirus fra pasienter med tegn og symptomer på øvre luftveisinfeksjon. Positive konstruerte prøver ble klargjort ved å tilsette SARS-CoV-2-genomisk RNA (BEI Resources NR-52285) i negative kliniske prøver. Av de 87 konstruerte positive prøvene var 57 ved konsentrasjoner 1 2X LoD, og 3 var ved konsentrasjoner 4 8X LoD. Prøver ble behandlet ved hjelp av begge arbeidsflytene, DIREKTE og FORBEHANDLING, på begge NeuMoDx Systems. Alle positive prøver ble rapportert positive, og alle negative prøver ble rapportert negative, som angitt i tabell nedenfor. Tabell 11. Sammendrag av testplan for klinisk evaluering av arbeidsflyten Forbehandling Konstruert panelmedlem Positiv Positiv SARS-CoV-2-RNA-kons. 225 cp/ml (1,5 x LoD) 4 cp/ml (2-3 x LoD) Individuelle konstruerte positive prøver Testet på N288 Testet på N96 Sum testresultater Positiv 5 cp/ml Positiv cp/ml Positiv 2 cp/ml Testresultater for konstruerte positive prøver: 66* Negativ ** * MERK: 66 positive testresultater fra 54 individuelle kliniske konstruerte positive prøver. ** MERK: 49 negative testresultater fra 3 individuelle kliniske negative prøver. Sum testresultater: 115 S. 11 av 15
12 Tabell 12. Forbehandlede prøver kun på NeuMoDx 288 Molecular System Arbeidsflyten Forbehandling: NeuMoDx 288 Molecular System Mål 1 (NSP2-gen) Mål 2 (N-gen) Prøvekonsentrasjon n % positiv % positiv 225 c/ml 12 32,5 ~1,5 x LoD (75,6 99,9) (75,6 99,9) 4 c/ml 11 31,4 ~2,7 x LoD (74, 99,9) (74, 99,9) 5 c/ml 1 31,2 ~3,3 x LoD (72,1 99,9) (72,1 99,9) c/ml 5 3,5 (56,4 99,9) (56,4 99,9) 2 c/ml 6 3,2 (6,8 99,9) (6,8 99,9) Negativ 29 () () Ytelse sammenlignet med de forventede resultatene er: Positivt prosentvis samsvar: 44/44 = % (95 % CI: 91,9 %) Negativt prosentvis samsvar: 29/29 = % (95 % CI: 88,2 %) 32,2 3,2 3,2 29,4 28,8 Prøvekonsentrasjon 225 c/ml ~1,5 x LoD 4 c/ml ~2,7 x LoD 5 c/ml ~3,3 x LoD Tabell 13. Forbehandlede prøver kun på NeuMoDx 96 Molecular System Arbeidsflyten Forbehandling: NeuMoDx 96 Molecular System n Mål 1 (NSP2-gen) % positiv Mål 2 (N-gen) % positiv 12 (75,6 99,9) 32, (75,6 99,9) 31,5 3 (43,7 99,8) 31,2 (43,7 99,8) 3,4 3 (43,7 99,8) 31,5 (43,7 99,8) 3,6 c/ml 2 (34,2 99,8) 3,2 (34,2 99,8) 29,2 2 c/ml 2 (34,2 99,8) 3,1 (34,2 99,8) 28,9 Negativ 2 () () Ytelse sammenlignet med de forventede resultatene er: Positivt prosentvis samsvar: 22/22 = % (95 % CI: 85, %) Negativt prosentvis samsvar: 2/2 = % (95 % CI: 83,8 %) S. 12 av 15
13 Tabell 14. Sammendrag av testplan for klinisk evaluering av NeuMoDx SARS-CoV-2 arbeidsflyten Direkte Konstruert panelmedlem Positiv Positiv SARS-CoV-2-RNA-kons. 225 cp/ml (1,5 x LoD) 4 cp/ml (2-3 x LoD) Individuelle konstruerte positive prøver Testet på N288 Testet på N96 Sum testresultater Positiv 5 cp/ml Positiv cp/ml Positiv 2 cp/ml Testresultater for konstruerte positive prøver: 69* Negativ ** * MERK: 69 positive testresultater fra 57 individuelle kliniske konstruerte positive prøver. ** MERK: 33 negative testresultater fra 33 individuelle kliniske negative prøver. Sum testresultater: 12 Tabell 15. Prøver med arbeidsflyten Direkte kun på NeuMoDx 288 Molecular System Arbeidsflyten Direkte: NeuMoDx 288 Molecular System Mål 1 (NSP2-gen) Mål 2 (N-gen) Prøvekonsentrasjon n % positiv % positiv 225 c/ml 12 33,8 ~1,5 x LoD (75,6 99,9) (75,6 99,9) 4 c/ml 11 32,4 ~2,7 x LoD (74, 99,9) (74, 99,9) 5 c/ml 11 32,5 ~3,3 x LoD (74, 99,9) (72,1 99,9) c/ml 6 31,9 (6,8 99,9) (56,4 99,9) 2 c/ml 6 31,1 (6,8 99,9) (6,8 99,9) Negativ 33 () () Ytelse sammenlignet med de forventede resultatene er: Positivt prosentvis samsvar: 46/46 = % (95 % CI: 92,2 %) Negativt prosentvis samsvar: 33/33 = % (95 % CI: 89,5 %) Tabell 16. Prøver med arbeidsflyten Direkte kun på NeuMoDx 96 Molecular System Prøvekonsentrasjon 225 c/ml ~1,5 x LoD 4 c/ml ~2,7 x LoD 5 c/ml ~3,3 x LoD Arbeidsflyten Direkte: NeuMoDx 96 Molecular System n c/ml 1 2 c/ml 2 Negativ Mål 1 (NSP2-gen) % positiv (75,6 99,9) (5,9 99,9) (5,9 99,9) (2,7 99,8) (34,2 99,8) () 33,4 32,7 32,6 31,9 31,5 Mål 2 (N-gen) % positiv (75,6 99,9) (5,9 99,9) (5,9 99,9) (2,7 99,8) (34,2 99,8) () Ytelse sammenlignet med de forventede resultatene er: Positivt prosentvis samsvar: 23/23 = % (95 % CI: 85,6 %) Negativt prosentvis samsvar: 32,7 31,1 31,3 3,5 29,7 32,3 31,7 31,5 3,2 29,7 S. 13 av 15
14 NeuMoDx SARS-CoV-2 Assay ble evaluert mot ytelsen til komparatoranalyser som det amerikanske FDA tidligere har godkjent til akutt bruk. Intern og ekstern testing ble utført via en enkeltblindet studie av avidentifiserte, kliniske nasofaryngeale restprøver fra symptomatiske pasienter og sendt til testing for SARS-CoV-2. I alt 71 prøver ble behandlet ved hjelp av NeuMoDx SARS-CoV-2 Assay over flere NeuMoDx Systems og benyttet både arbeidsflyten FORBEHANDLING og DIREKTE. Resultater av NeuMoDx SARS-CoV-2 Assay var i fullstendig samsvar med resultater fra komparatoranalyser for alle kliniske prøver testet i metodekorrelasjonsstudien (tabell 17 og 18). Tabell 17. Resultater fra kvalitativ metodesammenligning for NeuMoDx SARS-CoV-2 Assay mot referansetester arbeidsflyten FORBEHANDLING Arbeidsflyten FORBEHANDLING CDC 219-nCoV RT-PCR Diagnostic Panel eller New York SARS-CoV-2 RT-PCR Diagnostic Panel Pos. Neg. Totalt Pos NeuMoDx SARS-CoV-2 Assay Neg Totalt Klinisk sensitivitet % (95 % CI 87, %) Klinisk spesifisitet % (95 % CI 79,5 99,9 %) Tabell 18. Resultater fra kvalitativ metodesammenligning for NeuMoDx SARS-CoV-2 Assay mot referansetester arbeidsflyten DIREKTE Arbeidsflyten DIREKTE CDC 219-nCoV RT-PCR Diagnostic Panel Pos. Neg. Totalt Pos NeuMoDx SARS-CoV-2 Assay Neg Totalt Klinisk sensitivitet % (95 % CI 79,5 99,9 %) Klinisk spesifisitet % (95 % CI 79,5 99,9 %) REFERANSER 1. Centers for Disease Control and Prevention. Biosafety in Microbiological and Biomedical Laboratories, 5 th edition. HHS Publication No. (CDC) , Revised December Clinical and Laboratory Standards Institute (CLSI). Protection of Laboratory Workers from Occupationally Acquired Infections; Approved Guideline Fourth Edition. CLSI document M29-A4; May 214. VAREMERKER NeuMoDx og NeuDry er varemerker som tilhører NeuMoDx Molecular, Inc. Afrin er et registrert varemerke som tilhører Bayer AG. BD er et varemerke som tilhører Becton, Dickinson and Company. Flonase er et registrert varemerke som tilhører GlaxoSmithKline plc. Hamilton er et registrert varemerke som tilhører Hamilton Company. Relenza er et registrert varemerke som tilhører GlaxoSmithKline plc. Tamiflu er et registrert varemerke som tilhører Genentech USA, Inc. TaqMan er et registrert varemerke som tilhører Roche Molecular Systems, Inc. UTM-RT er et registrert varemerke som tilhører Copan Diagnostics Inc. Zicam er et registrert varemerke som tilhører Matrixx Initiatives, Inc. Alle andre produktnavn, varemerker og registrerte varemerker som kan forekomme i dette dokumentet, tilhører respektive eiere. S. 14 av 15
15 SYMBOL Rx only M V y h g H l m D X i Y F C SYMBOLER BETYDNING Reseptpliktig Produsent Medisinsk utstyr til in vitro-diagnostikk Autorisert representant i EU Katalognummer Partinummer Siste forbruksdato Temperaturbegrensning Fuktighetsbegrensning Skal ikke gjenbrukes Inneholder nok til <n> tester Se bruksanvisningen Forsiktig Biologisk fare CE-merke M NeuMoDx Molecular, Inc. 125 Eisenhower Place Ann Arbor, MI 4818, USA NMDX (6639) techsupport@neumodx.com Overvåkingsrapportering: y Emergo Europe B.V. Prinsessegracht AP, The Hague The Netherlands C Patent: S. 15 av 15
RespiFinder RG Panel. Ytelsesegenskaper. November Sample & Assay Technologies. Deteksjonsgrense (LOD)
 RespiFinder RG Panel Ytelsesegenskaper Håndbok for RespiFinder RG Panel versjon1, 4692163 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/p/respifinder-rg-panel-ce før testen utføres.
RespiFinder RG Panel Ytelsesegenskaper Håndbok for RespiFinder RG Panel versjon1, 4692163 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/p/respifinder-rg-panel-ce før testen utføres.
Bruk av genteknologiske analyser ved diagnostikk av luftveisinfeksjoner. Gardermoen 27.02.08. Svein Arne Nordbø
 Bruk av genteknologiske analyser ved diagnostikk av luftveisinfeksjoner Gardermoen 27.2.8 Svein Arne Nordbø Aktuelle genteknologiske metoder Hybridiseringsmetoder Ampifikasjonsmetoder PCR Konvensjonell
Bruk av genteknologiske analyser ved diagnostikk av luftveisinfeksjoner Gardermoen 27.2.8 Svein Arne Nordbø Aktuelle genteknologiske metoder Hybridiseringsmetoder Ampifikasjonsmetoder PCR Konvensjonell
Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artushcvrgpcrkitce.aspx før testen utføres.
 artus HCV QS-RGQ Kit Ytelsesegenskaper artus HCV QS-RGQ Kit, versjon 1, 4518363, 4518366 Versjonstyring Dette dokumentet er artus HCV QS-RGQ-sett ytelsesegenskaper, versjon 1, R3. Se etter nye elektroniske
artus HCV QS-RGQ Kit Ytelsesegenskaper artus HCV QS-RGQ Kit, versjon 1, 4518363, 4518366 Versjonstyring Dette dokumentet er artus HCV QS-RGQ-sett ytelsesegenskaper, versjon 1, R3. Se etter nye elektroniske
NeuMoDx CT/NG Test Strip BRUKSANVISNING
 FORSIKTIG: Ikke tilgjengelig for kommersielt salg i USA Rx only Til in vitro-diagnostikk med NeuMoDx 288 og NeuMoDx 96 Molecular System TILTENKT BRUK Detaljerte anvisninger finnes i brukerhåndboken for
FORSIKTIG: Ikke tilgjengelig for kommersielt salg i USA Rx only Til in vitro-diagnostikk med NeuMoDx 288 og NeuMoDx 96 Molecular System TILTENKT BRUK Detaljerte anvisninger finnes i brukerhåndboken for
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Instruksjoner for legen Til in vitro diagnostisk bruk. Bare for eksport fra USA. Instruksjoner 1. Det kan være nyttig å be pasienten drikke mye vann (omtrent
PROGENSA PCA3 Urine Specimen Transport Kit Instruksjoner for legen Til in vitro diagnostisk bruk. Bare for eksport fra USA. Instruksjoner 1. Det kan være nyttig å be pasienten drikke mye vann (omtrent
Progensa PCA3 Urine Specimen Transport Kit
 Instruksjoner for legen Progensa PCA3 Urine Specimen Transport Kit Til in vitro diagnostisk bruk. Bare for eksport fra USA. Instruksjoner 1. Det kan være nyttig å be pasienten drikke mye vann (omtrent
Instruksjoner for legen Progensa PCA3 Urine Specimen Transport Kit Til in vitro diagnostisk bruk. Bare for eksport fra USA. Instruksjoner 1. Det kan være nyttig å be pasienten drikke mye vann (omtrent
Luftveisinfeksjoner - PCR-basert diagnostikk. Anne-Marte Bakken Kran Overlege, førsteamanuensis Mikrobiologisk avd. UOS Ullevål
 Luftveisinfeksjoner - PCR-basert diagnostikk Anne-Marte Bakken Kran Overlege, førsteamanuensis Mikrobiologisk avd. UOS Ullevål Temaer PCR-basert mikrobiologisk diagnostikk Klinisk betydning av funn/fravær
Luftveisinfeksjoner - PCR-basert diagnostikk Anne-Marte Bakken Kran Overlege, førsteamanuensis Mikrobiologisk avd. UOS Ullevål Temaer PCR-basert mikrobiologisk diagnostikk Klinisk betydning av funn/fravær
Brukes til preparering og isolering av rensede lymfocytter direkte fra helblod PAKNINGSVEDLEGG. Brukes til in vitro diagnostikk PI-TT.
 Brukes til preparering og isolering av rensede lymfocytter direkte fra helblod PAKNINGSVEDLEGG Brukes til in vitro diagnostikk PI-TT.610-NO-V5 Brukerveiledning Bruksområde T-Cell Xtend-reagenset er beregnet
Brukes til preparering og isolering av rensede lymfocytter direkte fra helblod PAKNINGSVEDLEGG Brukes til in vitro diagnostikk PI-TT.610-NO-V5 Brukerveiledning Bruksområde T-Cell Xtend-reagenset er beregnet
QIAsymphony SP protokollark
 QIAsymphony SP protokollark PC_AXpH_HC2_V1_DSP-protokoll Tilsiktet bruk Til in vitro-diagnostisk bruk. Denne protokollen ble utviklet til bruk med cervikalprøver som lagres i PreservCyt -løsning ved bruk
QIAsymphony SP protokollark PC_AXpH_HC2_V1_DSP-protokoll Tilsiktet bruk Til in vitro-diagnostisk bruk. Denne protokollen ble utviklet til bruk med cervikalprøver som lagres i PreservCyt -løsning ved bruk
7900003 24 tester Circulating Tumor Cell Control Kit
 7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
Monosed SR Vakuumrør BRUKERVEILEDNING
 Monosed SR Vakuumrør BRUKERVEILEDNING Manual kode MAN-133-nb Revisjon 01 Revidert dato: November 2015 Bruksanvisning for in vitro diagnostiske instrumenter for profesjonell bruk PRODUKTNAVN PRODUKTET DELENUMMER
Monosed SR Vakuumrør BRUKERVEILEDNING Manual kode MAN-133-nb Revisjon 01 Revidert dato: November 2015 Bruksanvisning for in vitro diagnostiske instrumenter for profesjonell bruk PRODUKTNAVN PRODUKTET DELENUMMER
Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve
 Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve For rensing av genomisk DNA fra innsamlingssett i seriene Oragene og ORAcollect. Du finner flere språk og protokoller på vårt nettsted,
Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve For rensing av genomisk DNA fra innsamlingssett i seriene Oragene og ORAcollect. Du finner flere språk og protokoller på vårt nettsted,
QIAsymphony SP protokollark
 QIAsymphony SP protokollark DNA_Blood_400_V6_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra friskt eller
QIAsymphony SP protokollark DNA_Blood_400_V6_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra friskt eller
QIAsymphony DSP sirkulerende DNA-sett
 QIAsymphony DSP sirkulerende DNA-sett Februar 2017 Ytelsesegenskaper 937556 Sample to Insight Innhold Ytelsesegenskaper... 4 Grunnleggende ytelse... 4 Kjøringspresisjon... 6 Tilsvarende ytelse av 2 ml
QIAsymphony DSP sirkulerende DNA-sett Februar 2017 Ytelsesegenskaper 937556 Sample to Insight Innhold Ytelsesegenskaper... 4 Grunnleggende ytelse... 4 Kjøringspresisjon... 6 Tilsvarende ytelse av 2 ml
Leucosep-rør LTK.615 PAKNINGSVEDLEGG. Brukes til in vitro-diagnostikk PI-LT.615-NO-V3
 Leucosep-rør LTK.615 PAKNINGSVEDLEGG Brukes til in vitro-diagnostikk PI-LT.615-NO-V3 Bruksanvisning Bruksområde Leucosep-rørene er beregnet til bruk ved oppsamling og separasjon av mononukleære celler
Leucosep-rør LTK.615 PAKNINGSVEDLEGG Brukes til in vitro-diagnostikk PI-LT.615-NO-V3 Bruksanvisning Bruksområde Leucosep-rørene er beregnet til bruk ved oppsamling og separasjon av mononukleære celler
Aptima Multitest Swab Specimen Collection Kit
 Multitest Swab Specimen Collection Kit Aptima Bruksområder Aptima Multitest Swab Specimen Collection Kit (prøvetakingssett for vattpinneprøver) skal brukes til Aptima-analyser. Aptima Multitest Swab Specimen
Multitest Swab Specimen Collection Kit Aptima Bruksområder Aptima Multitest Swab Specimen Collection Kit (prøvetakingssett for vattpinneprøver) skal brukes til Aptima-analyser. Aptima Multitest Swab Specimen
Aptima Multitest Swab Specimen Collection Kit (prøvetakingssett for vattpinneprøver)
 Bruksområder Aptima Multitest Swab Specimen Collection Kit for bruk med Aptima-analyser. Aptima Multitest Swab Specimen Collection Kit er beregnet til bruk for innsamling av vaginal vattpinneprøver for
Bruksområder Aptima Multitest Swab Specimen Collection Kit for bruk med Aptima-analyser. Aptima Multitest Swab Specimen Collection Kit er beregnet til bruk for innsamling av vaginal vattpinneprøver for
Bruksanvisning IVD Matrix HCCA-portioned
 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
artus EBV QS-RGQ Kit Ytelsesegenskaper Mai 2012 Sample & Assay Technologies Analytisk følsomhet plasma artus EBV QS-RGQ Kit, Version 1,
 artus EBV QS-RGQ Kit Ytelsesegenskaper artus EBV QS-RGQ Kit, Version 1, 4501363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artuscmvpcrkitce.aspx før testen utføres. Gjeldende
artus EBV QS-RGQ Kit Ytelsesegenskaper artus EBV QS-RGQ Kit, Version 1, 4501363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artuscmvpcrkitce.aspx før testen utføres. Gjeldende
Laboratorieutstyrsliste QIAsymphony SP
 Februar 2017 Laboratorieutstyrsliste QIAsymphony SP Prøve- og eluatrør/-stativ som kan brukes med QIAsymphony DSP sirkulerende DNA-sett og QIAsymphony SP (programvareversjon 4.0 og programvareversjon 4.1;
Februar 2017 Laboratorieutstyrsliste QIAsymphony SP Prøve- og eluatrør/-stativ som kan brukes med QIAsymphony DSP sirkulerende DNA-sett og QIAsymphony SP (programvareversjon 4.0 og programvareversjon 4.1;
artus HI Virus-1 QS-RGQ Kit
 artus HI Virus-1 QS-RGQ Kit Ytelsesegenskaper artus HI Virus-1 QS-RGQ Kit, versjon 1, 4513363, 4513366 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artushivirusrt-pcrkitce.aspx
artus HI Virus-1 QS-RGQ Kit Ytelsesegenskaper artus HI Virus-1 QS-RGQ Kit, versjon 1, 4513363, 4513366 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artushivirusrt-pcrkitce.aspx
Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett)
 August 2015 QIAsymphony SP-protokollark Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett) Dette dokumentet er Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP
August 2015 QIAsymphony SP-protokollark Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett) Dette dokumentet er Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP
Bruksanvisning IVD Matrix HCCA-portioned
 8290200 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til matriksassistert laserdesorpsjons-ionisasjon flytid for massespektrometri (MALDI-TOF-MS). CARE- produkter er utformet for å støtte
8290200 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til matriksassistert laserdesorpsjons-ionisasjon flytid for massespektrometri (MALDI-TOF-MS). CARE- produkter er utformet for å støtte
Bruksanvisning IVD Matrix HCCA-portioned
 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
QIAsymphony SP protokollark
 QIAsymphony SP protokollark VirusBlood200_V5_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av viralt DNA fra friskt humant fullblod ved bruk av
QIAsymphony SP protokollark VirusBlood200_V5_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av viralt DNA fra friskt humant fullblod ved bruk av
Amplifikasjonsteknikker - andre metoder
 Amplifikasjonsteknikker - andre metoder Svein Arne Nordbø TH-28973 17.03.15 Alternative amplifikasjonsmetoder Templat-amplifikasjons metoder Signal-amplifikasjonsmetoder Templat-amplifikasjons metoder
Amplifikasjonsteknikker - andre metoder Svein Arne Nordbø TH-28973 17.03.15 Alternative amplifikasjonsmetoder Templat-amplifikasjons metoder Signal-amplifikasjonsmetoder Templat-amplifikasjons metoder
BRUKSINSTRUKSJONER PARASITE SUSPENSIONS. n Parasite Suspensions i formalin TILTENKT BRUK OPPSUMMERING OG FORKLARING PRINSIPPER KOMPOSISJON
 BRUKSINSTRUKSJONER n Parasite Suspensions i formalin TILTENKT BRUK Microbiologics Parasite Suspensions støtter kvalitetssikringsprogrammer ved å fungere som kvalitetskontrollutfordringer som inneholder
BRUKSINSTRUKSJONER n Parasite Suspensions i formalin TILTENKT BRUK Microbiologics Parasite Suspensions støtter kvalitetssikringsprogrammer ved å fungere som kvalitetskontrollutfordringer som inneholder
Strep A Rapid Test Device (Throat Swab) Cod For proffesjonel bruk Manual
 Strep A Rapid Test Device (Throat Swab) Cod. 24522 Strep A Hurtigtest Cod. 24522 For proffesjonel bruk Manual Brukeren må lese manual nøyaktig slik at han/hun forstår produktet før bruk M24522-M-Rev.3-10.15
Strep A Rapid Test Device (Throat Swab) Cod. 24522 Strep A Hurtigtest Cod. 24522 For proffesjonel bruk Manual Brukeren må lese manual nøyaktig slik at han/hun forstår produktet før bruk M24522-M-Rev.3-10.15
artus BK Virus QS-RGQ Kit
 artus BK Virus QS-RGQ Kit Ytelsesegenskaper artus BK Virus QS-RGQ Kit, versjon 1, 4514363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artusbkvirusrgpcrkit.aspx før testen
artus BK Virus QS-RGQ Kit Ytelsesegenskaper artus BK Virus QS-RGQ Kit, versjon 1, 4514363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artusbkvirusrgpcrkit.aspx før testen
QIAsymphony SP protokollark
 Februar 2017 QIAsymphony SP protokollark circdna_2000_dsp_v1 og circdna_4000_dsp_v1 Dette dokumentet er QIAsymphony circdna_2000_dsp_v1 og circdna_4000_dsp_v1- protokollark, versjon 1, R1 Sample to Insight
Februar 2017 QIAsymphony SP protokollark circdna_2000_dsp_v1 og circdna_4000_dsp_v1 Dette dokumentet er QIAsymphony circdna_2000_dsp_v1 og circdna_4000_dsp_v1- protokollark, versjon 1, R1 Sample to Insight
PCR-analyser i rutinediagnostikken Pål A. Jenum
 PCR-analyser i rutinediagnostikken Pål A. Jenum september 2015 1 Utvikling Antall genmolekylære analyser pr år (unntatt klamydia og gonokokker: Ca 32.000 i 2015) 120000 Stipulert for hele året 100000 80000
PCR-analyser i rutinediagnostikken Pål A. Jenum september 2015 1 Utvikling Antall genmolekylære analyser pr år (unntatt klamydia og gonokokker: Ca 32.000 i 2015) 120000 Stipulert for hele året 100000 80000
artus CMV QS-RGQ-sett
 artus CMV QS-RGQ-sett Ytelsesegenskaper artus CMV QS-RGQ-sett, Versjon 1, 4503363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artuscmvpcrkitce.aspx før testen utføres. Gjeldende
artus CMV QS-RGQ-sett Ytelsesegenskaper artus CMV QS-RGQ-sett, Versjon 1, 4503363 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artuscmvpcrkitce.aspx før testen utføres. Gjeldende
LTK.615 PAKNINGSVEDLEGG
 LTK.615 PAKNINGSVEDLEGG For in vitro-diagnostisk bruk PI-LT.615-NO-V4 Instruktiv informasjon Tilsiktet bruk Leucosep-rør er beregnet på innsamling og separasjon av perifere mononukleære blodceller (PBMC
LTK.615 PAKNINGSVEDLEGG For in vitro-diagnostisk bruk PI-LT.615-NO-V4 Instruktiv informasjon Tilsiktet bruk Leucosep-rør er beregnet på innsamling og separasjon av perifere mononukleære blodceller (PBMC
Brukerveiledning. www.med-kjemi.no. firmapost@med-kjemi.no
 Brukerveiledning S www.med-kjemi.no firmapost@med-kjemi.no 1 HEMOSURE Hemosure er en ett-trinns immunologisk hurtigtest for påvisning av skjult blod i fæces. Denne type tester er også referert til som
Brukerveiledning S www.med-kjemi.no firmapost@med-kjemi.no 1 HEMOSURE Hemosure er en ett-trinns immunologisk hurtigtest for påvisning av skjult blod i fæces. Denne type tester er også referert til som
Preanalyse. Kurs i Molekylærpatologi Oslo, juni 2017
 Preanalyse Kurs i Molekylærpatologi Oslo, 07.-08. juni 2017 Heidemarie Svendsen Bioingeniør Enhet for molekylærpatologi Avdeling for Patologi Oslo Universitetssykehus Innhold Prøvemateriale Preparering
Preanalyse Kurs i Molekylærpatologi Oslo, 07.-08. juni 2017 Heidemarie Svendsen Bioingeniør Enhet for molekylærpatologi Avdeling for Patologi Oslo Universitetssykehus Innhold Prøvemateriale Preparering
QIAsymphony SP protokollark
 QIAsymphony SP protokollark DNA_Buffy_Coat_200_V7_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra frisk
QIAsymphony SP protokollark DNA_Buffy_Coat_200_V7_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra frisk
BD MAX Enteric Parasite Panel 442960 Til in vitro-diagnostisk bruk Skal brukes med BD MAX System
 BD MAX Enteric Parasite Panel 442960 Til in vitro-diagnostisk bruk Skal brukes med BD MAX System P0195(04) 2015-04 Norsk BRUKSOMRÅDE BD MAX Enteric Parasite Panel (tarmparasittpanel), utført på BD MAX
BD MAX Enteric Parasite Panel 442960 Til in vitro-diagnostisk bruk Skal brukes med BD MAX System P0195(04) 2015-04 Norsk BRUKSOMRÅDE BD MAX Enteric Parasite Panel (tarmparasittpanel), utført på BD MAX
HURTIGREFERANSEINSTRUKSER Bare for bruk med Sofia Analyzer.
 Reader Eject Reader Analyzer og Strep A FIA HURTIGREFERANSEINSTRUKSER Bare for bruk med Sofia Analyzer. TESTPROSEDYRE Alle kliniske prøver må ha romtemperatur før du begynner med analysen. Utløpsdato:
Reader Eject Reader Analyzer og Strep A FIA HURTIGREFERANSEINSTRUKSER Bare for bruk med Sofia Analyzer. TESTPROSEDYRE Alle kliniske prøver må ha romtemperatur før du begynner med analysen. Utløpsdato:
tester Circulating Tumor Cell Control Kit
 7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
Produktbeskrivelse. Accu-Chek Aviva II
 Produktbeskrivelse Accu-Chek Aviva II 1 Innhold Generelt... 3 Analyseprinsipp... 4 Reagenser... 4 Prøvemateriale... 5 Kalibrering/ koding... 5 Kvalitetskontroll... 5 Analyseprosedyre... 6 Kontroll... 6
Produktbeskrivelse Accu-Chek Aviva II 1 Innhold Generelt... 3 Analyseprinsipp... 4 Reagenser... 4 Prøvemateriale... 5 Kalibrering/ koding... 5 Kvalitetskontroll... 5 Analyseprosedyre... 6 Kontroll... 6
artus HBV QS-RGQ-sett
 artus HBV QS-RGQ-sett Ytelsesegenskaper artus HBV QS-RGQ-sett, versjon 1, 4506363, 4506366 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artushbvpcrkitce.aspx før testen utføres.
artus HBV QS-RGQ-sett Ytelsesegenskaper artus HBV QS-RGQ-sett, versjon 1, 4506363, 4506366 Se etter nye elektroniske etikettoppdateringer på www.qiagen.com/products/artushbvpcrkitce.aspx før testen utføres.
Kan laboratoriene stole på sine kontrollmaterialer?
 Kan laboratoriene stole på sine kontrollmaterialer? Bioingeniørkongressen 2. juni 2016 Mari Solhus Produktspesialist/bioingeniør SERO AS Utfordringer med bruk av kvalitetskontroller Konsekvenser for laboratoriedriften
Kan laboratoriene stole på sine kontrollmaterialer? Bioingeniørkongressen 2. juni 2016 Mari Solhus Produktspesialist/bioingeniør SERO AS Utfordringer med bruk av kvalitetskontroller Konsekvenser for laboratoriedriften
AdnaTest ProstateCancerSelect
 AdnaTest ProstateCancerSelect Anriking av tumorceller fra blodet fra pasienter med prostatakreft til genekspresjonsanalyser Til bruk i in vitro-diagnostikk Brukerhåndbok T-1-520 Innhold Bestillingsinformasjon...
AdnaTest ProstateCancerSelect Anriking av tumorceller fra blodet fra pasienter med prostatakreft til genekspresjonsanalyser Til bruk i in vitro-diagnostikk Brukerhåndbok T-1-520 Innhold Bestillingsinformasjon...
Hurtigveiledning for RAS Extension Pyro Plug-in
 Februar 2017 Hurtigveiledning for RAS Extension Pyro Plug-in Til installasjon og bruk med PyroMark Q24- instrumenter og PyroMark Q24-programvaren, versjon 2.0 Sample to Insight Om RAS Extension Pyro Plug-in
Februar 2017 Hurtigveiledning for RAS Extension Pyro Plug-in Til installasjon og bruk med PyroMark Q24- instrumenter og PyroMark Q24-programvaren, versjon 2.0 Sample to Insight Om RAS Extension Pyro Plug-in
Ytelseskarakteristikker
 Ytelseskarakteristikker QIAamp DSP DNA FFPE Tissue-sett, Versjon 1 60404 Versjonshåndtering Dette dokumentet er ytelsesegenskaper for QIAamp DSP DNA FFPE Tissue-sett, versjon 1, R3. Se etter nye elektroniske
Ytelseskarakteristikker QIAamp DSP DNA FFPE Tissue-sett, Versjon 1 60404 Versjonshåndtering Dette dokumentet er ytelsesegenskaper for QIAamp DSP DNA FFPE Tissue-sett, versjon 1, R3. Se etter nye elektroniske
Kvalitetssikring av HPV-testing i Norge
 Kvalitetssikring av HPV-testing i Norge HPV-referanselaboratoriets rolle i Masseundersøkelsen mot livmorhalskreft Irene Kraus Christiansen Nasjonalt referanselaboratorium for humant papillomavirus Fagdag,
Kvalitetssikring av HPV-testing i Norge HPV-referanselaboratoriets rolle i Masseundersøkelsen mot livmorhalskreft Irene Kraus Christiansen Nasjonalt referanselaboratorium for humant papillomavirus Fagdag,
MBT Sepsityper IVD Kit
 1834338 Bruksanvisning MBT Sepsityper IVD Kit Sett for identifisering av mikroorganismer fra positive blodkulturer ved hjelp av IVD MALDI Biotyper-systemet CARE- produkter er utformet for å støtte kunder
1834338 Bruksanvisning MBT Sepsityper IVD Kit Sett for identifisering av mikroorganismer fra positive blodkulturer ved hjelp av IVD MALDI Biotyper-systemet CARE- produkter er utformet for å støtte kunder
Produkt Produktnavn Gjeldende nummer Nytt nummer Lotnummer. ARCHITECT Free T4 Reagent 7K65-20, -25, -30 7K65-22, -27, -32 Alle ARCHITECT Free T4
 Abbott Laboratories 100 Abbott Park Road Abbott Park, IL 60064-6081 Produktinformasjon Dato 13. juni 2013 Produkt Produktnavn Gjeldende nummer Nytt nummer Lotnummer ARCHITECT Free T4 Reagent 7K65-20, -25,
Abbott Laboratories 100 Abbott Park Road Abbott Park, IL 60064-6081 Produktinformasjon Dato 13. juni 2013 Produkt Produktnavn Gjeldende nummer Nytt nummer Lotnummer ARCHITECT Free T4 Reagent 7K65-20, -25,
EKG-slavekabel og -adaptersett
 EKG-slavekabel og -adaptersett Brukerhåndbok Produsent FUJIFILM SonoSite, Inc. 21919 30th Drive SE Bothell, WA 98021 USA Tlf.: +1-888-482-9449 eller +1-425-951-1200 Faks: +1-425-951-1201 EU-autorisert
EKG-slavekabel og -adaptersett Brukerhåndbok Produsent FUJIFILM SonoSite, Inc. 21919 30th Drive SE Bothell, WA 98021 USA Tlf.: +1-888-482-9449 eller +1-425-951-1200 Faks: +1-425-951-1201 EU-autorisert
Nye krav til sensitivitet ved kvantitering av HCV
 Nye krav til sensitivitet ved kvantitering av HCV Har det konsekvenser for laboratoriet? Mette Lundstrøm Dahl Mikrobiologisk avd. Sykehuset i Vestfold HF Bakgrunn Kvalitativ HCV RNA PCR fra Roche siden
Nye krav til sensitivitet ved kvantitering av HCV Har det konsekvenser for laboratoriet? Mette Lundstrøm Dahl Mikrobiologisk avd. Sykehuset i Vestfold HF Bakgrunn Kvalitativ HCV RNA PCR fra Roche siden
Veritor System Reader
 Veritor System Reader Brukerhåndbok for Reader (avleser) L010108(03) 2013-09 Norsk BRUKSOMRÅDE BD Veritor System Reader (Avleseren til BD Veritor-systemet) er beregnet for bruk sammen med enheter av BD
Veritor System Reader Brukerhåndbok for Reader (avleser) L010108(03) 2013-09 Norsk BRUKSOMRÅDE BD Veritor System Reader (Avleseren til BD Veritor-systemet) er beregnet for bruk sammen med enheter av BD
HEMOCUE. Resultater med laboratoriekvalitet Rask, lett å utføre.
 HEMOCUE Resultater med laboratoriekvalitet Rask, lett å utføre. HEMOCUE Hemoglobin Hb 201+ og 201 Måleområde: 0-25,6 g/dl Nøyaktighet: Korrelasjon på 0,99 sammenliknet med ref. metoden. Prøvevolum: 10ul
HEMOCUE Resultater med laboratoriekvalitet Rask, lett å utføre. HEMOCUE Hemoglobin Hb 201+ og 201 Måleområde: 0-25,6 g/dl Nøyaktighet: Korrelasjon på 0,99 sammenliknet med ref. metoden. Prøvevolum: 10ul
B Directigen EZ RSV For direkte påvisning av respiratorisk syncytial-virus (RSV)
 B Directigen EZ RSV For direkte påvisning av respiratorisk syncytial-virus (RSV) L009004JAA 2008/12 U Norsk BRUKSOMRÅDE Directigen EZ RSV-testen er en rask kromatografisk immunanalyse for direkte og kvalitativ
B Directigen EZ RSV For direkte påvisning av respiratorisk syncytial-virus (RSV) L009004JAA 2008/12 U Norsk BRUKSOMRÅDE Directigen EZ RSV-testen er en rask kromatografisk immunanalyse for direkte og kvalitativ
Produktbeskrivelse. cobas h 232
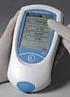 Produktbeskrivelse cobas h 232 INNHOLDSFORTEGNELSE: 1. Generell beskrivelse 3 2. Instrumentmoduler..4 3. Teststrimmel.5 4. Analyseprinsipp/reagenser....6 5. Prøvemateriale/Kalibrering.....7 6. Svarrapportering/vedlikehold......8
Produktbeskrivelse cobas h 232 INNHOLDSFORTEGNELSE: 1. Generell beskrivelse 3 2. Instrumentmoduler..4 3. Teststrimmel.5 4. Analyseprinsipp/reagenser....6 5. Prøvemateriale/Kalibrering.....7 6. Svarrapportering/vedlikehold......8
VEDLEGG NR. 2 TEST CASER
 VEDLEGG NR. 2 TEST CASER I forbindelse med at Universitetssykehuset Nord Norge HF (UNN) ved Avdeling for mikrobiologi og smittevern skal gå til innkjøp av en ekstraksjonsrobot ønsker vi å invitere tilbydere
VEDLEGG NR. 2 TEST CASER I forbindelse med at Universitetssykehuset Nord Norge HF (UNN) ved Avdeling for mikrobiologi og smittevern skal gå til innkjøp av en ekstraksjonsrobot ønsker vi å invitere tilbydere
Shire utgir dette materialet for risikohåndtering som en del av sin tilknytning til EMA for å implementere den godkjente risikohåndteringsplanen.
 Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Shire utgir dette opplæringsmaterialet for å implementere den godkjente risikohåndteringsplanen som en del av sin forpliktelse overfor EMA.
Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Shire utgir dette opplæringsmaterialet for å implementere den godkjente risikohåndteringsplanen som en del av sin forpliktelse overfor EMA.
Maxwell 16 Blood DNA Purification System
 Teknisk håndbok Maxwell 16 Blood DNA Purification System Forsiktig - håndter kassettene med forsiktighet, forseglede kanter kan være skarpe. 2800 Woods Hollow Rd. Madison, WI USA In Vitro diagnostisk medisinsk
Teknisk håndbok Maxwell 16 Blood DNA Purification System Forsiktig - håndter kassettene med forsiktighet, forseglede kanter kan være skarpe. 2800 Woods Hollow Rd. Madison, WI USA In Vitro diagnostisk medisinsk
Nasjonal holdbarhetsdatabase
 Nasjonal holdbarhetsdatabase hvordan kan vi finne ut hvor lenge prøvene er holdbare? Preanalyse 10. 11.mai 2017 Nasjonalt prosjekt for standardisering av holdbarhetsforsøk Protokoll med beskrivelse av
Nasjonal holdbarhetsdatabase hvordan kan vi finne ut hvor lenge prøvene er holdbare? Preanalyse 10. 11.mai 2017 Nasjonalt prosjekt for standardisering av holdbarhetsforsøk Protokoll med beskrivelse av
Nr. 67/86 EØS-tillegget til Den europeiske unions tidende. KOMMISJONSFORORDNING (EF) nr. 1168/2006. av 31. juli 2006
 Nr. 67/86 EØS-tillegget til Den europeiske unions tidende KOMMISJONSFORORDNING (EF) nr. 1168/2006 2010/EØS/67/14 av 31. juli 2006 om gjennomføring av europaparlaments- og rådsforordning (EF) nr. 2160/2003
Nr. 67/86 EØS-tillegget til Den europeiske unions tidende KOMMISJONSFORORDNING (EF) nr. 1168/2006 2010/EØS/67/14 av 31. juli 2006 om gjennomføring av europaparlaments- og rådsforordning (EF) nr. 2160/2003
Endringshistorikk. MAX Enteric Viral Panel. Revisjon/dato Avsnitt Endringssammendrag
 MAX Enteric Viral Panel 443985 P0231(03) 2018-06 Norsk Endringshistorikk Revisjon/dato Avsnitt Endringssammendrag (03) 2018-06 Innholdsfortegnelse Prosedyreprinsipper Tabell over reagenser og materialer
MAX Enteric Viral Panel 443985 P0231(03) 2018-06 Norsk Endringshistorikk Revisjon/dato Avsnitt Endringssammendrag (03) 2018-06 Innholdsfortegnelse Prosedyreprinsipper Tabell over reagenser og materialer
Synovasure PJI-sett for lateral flowtest
 Synovasure PJI-sett for lateral flowtest Alfadefensintest for periprostetisk leddinfeksjon Distribueres av Gå til www.cddiagnostics.com for ytterligere produktinformasjon. Brukere må lese dette pakningsvedlegget
Synovasure PJI-sett for lateral flowtest Alfadefensintest for periprostetisk leddinfeksjon Distribueres av Gå til www.cddiagnostics.com for ytterligere produktinformasjon. Brukere må lese dette pakningsvedlegget
Molekylære metoder i medisinsk mikrobiologi.
 - 1 - Molekylære metoder i medisinsk mikrobiologi. Laboratorieøvelser onsdag 18.mars 2014. Øvelser: 5. Gelelektroforese på PCR produkt fra meca og nuc PCR fra dag 1 6. Mycobakterium genus FRET realtime
- 1 - Molekylære metoder i medisinsk mikrobiologi. Laboratorieøvelser onsdag 18.mars 2014. Øvelser: 5. Gelelektroforese på PCR produkt fra meca og nuc PCR fra dag 1 6. Mycobakterium genus FRET realtime
Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre.
 DNA HALSKJEDE Hensikt Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre. Bakgrunn Det humane genomet består av omtrent 2.9 milliarder basepar.
DNA HALSKJEDE Hensikt Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre. Bakgrunn Det humane genomet består av omtrent 2.9 milliarder basepar.
3M Food Safety 3M Molecular Detection System. Patogentesting. Enkelt og greit
 3M Food Safety 3M Molecular Detection System Patogentesting Enkelt og greit Matproduksjon er ditt fagfelt Matsikkerhet er vårt Forbrukerne stoler på at ditt firma leverer mat av trygg kvalitet hver dag.
3M Food Safety 3M Molecular Detection System Patogentesting Enkelt og greit Matproduksjon er ditt fagfelt Matsikkerhet er vårt Forbrukerne stoler på at ditt firma leverer mat av trygg kvalitet hver dag.
Endringshistorikk. MAX Enteric Viral Panel-NR. Revisjon/dato Avsnitt Endringssammendrag. (03) Innholdsfortegnelse Prosedyreprinsipper
 MAX Enteric Viral Panel-NR 443987 P0230(03) 2018-06 Norsk Endringshistorikk Revisjon/dato Avsnitt Endringssammendrag (03) 2018-06 Innholdsfortegnelse Prosedyreprinsipper Tabell over reagenser og materialer
MAX Enteric Viral Panel-NR 443987 P0230(03) 2018-06 Norsk Endringshistorikk Revisjon/dato Avsnitt Endringssammendrag (03) 2018-06 Innholdsfortegnelse Prosedyreprinsipper Tabell over reagenser og materialer
Pasientnær analysering innen medisinsk mikrobiologi
 Pasientnær analysering innen medisinsk mikrobiologi Marie Elisabeth Vad Fagbioingeniør/ Medlem av RUFMIK Seksjon for Utvikling Avdeling for Mikrobiologi Ullevål,OUS Hva mener vi med pasientnær analysering(pna)?
Pasientnær analysering innen medisinsk mikrobiologi Marie Elisabeth Vad Fagbioingeniør/ Medlem av RUFMIK Seksjon for Utvikling Avdeling for Mikrobiologi Ullevål,OUS Hva mener vi med pasientnær analysering(pna)?
PREPARATOMTALE. Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk. Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
PREPARATOMTALE 1. LEGEMIDLETS NAVN Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
INSTRUKSJONER OM HURTIGREFERANSER Kun til bruk med Sofia Analyzer. Sofia Analyzer og Influenza A+B FIA. Velg analysatormodus.
 Eject Sofia Analyzer og Influenza FIA INSTRUKSJONER OM HURTIGREFERANSER Kun til bruk med Sofia Analyzer. TESTPROSEDYRE Alle kliniske prøver må ha romtemperatur før analysen begynner. Utløpsdato: Kontroller
Eject Sofia Analyzer og Influenza FIA INSTRUKSJONER OM HURTIGREFERANSER Kun til bruk med Sofia Analyzer. TESTPROSEDYRE Alle kliniske prøver må ha romtemperatur før analysen begynner. Utløpsdato: Kontroller
Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Instruksjoner for helsepersonell
![Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Instruksjoner for helsepersonell Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Instruksjoner for helsepersonell](/thumbs/69/60787469.jpg) Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Instruksjoner for helsepersonell Denne informasjonen leveres av Shire Pharmaceuticals. Dette legemidlet er underlagt særlig overvåking for
Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Instruksjoner for helsepersonell Denne informasjonen leveres av Shire Pharmaceuticals. Dette legemidlet er underlagt særlig overvåking for
Internal Control Detection Kit
 Internal Control Detection Kit IC FOR BRUK TIL IN VITRO-DIAGNOSTIKK. Bestillingsinformasjon COBAS AMPLICOR IC DK 100 Tests P/N: 20757608 122 Internal Control Detection Kit ART: 07 5760 8 US: 83281 COBAS
Internal Control Detection Kit IC FOR BRUK TIL IN VITRO-DIAGNOSTIKK. Bestillingsinformasjon COBAS AMPLICOR IC DK 100 Tests P/N: 20757608 122 Internal Control Detection Kit ART: 07 5760 8 US: 83281 COBAS
1. En ikke-naturlig forekommende eller konstruert sammensetning omfattende:
 1 Patentkrav EP2931898 1. En ikke-naturlig forekommende eller konstruert sammensetning omfattende: et leveringssystem som er operativt konfigurert for å levere CRISPR-Caskomplekskomponenter eller polynukleotidsekvenser
1 Patentkrav EP2931898 1. En ikke-naturlig forekommende eller konstruert sammensetning omfattende: et leveringssystem som er operativt konfigurert for å levere CRISPR-Caskomplekskomponenter eller polynukleotidsekvenser
tester Circulating Tumor Cell Control Kit
 7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
7900003 24 tester Circulating Tumor Cell Control Kit 1 TILTENKT BRUK For in vitro diagnostisk bruk CELLSEARCH Circulating Tumor Cell Control Kit er tiltenkt brukt som en analysekontroll for å sikre at
Produktbeskrivelse Urisys 1100
 Produktbeskrivelse Urisys 1100 INNHOLDSFORTEGNELSE: 1. Generell beskrivelse..3 2. Reagenser/teststrimler.....3 3. Testparametere...4 4. Teststrimler. 4 5. Analyseprinsipp. 5 6. Prøvemateriale...5 7. Kalibrering
Produktbeskrivelse Urisys 1100 INNHOLDSFORTEGNELSE: 1. Generell beskrivelse..3 2. Reagenser/teststrimler.....3 3. Testparametere...4 4. Teststrimler. 4 5. Analyseprinsipp. 5 6. Prøvemateriale...5 7. Kalibrering
Serologisk diagnostikk av luftveisinfeksjoner; Hva kan vi? Nina Evjen Mikrobiologisk avdeling Ahus
 Serologisk diagnostikk av luftveisinfeksjoner; Hva kan vi? Nina Evjen Mikrobiologisk avdeling Ahus Hva gjør vi? Serologisk rutinetilbud tilgjengelig for Bakterier Mycoplasma pneumoniae Chlamydophila pneumoniae
Serologisk diagnostikk av luftveisinfeksjoner; Hva kan vi? Nina Evjen Mikrobiologisk avdeling Ahus Hva gjør vi? Serologisk rutinetilbud tilgjengelig for Bakterier Mycoplasma pneumoniae Chlamydophila pneumoniae
Sammendrag av produktegenskaper for et biocidprodukt
 Sammendrag av produktegenskaper for et biocidprodukt Produktnavn: MECDEET Solution Produkttype(r): PT9 Repellenter og lokkestoffer (skadedyrbekjempelse) Godkjenningsnummer: NO080 RBP 3 asset_referansenummer:
Sammendrag av produktegenskaper for et biocidprodukt Produktnavn: MECDEET Solution Produkttype(r): PT9 Repellenter og lokkestoffer (skadedyrbekjempelse) Godkjenningsnummer: NO080 RBP 3 asset_referansenummer:
Kvantitative genteknologiske analyser
 Kvantitative genteknologiske analyser TH-28973 19.03.15 Svein Arne Nordbø Indikasjoner for kvantitative analyser Vurdere klinisk betydning av mikrobefunn gjort med meget sensitive metoder Monitorere grad
Kvantitative genteknologiske analyser TH-28973 19.03.15 Svein Arne Nordbø Indikasjoner for kvantitative analyser Vurdere klinisk betydning av mikrobefunn gjort med meget sensitive metoder Monitorere grad
Digital promille tester CA2010. Brukerveiledning. TT Micro AS Side 1
 Digital promille tester CA2010 Brukerveiledning TT Micro AS Side 1 ... 32 Innholdsfortegnelse Innhold i pakken Produkt Forholdsregler... oversikt Skjerm... informasjon Brukerveiledning 4 Feilmeldinger
Digital promille tester CA2010 Brukerveiledning TT Micro AS Side 1 ... 32 Innholdsfortegnelse Innhold i pakken Produkt Forholdsregler... oversikt Skjerm... informasjon Brukerveiledning 4 Feilmeldinger
Forslag til opplegg for kontroll av blodkultur og ID-systemer
 Forslag til opplegg for kontroll av blodkultur og ID-systemer Fredrik Müller Mikrobiologisk institutt Rikshospitalet Bestilling: Å presentere et lavterskel opplegg for bruk av kvalitetskontroller knyttet
Forslag til opplegg for kontroll av blodkultur og ID-systemer Fredrik Müller Mikrobiologisk institutt Rikshospitalet Bestilling: Å presentere et lavterskel opplegg for bruk av kvalitetskontroller knyttet
RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN
 Til sykepleier - Veileder for dosering og administrasjon RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN En veiledning som skal hjelpe
Til sykepleier - Veileder for dosering og administrasjon RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN En veiledning som skal hjelpe
HMS-DATABLAD. Del 1: Identifikasjon av stoffet/blandingen og selskapet/foretaket. Del 2: Fareidentifikasjon
 ifølge EF-direktiv 1907/2006 Side: 1 Utarbeidelsesdato: 16.08.2010 Revisjonsdato: 15.03.2013 Revidert utgave nr.: 3 Del 1: Identifikasjon av stoffet/blandingen og selskapet/foretaket 1.1. Produktidentifikator
ifølge EF-direktiv 1907/2006 Side: 1 Utarbeidelsesdato: 16.08.2010 Revisjonsdato: 15.03.2013 Revidert utgave nr.: 3 Del 1: Identifikasjon av stoffet/blandingen og selskapet/foretaket 1.1. Produktidentifikator
Produktinformasjon. Dato 24. september Produkt Produktnavn Bestillingsnr. Pakningsstørrelse. Begrunnelse. Gjeldende status
 Produktinformasjon Dato 24. september 2015 Produkt Produktnavn Bestillingsnr. Pakningsstørrelse Vitamin D Reagent Vitamin D Calibrators Vitamin D Controls 5P02-25 1 x 100 tester/pakke 5P02-35 1 x 500 tester/pakke
Produktinformasjon Dato 24. september 2015 Produkt Produktnavn Bestillingsnr. Pakningsstørrelse Vitamin D Reagent Vitamin D Calibrators Vitamin D Controls 5P02-25 1 x 100 tester/pakke 5P02-35 1 x 500 tester/pakke
ABX Pentra Bilirubin Direct CP A91A00562CNO 10/08/2005
 Materialdatablad ABX Pentra Bilirubin Direct CP A91A00562CNO 10/08/2005 1. Produkt- og selskapsidentifisering 1.1. Identifisering av produktet Produktnavn: Produktkode: 1.2. Selskapsidentifisering ABX
Materialdatablad ABX Pentra Bilirubin Direct CP A91A00562CNO 10/08/2005 1. Produkt- og selskapsidentifisering 1.1. Identifisering av produktet Produktnavn: Produktkode: 1.2. Selskapsidentifisering ABX
PNA ISH Detection Kit
 PNA ISH Detection Kit Kode nr. K5201 8. utgave Til in situ-hybridisering ved bruk av fluorescein-konjugerte PNA-prøver. Settet inneholder reagenser til minst 40 tester*. * Antall tester basert på bruk
PNA ISH Detection Kit Kode nr. K5201 8. utgave Til in situ-hybridisering ved bruk av fluorescein-konjugerte PNA-prøver. Settet inneholder reagenser til minst 40 tester*. * Antall tester basert på bruk
Tiltenkt bruk. Kontraindikasjoner, advarsler og forholdsregler. Enheter og reagenser. Oppbevaring og stabilitet. Kontraindikasjon.
 TM NMP22 BladderChek L0219 Rev. 4 2010/11 Tiltenkt bruk Alere NMP22 BladderChek-testen er en immunologisk in vitro-analyse som er tiltenkt kvalitativ påvisning av det nukleære mitotiske apparatusproteinet
TM NMP22 BladderChek L0219 Rev. 4 2010/11 Tiltenkt bruk Alere NMP22 BladderChek-testen er en immunologisk in vitro-analyse som er tiltenkt kvalitativ påvisning av det nukleære mitotiske apparatusproteinet
Lover og forskrifter om smittevern
 Lover og forskrifter om smittevern Kurs for teknisk personell i sykehus 24. mars 2014 Geir Bukholm Avdeling for smittevern Oslo universitetssykehus 3 områder Populasjonsrettet smittevern Smittevern som
Lover og forskrifter om smittevern Kurs for teknisk personell i sykehus 24. mars 2014 Geir Bukholm Avdeling for smittevern Oslo universitetssykehus 3 områder Populasjonsrettet smittevern Smittevern som
C. DIFF QUIK CHEK COMPLETE. Få hele det diagnostiske bildet med bare én test. TRYKK HER FOR Å SE NESTE SIDE
 C. DIFF QUIK CHEK COMPLETE Få hele det diagnostiske bildet med bare én test. TRYKK HER FOR Å SE SIDE KLINIKER Vil anvendelige C. difficiletestresultater på under 30 minutter bedre pasientbehandlingen?
C. DIFF QUIK CHEK COMPLETE Få hele det diagnostiske bildet med bare én test. TRYKK HER FOR Å SE SIDE KLINIKER Vil anvendelige C. difficiletestresultater på under 30 minutter bedre pasientbehandlingen?
Molekylær diagnostikk av Leishmaniasis og Malaria
 Molekylær diagnostikk av Leishmaniasis og Malaria Dr scient. Cathrine Fladeby Seksjon for utvikling, Ullevål Avdeling for mikrobiologi Oslo universitetssykehus Leishmaniasis WHO, Control of the leishmaniases
Molekylær diagnostikk av Leishmaniasis og Malaria Dr scient. Cathrine Fladeby Seksjon for utvikling, Ullevål Avdeling for mikrobiologi Oslo universitetssykehus Leishmaniasis WHO, Control of the leishmaniases
Flokkuleringsmiddel P872-1000
 Produktdatablad Desember 2005 INTERNASJONALT MASTERDOKUMENT KUN TIL PROFESJONELL BRUK Flokkuleringsmiddel P872-1000 M0700V Produkt Beskrivelse P872-1000 Flokkuleringsmiddel Produktbeskrivelse P872-1000
Produktdatablad Desember 2005 INTERNASJONALT MASTERDOKUMENT KUN TIL PROFESJONELL BRUK Flokkuleringsmiddel P872-1000 M0700V Produkt Beskrivelse P872-1000 Flokkuleringsmiddel Produktbeskrivelse P872-1000
Hurtigveiledning for BRAF Pyro Plug-in
 Hurtigveiledning for BRAF Pyro Plug-in Februar 2017 Til installasjon og bruk med PyroMark Q24- instrumenter og PyroMark Q24-programvaren, versjon 2.0 Sample to Insight Om BRAF Pyro Plug-in BRAF Pyro Plug-in-pakken
Hurtigveiledning for BRAF Pyro Plug-in Februar 2017 Til installasjon og bruk med PyroMark Q24- instrumenter og PyroMark Q24-programvaren, versjon 2.0 Sample to Insight Om BRAF Pyro Plug-in BRAF Pyro Plug-in-pakken
VERIFISERING AV STORE ANALYSESYSTEMER
 05.06.2016 Bioingeniørkongressen 2016 Sigrid Høistad og Torill Kalfoss VERIFISERING AV STORE ANALYSESYSTEMER SIDE 2 1 Hvor stort? 6 Advia Chemistry XPT 18 Advia Centaur XPT SIDE 3 Klinisk kjemi: 42 analytter
05.06.2016 Bioingeniørkongressen 2016 Sigrid Høistad og Torill Kalfoss VERIFISERING AV STORE ANALYSESYSTEMER SIDE 2 1 Hvor stort? 6 Advia Chemistry XPT 18 Advia Centaur XPT SIDE 3 Klinisk kjemi: 42 analytter
Bakterietesting av skop, en nødvendighet? Vibecke Lindøen avdelingssykepleier Medisinsk undersøkelse, HUS
 Bakterietesting av skop, en nødvendighet? Vibecke Lindøen avdelingssykepleier Medisinsk undersøkelse, HUS Hovedmål Forebygge og begrense forekomst av infeksjoner innen endoskopisk virksomhet 3 viktige
Bakterietesting av skop, en nødvendighet? Vibecke Lindøen avdelingssykepleier Medisinsk undersøkelse, HUS Hovedmål Forebygge og begrense forekomst av infeksjoner innen endoskopisk virksomhet 3 viktige
Instructions for use. Hurtigstart referansehåndbok for Cyclops6-SA. 067_v02 02/2017 (no) Kun til profesjonelt bruk
 Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands Cyclops6-SA 067_v02 02/2017 (no) K7309 Phone: +31 20 5123599 Fax: +31 20 5123570 Reagents@sanquin.nl www.sanquin.org/reagents
Instructions for use Sanquin Reagents B.V. Plesmanlaan 125 1066 CX Amsterdam The Netherlands Cyclops6-SA 067_v02 02/2017 (no) K7309 Phone: +31 20 5123599 Fax: +31 20 5123570 Reagents@sanquin.nl www.sanquin.org/reagents
AdnaTest BreastCancerDetect
 AdnaTest BreastCancerDetect RT-PCR-sett for påvisning av brystkreft-assosiert genekspresjon i anrikede tumorceller Til bruk i in vitro-diagnostikk Brukerhåndbok T-1-509 Innhold Bestillingsinformasjon...
AdnaTest BreastCancerDetect RT-PCR-sett for påvisning av brystkreft-assosiert genekspresjon i anrikede tumorceller Til bruk i in vitro-diagnostikk Brukerhåndbok T-1-509 Innhold Bestillingsinformasjon...
BRUKSANVISNING. Mikroorganismer med kjente og forutsigbare karakteristikker brukes til kvalitetskontroll, opplæring og kompetanseprogrammer.
 BRUKSANVISNING KWIK-STIK KWIK-STIK Plus LYFO DISK ANVENDELSESOMRÅDE KWIK-STIK -, KWIK-STIK Plus- og LYFO DISK -mikroorganismer er beregnet brukt som kontroller for å verifisere ytelsen til analyser, reagenser
BRUKSANVISNING KWIK-STIK KWIK-STIK Plus LYFO DISK ANVENDELSESOMRÅDE KWIK-STIK -, KWIK-STIK Plus- og LYFO DISK -mikroorganismer er beregnet brukt som kontroller for å verifisere ytelsen til analyser, reagenser
TheraScreen : K-RAS Mutation Kit for deteksjon av 7 mutasjoner i K-RAS-genet
 TheraScreen : K-RAS Mutation Kit for deteksjon av 7 mutasjoner i K-RAS-genet Til bruk på Roche LightCycler 480 Real-Time PCR-system (instrument II) (katalognr.: 05015278001) og Applied BioSystems 7500
TheraScreen : K-RAS Mutation Kit for deteksjon av 7 mutasjoner i K-RAS-genet Til bruk på Roche LightCycler 480 Real-Time PCR-system (instrument II) (katalognr.: 05015278001) og Applied BioSystems 7500
Tidlig Graviditetstest Strimmel
 NO Tidlig Graviditetstest Strimmel Bruksanvisning Egnet for hjemmebruk. Version 1.0 NO 17012017 Cat.No. W1-S 10mIU Babyplan Tidlig Graviditetstest kan du lett selv utføre. Den registrerer forekomsten av
NO Tidlig Graviditetstest Strimmel Bruksanvisning Egnet for hjemmebruk. Version 1.0 NO 17012017 Cat.No. W1-S 10mIU Babyplan Tidlig Graviditetstest kan du lett selv utføre. Den registrerer forekomsten av
AdV/hMPV/RV-assay (Panther Fusion -system)
 Panther Fusion AdV// AdV//-assay (Panther Fusion -system) Til in vitro-diagnostisk bruk. Kun til eksport fra USA. INNHOLD Generell informasjon.................................................. 2 Tiltenkt
Panther Fusion AdV// AdV//-assay (Panther Fusion -system) Til in vitro-diagnostisk bruk. Kun til eksport fra USA. INNHOLD Generell informasjon.................................................. 2 Tiltenkt
Hvordan forbedre EKV-program som har metodespesifikk fasit?
 Hvordan forbedre EKV-program som har metodespesifikk fasit? Anne Stavelin Bioingeniør, PhD NKK-møte, Solstrand 14. mars 2014 www.noklus.no Norsk kvalitetsforbedring av laboratorievirksomhet utenfor sykehus
Hvordan forbedre EKV-program som har metodespesifikk fasit? Anne Stavelin Bioingeniør, PhD NKK-møte, Solstrand 14. mars 2014 www.noklus.no Norsk kvalitetsforbedring av laboratorievirksomhet utenfor sykehus
Sikkerhetsdatablad i.h.t. (EF) nr. 1907/2006
 Sikkerhetsdatablad i.h.t. (EF) nr. 1907/2006 Tangit FP 450 Fire Protection Side 1 av 1 SDB-Nr. : 260649 V001.0 bearbeidet den: 06.06.2011 Trykkdato: 14.06.2011 Kapittel 1: Betegnelse på stoff hhv. blanding
Sikkerhetsdatablad i.h.t. (EF) nr. 1907/2006 Tangit FP 450 Fire Protection Side 1 av 1 SDB-Nr. : 260649 V001.0 bearbeidet den: 06.06.2011 Trykkdato: 14.06.2011 Kapittel 1: Betegnelse på stoff hhv. blanding
Aptima HIV-1 Quant Dx Assay
 Aptima HIV-1 Quant Dx Assay Til bruk ved in vitro-diagnostikk. Kun til eksport fra USA. Allmenn informasjon................................................ 2 Beregnet bruk..................................................................
Aptima HIV-1 Quant Dx Assay Til bruk ved in vitro-diagnostikk. Kun til eksport fra USA. Allmenn informasjon................................................ 2 Beregnet bruk..................................................................
