Tema Vaksinasjon.
|
|
|
- Bengt Fredriksen
- 8 år siden
- Visninger:
Transkript
1 I Tidsskriftet nr /2006 publiseres flere artikler om vaksinasjon. Artiklene er redigert av Preben Aavitsland og Petter Gjersvik. Bildet illustrerer sentrale celler ved slimhinneimmunitet: Dendrittiske celler med sine utløpere i tarmlumen «snorkler» etter vaksineantigener eller patogene tarmbakterier og tar med seg antigener til nærmeste lymfeknute, der immunresponsen igangsettes. Illustrasjon Ludvig André Munthe Nr. 19/2006 Kua, gutten og lymfeknuten immunologiske prinsipper for vaksinasjon Ludvig André Munthe Side Det norske vaksinasjonsprogrammet Hanne Nøkleby, Berit Feiring Side Uønskede hendelser etter vaksinering Hanne Nøkleby, Marianne A. Riise Bergsaker Side Nr. 20/2006 Vaksinering er det verdt pengene? Torbjørn Wisløff, Tore G. Abrahamsen, Marianne A. Riise Bergsaker, Øistein Løvoll, Ivar Sønbø Kristiansen Side Vaksinasjon i et utviklingsperspektiv Halvor Sommerfelt, Tore Godal Side Vaksiner mot tuberkulose Harald G. Wiker, Gunnar Bjune Side Nr. 21/2006 Reisevaksinasjon Synne Sandbu Side Influensavaksinering hvorfor, for hvem og med hvilken vaksine? Marianne Bergsaker, Olav Hungnes, Bjørn Iversen Side Slimhinnevaksiner i utvikling Hilde Bakke, Bjørn Haneberg Side Nr. 22/2006 DNA fremtidens vaksine? Rune Kjeken, Bjarne Bogen, Iacob Mathiesen Side Kreftvaksiner Jon Amund Kyte Side Vaksiner mot rusmidler Jørg Mørland Side Tidsskr Nor Lægeforen nr. 22, 2006;
2 Medisin og vitenskap tema Vaksinasjon Kua, gutten og lymfeknuten immunologiske prinsipper for vaksinasjon Sammendrag Vaksiner stimulerer immunsystemet ved å aktivere profesjonelle antigenpresenterende celler, deriblant dendrittiske celler. Dendrittiske celler uttrykker en rekke mønstergjenkjennelsesreseptorer (MGR) på overflaten, reseptorer som gjenkjenner strukturer på virus og bakterier. Disse reseptorene stimulerer til modning av dendrittiske celler, som deretter migrerer til lymfeknuter og presenterer vaksineantigen til T-celler. Vaksinens MGR-ligander er bestemmende for om man får en hensiktsmessig immunrespons, og effektiv langvarig immunitet. I denne artikkelen gjennomgås cellulære prinsipper og mekanismer for vaksineresponser, inkludert antigennedbrytning, antigenpresentasjon, T-celleresirkulering, Th1-, Th2- og CTL- T-celleresponser og T-B-cellesamarbeid, samt primære og sekundære B-celleresponser. Engelsk sammendrag finnes i artikkelen på Oppgitte interessekonflikter: Ingen > Se også side 2504 Ludvig André Munthe l.a.munthe@medisin.uio.no Immunologisk institutt Fakultetsdivisjon Rikshospitalet Universitetet i Oslo og Rikshospitalet-Radiumhospitalet 0027 Oslo Edward Jenner ( ) beskrev vaksineringsprinsippet i 1796 (1). Koppeepidemier var et stort problem i Jenners samtid, kopper var en infeksjon som forårsaket stor barnedødelighet og i tillegg vansiret en betydelig del av verdens befolkning. Letaliteten var over 30 % (2). Ved sitt forsøk der han vaksinerte gutten James Phipps (fig 1), viste Jenner at kroppen kunne utvikle en motstand mot koppeinfeksjon dersom man tidligere hadde gjennomgått en immunrespons mot det nær beslektede kukoppeviruset. Uten å vite det, hadde Jenner oppdaget ervervet immunitet og immunologisk hukommelse, og tatt det første skrittet mot utryddelsen av kopper. Koppeviruset var også det første viruset som ble erklært utryddet av WHO i I det følgende omtales immunologiske prinsipper for vaksinasjon, først ved gjennomgang av celler og ervervet immunitet, deretter beskrives igangsettelsen av immunresponser med utgangspunkt i antigenpresenterende celler, og det trekkes linjer til vaksinasjonsstrategier. Medfødt og ervervet immunitet Kroppens hud og slimhinner danner barrierer som utgjør første forsvarsverk i medfødt (non-adaptiv) immunitet. I tillegg har vi proteiner i sekreter og i plasma som beskytter oss mot bakterier og virus. En rekke plasmaproteiner inngår i komplementsystemet, en kaskade som er spesielt viktig i den tidlige fasen av infeksjoner. Bakterier aktiverer komplementfaktorer, og det dannes komplementfaktorfragmenter: Opsoniner (C3b) binder reseptorer på fagocytter, anafylatoksiner (C5a, C3a) aktiverer mastceller, kjemotaksiner (C5a) rekrutterer leukocytter til inflammasjonen. Det dannes også terminalt komplementkompleks (C5b-C9) som laserer bakterier (3). Leukocytter inndeles i lymfocytter (T-celler, B-celler, NK-celler (naturlige drepeceller)), monocytter, dendrittiske celler og granulocytter (e-fig 2). Ervervet (adaptiv) infeksjonsforsvar, som utvikles som en følge av kontakt med mikroorganismer, er avhengig av lymfocyttresponser og har tre kjennetegn: spesifisitet, hukommelse og toleranse (3). En spesifikk reaksjon betegnes ved at lymfocytter reagerer med ett antigen (og ikke et annet ubeslektet antigen). Immunologisk hukommelse innebærer at lymfocytter som er spesifikke for et antigen, gjennomgår celledeling for å bli langlivede hukommelsesceller. Toleranse omtales ikke nærmere her, men krever at lymfocytter ikke reagerer på kroppens egne celler og proteiner. Opplasting av antigenpresenterende celler La oss se på hvordan et moderne immunologisk perspektiv ville forklare funnene til Jenner. Gutten James Phipps (fig 1) ble immunisert subkutant med et inokulat av kukoppevirus. I huden og i subkutant vev finnes spesialiserte antigenpresenterende celler kalt dendrittiske celler. Disse er oftest hvilende og kalles da umodne. I hvilefasen tar dendrittiske celler opp ekstracellulærvæske tilsvarende flere ganger deres eget volum hvert døgn. Denne prosessen, makropinocytose, gjør at dendrittiske celler lastes opp med de antigenene som til enhver tid finnes i det aktuelle vevet (3), for eksempel kukoppeantigener etter vaksineringen. Proteinantigener brytes ned til peptider, som så binder gropen til MHC-klasse II-molekyler (ramme 1), for videre transport ut til cellens overflate (fig 3) (3, 4). Mønstergjenkjennelsesreseptorer Dendrittiske celler har en lang rekke reseptorer som aktiverer cellen ved kontakt med bakterie- og virusprodukter. Slike mønstergjenkjennelsesreseptorer (MGR) (5) er helt nødvendig for det medfødte immunforsvarets gjenkjennelse av patogener. Den største gruppen av mønstergjenkjennelsesreseptorer er Toll-liknende reseptorer (TLR, en gruppe som har fått navnet sitt etter toll-reseptor oppdaget i bananflue) (5). Mønstergjenkjennelsesreseptorer aktiverer og modner monocytter, makrofager og dendrittiske celler. Tabell 1 inneholder en liste av bakterieantigener og deres MGR-ligander, med sentrale referanser (6 21). Ved infeksjoner, eller som i gutten James Phipps tilfelle, etter subkutan vaksinering med virus, vil dendrittiske celler meget effektivt modnes ved hjelp av mønstergjenkjennelsesreseptorer. De vil deretter vandre til lymfeknutens paracortex, hvor de presenterer et antigent «øyeblikksbilde» til T-celler (fig 4).! Hovedbudskap Vaksiner setter i gang immunresponser som beskytter organismen mot infeksjoner Vaksiner aktiverer antigenproduserende celler, som gjennom reseptorer på overflaten er i stand til å gjenkjenne strukturer på virus og bakterier De antigenproduserende cellene migrerer til lymfeknuter og presenterer vaksineantigen overfor T-celler, en immunrespons settes i gang og langvarig immunitet etableres 2532 Tidsskr Nor Lægeforen nr. 19, 2006; 126:
3 MEDISIN OG VITENSKAP For optimalisering av vaksiner er det nødvendig å simulere den aktivering som antigenpresenterende celler får fra mikroorganismer (22). Kunnskap om mønstergjenkjennelsesreseptorer og om hvordan man kan få den ønskede aktiveringen av dendrittiske celler, står derfor sentralt. Tradisjonelle vaksiner benytter gjerne svekkede eller drepte mikroorganismer og drar nytte av patogenets egne ligander for mønstergjenkjennelsesreseptorer. Eksempelvis aktiverer den levende attenuerte gulfebervirusvaksinen (YF-17D) en rekke toll-liknende reseptorer (TLR2, 7, 8 og 9) (21). En utfordring for moderne vaksineutvikling er å skreddersy vaksiner til å optimalisere igangsettingen av immunresponsen og å fremprovosere den ønskede typen av immunrespons som initieres av dendrittiske celler, jf. omtale av TLR og Th1/Th2-balansen nedenfor. T-cellereseptor og B-cellereseptor T-cellereseptor og B-cellereseptor er grunnlaget for immunologisk hukommelse og ervervet immunitet. Én reseptor på én dendrittisk celle er lik den som finnes på nabocellen. Dette er ikke tilfellet for lymfocytter, hvor T-cellereseptor (TCR) eller B-cellereseptor (BCR, membranbundet antistoff) kan være helt unike for den aktuelle cellen. For å forstå hvordan immunsystemet klarer å gjenkjenne et bredt repertoar av antigene determinanter, kreves det en kort gjennomgang av mekanismen for mangfold av T- og B-lymfocyttenes reseptorer. Prinsipielt er mekanismen for danningen av lymfocyttreseptormangfold lik for B- og T- celler. B-celler gjennomgår en såkalt rearrangering av BCR-gener i utviklingen i beinmargen (23). Ett V-gensegment, ett D-gensegment (for tungkjeder) og ett J-gensegment settes tilfeldig sammen, og mellomliggende gensegmenter klippes bort (e-fig 5). Det samme skjer for T-lymfocytter og T-cellereseptor (TCR), men da i thymus. T-cellereseptor har to kjeder, rearrangeringen av TCR-α-kjedegensegmentene tilsvarer lettkjedegensegmentene, mens TCRβ-locus tilsvarer tungkjedelokus. Denne tilfeldige rearrangeringen resulterer i cirka potensielt unike reseptorer for T- og B-celler, noe som forklarer hvordan det er mulig å danne reseptorer som kan binde nesten alle tenkelige antigener (3). Merk at det ikke ligger noen antigenseleksjon i lymfocyttmodningen. B-celler som kommer fra beinmargen er altså ikke selektert for å kunne binde et antigen, og cellene har ingen viten om eksistensen av antigen (de kalles derfor naive lymfocytter). Bare tilfeldigheter avgjør om deres B-cellereseptor kan binde mikroorganismer i kroppen (3). Seleksjon, emigrasjon og resirkulering I beinmargen fjernes B-celler som reagerer på kroppens egne antigener (selvantigener). Det samme skjer for T-celler i thymus. Denne prosessen kalles negativ seleksjon (3). De Figur 1 Det første vaksinasjonsforsøket i Budeia Sarah Nelmes hadde utviklet blemmer i håndflatene etter å ha melket kua Blossom (ordet vaksine er avledet fra vacca, latin, ku). Edward Jenner tok eksudat fra blemmene, et inokulat som han ga åtteåringen James Phipps. Seks uker senere fikk James ekstrakt fra en koppeinfisert pasient, en behandling som normalt ville resultere i koppesykdom, en livstruende sykdom, men han forble frisk. Forsøket demonstrerte at resistens kan erverves ved vaksinering, men kan trygt sies ikke å tilfredsstille dagens forskningsetiske krav gjenværende lymfocyttene har reseptorer som ikke reagerer på kroppsegne proteiner. Godkjente B-celler og T-celler emigrerer deretter ut i blodbanen som naive lymfocytter og vandrer til lymfeknuter og annet sekundært lymfoid vev. I lymfeknuter ekstravaserer både T- og B-lymfocyttene gjennom spesialiserte høyendotelvenyler i paracortex (fig 6A). Presentasjon til hjelpeceller og cytotoksiske celler T-celler inndeles i to hovedgrupper, etter uttrykk av enten CD4-koreseptor eller CD8- koreseptor (3). CD4-positive (CD4 + ) T-celler kalles hjelpeceller, mens CD8-positive (CD8 +) T-celler kalles cytotoksiske T-lymfocytter (CTL). I motsetning til B-celler, som med sine B-cellereseptorer kan binde konformasjonsdeterminanter på hele proteiner, gjenkjenner T-cellereseptor antigent peptid som ligger i gropen på MHC- klasse I- eller II-molekyler. Nukleære og cytosolære proteiner brytes konstitutivt ned, og peptider fraktes over den endoplasmatiske retikulummembranen for å havne i gropen på MHC-klasse I-molekyler (3). Nedbrutte virusproteinfragmenter som uttrykkes av infiserte celler, havner altså som peptider på MHC-klasse I-molekyler. MHC klasse I/peptidkomplekset kan gjenkjennes av T-cellereseptor på cytotoksiske T-lymfocytter. CD8-koreseptoren benyttes av T-cellen til å stabilisere bindingen til MHC-klasse I-molekyler. MHC-klasse I- molekyler finnes på nesten alle kjerneholdige celler, som dermed kan presentere viruspeptidantigen til CD8-positive T-celler (3). MHC klasse II uttrykkes bare av såkalte profesjonelle antigenpresenterende celler (dendrittiske celler, makrofager, B-celler). Proteinfragmenter derivert fra ekstracellulærvæsken, eller fra det sekretoriske apparatet, havner som peptider i gropen på MHCklasse II-molekyler. Dermed vil de aller fleste vaksineantigener presenteres på MHC-klasse II-molekyler, via endocytose Figur 3 Opplasting av peptider i gropen på MHC-molekyler. A. Profesjonelle antigenpresenterende celler (APC) endocytterer antigener, endosomer fusjonerer med MHC klasse II inneholdende vesikler, ph reduseres, og enzymer bryter ned proteiner til peptidfragmenter som lastes opp i gropen av MHC klasse II. MHC klasse II/peptidkomplekset fraktes deretter til overflaten av cellen, og kan gjenkjennes av T-cellereseptor (TCR) på overflaten av T-lymfocytter. B. Krystallstrukturen til MHC-klasse II-molekylet (3, 4). MHC klasse II består av en α- og en β-kjede. Den peptidbindende gropen ligger mellom to såkalte α-helikser fra α 1- og β 1- domenene. Figuren er modifisert fra (3) Tidsskr Nor Lægeforen nr. 19, 2006;
4 Ramme 1 Antigenpresenterende celle (APC) Slike celler kan være profesjonelle APC, da uttrykker cellene både MHC klasse I og klasse II i tillegg til kostimulerende molekyler. B-cellereseptor (BCR) Membranbundet antistoff (kalles også membranbundet immunglobulin). I utskilt form: Immunglobulin, antistoff. CD-antigener Fra «cluster of differentiation», markører som benyttes til å karakterisere celler og vev. CD4-koreseptor Markør for T-hjelpeceller, CD4-positive T-celler er spesialisert til å samarbeide med monocytter/makrofager/dendrittiske celler eller B-celler. CD8-koreseptor Markør for cytotoksiske T-celler. CD8- positive T-celler dreper virusinfiserte celler. Dendrittisk celle (DC) Den mest effektive profesjonelle antigenpresenterende cellen. MHC-komplekset (major histocompatibility complex) Vevsforlikelighetsantigener. Disse benyttes av antigenpresenterende celler til å presentere antigene peptider til T-celler. MHC klasse I bindes av CD8, som finnes på cytotoksiske T-celler. MHC klasse II på overflaten av antigenpresenterende celler bindes av CD4 på T-hjelpeceller. HLA (human leukocyte antigen) MHC hos mennesket. Mønstergjenkjennelsesreseptorer (MGR) Samlebetegnelse på reseptorer, for eksempel TLR, som har som funksjon å binde patogene agenser, bakterier, virus og sopp. Kalles på engelsk pattern recognition receptors (PRR). Toll-liknende reseptorer (TLR) Mønstergjenkjennelsesreseptorer som finnes på antigenpresenterende celler hos pattedyr. Toll-reseptorer ble først oppdaget hos bananfluer, og liknende reseptorer ble siden funnet hos en rekke arter, deriblant hos mennesket. Tabell 1 Antigenbinding til mønstergjenkjennelsesreseptorer (MGR) Mikroorganisme og endosomal prosessering av proteinantigener (fig 3). CD4 + -koreseptoren binder MHC klasse II, og øker dermed aviditeten. Attenuerte virale vaksiner vil ved transkripsjon og translasjon uttrykke cytosolære eller nukleære proteinantigener som havner i gropen på MHC klasse I. Derimot vil drepte vaksiner endocytteres og presenteres på MHC klasse II. Hvordan får man da aktivering av CD8-positive T-celler ved vaksiner som inneholder ikke-viable virus? Ved kraftig aktivering av antigenpresenterende celler skjer krysspresentasjon (cross priming) av ekstracellulære proteiner på MHC klasse I. Den nøyaktige mekanismen for dette er fortsatt uklar, men TLR3 ser ut til å spille en rolle (24). Aktivering av T-celler Dersom en naiv CD4-positiv T-celle tilfeldigvis har en T-cellereseptor (TCR) som kan binde et peptid presentert i gropen på MHCklasse II-molekyler (for eksempel et peptid fra kukoppeviruset), mottar den både stimulering via T-cellereseptor og kostimulering via overflateproteiner som CD28 (som ligeres av CD80, CD86; fig 4B). Det dannes da en tett synapse mellom cellene og signaleringsapparatet polariseres inn mot synapsen (3). Etter flere timer har den naive T-cellen fått tilstrekkelig stimulering for å lage både vekstfaktoren IL-2 og IL-2-reseptorer. T- cellen gjennomgår så en kraftig celledeling som i løpet av noen uker kan resultere i titusenvis av datterceller, alle med samme spesifisitet, nå kalt effektorceller eller hukommelsesceller. Det er to viktige forskjeller mellom den naive T-cellen og effektorcellen. For det første har effektorceller et annet sett med Binding til MGR Bakterieantigen LPS Gramnegative bakterier LPS binder plasmaproteinet LPS-bindende protein (LBP) og deretter TLR4 1 (6) LTA, lipoproteiner Peptidoglykan Grampositive bakterier Gruppe B-streptokokker, Staphylococcus aureus CpG-DNA 2 Bakterier og mykobakterier TLR9 (10) Flagellin Flagellate bakterier TLR5 (11) TLR2 (7), TLR6/TLR2/TLR1 (8, 9) Lipoarabinomannan Mykobakterier TLR2, Dectin-1, (TLR4) (12) Triacylerte lipoproteiner Mycobacterium leprae TLR1/TLR2 (13) Mannose Bakterier Mannosereseptor Virusantigen CpG-DNA Virus, f.eks. HSV-1, HSV-2, og musecytomegalovirus (MCMV) TLR9 (14, 15) Dobbelttrådet (ds)rna Virus TLR3 (16), retinoic-acid-inducible protein I (RIG-I) (17) Enkelttrådet (ss)rna RNA-virus TLR7, TLR8 (18) F(fusjons)-protein RSV TLR4 (19) Hemagglutininprotein Meslingvirus TLR2 (20) YF-17D-vaksine Gulfeber TLR2, 7, 8 og 9 (21) 1 Følgende toll-liknende reseptorer (TLR) uttrykkes på celleoverflaten: TLR1, 2, 4, 5, 6. TLR danner ofte heterodimerer, f.eks. TLR2/TLR6. TLR3, 7, 8, 9 uttrykkes nesten bare intracellulært, og patogene antigener må derfor endocytteres. TLR benytter felles signaleringsvei, som deles med IL-1-reseptoren 2 Bakterielt DNA inneholder ofte sekvenser med kombinasjoner av C- og G-nukleotidene, som i motsetning til hos pattedyr ikke er metylert. Pattedyrceller har TLR9 som har affinitet for bestemte sekvenser av slike CpG-motiver. TLR9 uttrykkes i endosomer, og bakterielt DNA må derfor endocytteres, eller hele bakterien fagocytteres kjemokinreseptorer (fig 6B) som lokker cellen ut i betent vev og ikke bare til lymfeknuter. Effekten av en vaksine er dermed å mangfoldiggjøre spesifikke hukommelsesceller, som umiddelbart kan dra til det infiserte stedet ved en infeksjon (fig 6B). Effektorceller utskiller dessuten inflammatoriske cytokiner som aktiverer en rekke celler, slik som monocytter, makrofager og dendrittiske celler (fig 6B, e-tab 2). Effektorcellen kan drepe virusinfiserte celler (og for eksempel kreftceller) ved å indusere aktivert celledød (apoptose) i målcellene. Alternativt kan effektorceller gi hjelp til B-celler og aktivere dem til å utskille antistoff. Polarisering av effektorfunksjon CD4-positive T-hjelperceller kan inndeles i to grupper med vidt forskjellige effektorfunksjoner, Th1- og Th2-celler. CD4-positive Th1-celler, som ofte kalles inflammatoriske hjelperceller, utskiller interferon-γ (IFN-γ, i tillegg til for eksempel IL-2 og TNF) (e-tab 2). Th1-celler er meget potente til å aktivere monocytter, makrofager og dendrittiske celler. Th1-celler er også helt nødvendige for eliminering av intracellulære bakterier som Mycobacterium leprae og Mycobacterium tuberculosis. I tillegg er Th1-celler spesielt effektive i kampen mot virusinfeksjoner. Videre er det vist at Th Tidsskr Nor Lægeforen nr. 19, 2006; 126
5 MEDISIN OG VITENSKAP celler effektivt kan eliminere kreftceller (25, 26). Th1-celler kan også indusere apoptose i målceller ved at Fas-ligand (FasL) på Th1- cellens overflate binder Fas (CD95) på målcellen (26). For de fleste formål er det derfor ønskelig å indusere Th1-responser ved vaksinering. CD4-positive Th2-celler er dårlige hjelpere av dendrittiske celler og makrofager, men er meget gode hjelpere av B-celler, utskiller IL-4 og IL-13 og er nødvendig for bekjempelse av helmintinfeksjoner. Et viktig poeng er at Th1- og Th2-celler gjensidig hemmer hverandre (tab 2). Dessuten kan dendrittiske celler aktiveres av patogener til å favorisere den ene eller andre responstypen. Lipopolysakkarid (LPS) fra patogene og mindre patogene bakterier induserer henholdsvis Th1- og Th2-responser, sannsynligvis grunnet forskjellig TLR4-signalering (27). Det er vist at selekterte TLR-ligander kan polarisere responsen mot Th1-celler ved stimulering av humane dendrittiske celler (28, 29). Legering av TLR2 kan indusere Th2- responser (30 32). En effektiv virusvaksine mot gulfeber (YF-17D) resulterer i både Th1- og Th2-responser (med Th1-overvekt) (21). Dersom YF-17D-vaksinerte mus mangler TLR2, utvikles en kraftig Th1-respons (21). I lys av slike resultater, pågår en aktiv forskning for å utvikle vaksiner som favoriserer Th1-responser. Eksempelvis induserer Hiv- Gag-protein koblet til TLR7/9-agonister en kraftig og vedvarende Th1-respons i tillegg til CD8-positiv T-cellerespons hos aper (33). Lisensiering av dendrittiske celler CD4-positive T-celler potenserer antigenpresentasjonsfunksjonen av dendrittiske celler ved hjelp av membranbundet CD40-ligand (CD40L), som binder CD40 på de dendrittiske cellene. Dermed bedres cellens evne til å presentere til naive CD8-positve T- celler, en mekanisme som kalles lisensiering av dendrittiske celler (34). I tillegg utskiller CD4-positive T-celler cytokiner, for eksempel IL-2 og IL-15, som parakrint tilfører vekstfaktorer for CD8-positive T-celler (etab 2). CD8-positive cytotoksiske T-lymfocytter (CTL) har som hovedfunksjon å drepe virusinfiserte celler. Det er altså en stor fordel for virale vaksineantigener at det finnes epitoper som aktiverer både CD4-positive (med lisensiering av dendrittiske celler) og CD8-positive celler. Etter aktivering vil virusspesifikke CD4- positive T-celler og CD8-positive T-celler endre sine kjemokinreseptorer på overflaten og erverve evnen til å vandre til betent vev (fig 6B). Når gutten James Phipps igjen fikk en inokulering, denne gangen med koppevirus, hadde han T-celler som kunne dra direkte til det aktuelle virusinfiserte vevet. Koppevirusinfiserte celler ble dermed angrepet av koppespesifikke CD8-positive T-celler, som induserte apoptose i målcellene. Som støtte til CD8-positive T-celleresponser vil Figur 4 Vaksinering, aktivering og migrering av dendrittiske celler. A. Dendrittiske celler, eksempelvis langerhansceller i huden og subkutane umodne dendrittiske celler, tar opp ekstracellulærvæsken ved makropinocytose. Proteiner som tas opp, brytes ned til peptidfragmenter, og peptidene binder seg til gropen av MHC-molekyler (HLA-molekyler). Dendrittiske celler har en lang rekke med mønstergjenkjennelsesreseptorer (MGR). Når MGR binder bakterie eller virus, aktiveres cellen. MGR kan også føre til reseptormediert opptak av det bundne antigenet. På tilsvarende måte, kan antigener som påheftes komplementfaktorer (for eksempel C3b), aktivere og modne dendrittiske celler via komplementreseptorer (CR1, CD35) og føre til fagocytose. Dette kalles opsonisering. B. På umodne dendrittiske celler er det få MHC-molekyler på overflaten, da MHC- molekyler i løpet av mindre enn en time resirkuleres inn i cellen. Ved modning fraktes MHC-molekyler med peptid i gropen til overflaten og forblir der. Modningen medfører også at cellen begynner å uttrykke såkalte kostimulerende molekyler (CD80, CD86), som er viktig for effektiv aktivering av T-celler. C. I løpet av modningen uttrykker cellen kjemokinreseptorer som CCR7. CCR7 gjør at cellen kan binde kjemokinet CCL21 (tidligere kalt SLC). Dette gjør den dendrittiske cellen følsom for CCL21- kjemokingradienter slik at den kan vandre inn i vevsdrenerende lymfekar. D. Dendrittiske celler vandrer med lymfekaret ned til første drenerende lymfeknute. Her tar den seg ned gjennom lymfeknutens trabekelverk av retikulære fibroblaster, hvor den ekstravaserer og vandrer til lymfeknutens T-celleområde, paracortex. På denne måten frakter dendrittiske celler et antigent «øyeblikksbilde», tatt under en infeksjon eller ved en vaksinering, til en av immunsystemets kontrollstasjoner. Her møter den dendrittiske cellen T-celler. T-celler ankommer paracortex ved å ekstravasere gjennom spesialisert endotel, på såkalt høyendotelvenyler (HEV) i lymfeknutens paracortex. Dersom T-cellene gjenkjenner viruspeptider i gropen på MHC-klasse II-molekyler på overflaten til dendrittiske celler, vil T-cellen aktiveres, utskille cytokiner og gjennomgå celledeling. Figuren er modifisert fra (3) Th1-celler utskille cytokiner, som så aktiverer makrofager og bidrar til drap av virusinfiserte celler. Når virusinfiserte celler drepes, hindres videre mangfoldiggjøring av viruset. CD4-positive T-celler hjelper B-celler T- og B-celler samarbeider ved å gjensidig stimulere hverandre. T-cellen hjelper B-cellen til å differensiere til hukommelsesceller eller plasmaceller. Ved en infeksjon eller ved vaksinasjon vil antigener drenere fra vevet til lymfeknuter med den efferente lymfen. B-celler, som hovedsakelig befinner seg i lymfeknutens kortikale follikler, har derfor mulighet til å binde antigener fra et infeksjonsfokus. Dersom en B-celle har en egnet B-cellereseptor med spesifisitet for antigen, binder denne reseptoren antigenet, komplekset internaliseres og antigenet brytes ned til peptidfragmenter. Peptidene lastes deretter opp i gropen på MHC-klasse II-molekyler og fraktes til overflaten av B-cellen. En slik BCR-ligering aktiverer B-cellen til å dra dypere inn i lymfeknuten, hvor den vil kunne treffe CD4-positive T-celler i randsonen rundt follikkelen (3). Dersom B-cellen i utkanten av folliklene finner en CD4- positiv T-celle som gjenkjenner det samme antigenet (nå presentert i form av peptid/ MHC klasse II kompleks), aktiveres T-cellen. T-cellen stimulerer B-cellen både med cytokiner (for eksempel IL-2, IL-4, IL-5, IL- 6, eller IFN-γ (tab 2), og ved CD40L-ligering av B-cellens CD40 (3). Avhengig av kvaliteten og kvantiteten av de mottatte signalene, vil B-cellen enten dele seg utenfor follikkelen og så differensiere til kortlivede IgM-utskillende plasmaceller (primærrespons), eller vende tilbake til follikkelen for å danne et kimsenter og gjennomgå såkalt Tidsskr Nor Lægeforen nr. 19, 2006;
6 Figur 6 Resirkulering av naive T-celler og effektor-t-celler. A. Naive T-celler sirkulerer i blodbanen og passerer ut i lymfeknuters paracortex gjennom spesialiserte venyler kalt høyendotelvenyler (HEV). T-cellene fester seg til HEV-endotelet med selektiner, kjemokinreseptorer (for eksempel CCR7, som binder CCL21), integriner, og ekstravaserer gjennom endotelet ved diapedese. Dermed kommer T-cellene inn i det ekstravaskulære paracortexvevet og kan reagere på dendrittiske celler lastet opp med antigener fra kroppens mange vev. T-cellene migrerer deretter innover i lymfeknuten til margsinuser som samles til efferente lymfekar. Lymfekarene samles i ductus thoracicus, som tømmer seg i v. subclavia. B. Effektor-T-celler erverver et annet sett med kjemokinreseptorer på overflaten. I infisert vev aktiveres makrofager til å utskille kjemokiner (som for eksempel CCL2, tidligere kalt MIP-1α, CCL2, tidligere MCP-1. T-celler som har kjemokinreseptorer som kan binde disse kjemokinene (henholdsvis CCR1, 4, 5; CCR2, 4, 9), vil stanse opp ved infeksjonsfokus og ekstravasere. I vevet kan T-cellene aktiveres og utøve sin effektorfunksjon, interagere med DC og makrofager (CD40L-CD40, m.fl.), utskille inflammatoriske cytokiner, som IFN-γ, TNF, og drepe målceller (via FasL-Fas-interaksjon). Etter at infeksjonen er bekjempet, kan T-celler migrere tilbake via lymfekar, til blodbanen. Figuren er modifisert fra (3) Figur 7 Peyerske plakk og mucosaassosiert lymfoid vev (MALV). A. I tynntarm finnes peyerske plakk, strukturer som konseptuelt likner lymfeknuter ved å ha B-cellefollikler, T-celleområder og høyendotelvenyler (3). B. Det er imidlertid ingen efferent lymfe, men spesialiserte epitelceller (M-celler) som frakter antigener over epitelet til T-cellene, B-cellene og dendrittiske celler i submucosa (3). Det finnes også spredte dendrittiske celler, både her og i andre slimhinner, som har lange utløpere som strekker seg ut i lumen. Dersom slike dendrittiske celler treffer på patogener som binder MGR, vil den dendrittiske cellen fagocyttere patogenet, aktiveres og dra til drenerende lymfeknuter hvor antigener presenteres. Flesteparten av B-celler, og en stor andel av T-celler i kroppen finnes i mucosaassosiert lymfoid vev (MALV), både i fokale områder, som peyerske plakk eller tonsiller, eller diffust i submucosa. Plasmaceller utskiller IgA-dimerer med J-kjede, som binder poly-ig-reseptor PIgR på overflaten av epitelceller (37). Komplekset transcytteres og PIgR kuttes av proteolyttiske enzymer. Den delen av PIgR som er bundet til IgA etter proteolyse, kalles sekretorisk komponent og beskytter mot proteolyse. Luminalt IgA vil kunne binde bakterier og forhindre at bakterier kan binde seg til epitelceller. Ved tilstedeværelse av patogener i tarmen ligeres MGR på epitelceller, uttrykket av PIgR oppreguleres, og uttransportering av IgA effektiviseres (38). Vaksiner som får tilgang til MALV gjennom M-celler, eller via aktiverte dendrittiske celler, vil kunne aktivere T- og B-celler. Som for andre vaksiner spiller sannsynligvis MGR en stor rolle for kvaliteten av immunresponsen. Figuren er modifisert fra (3) somatisk hypermutasjon (sekundærrespons) (3). De kortlivede plasmacellene står for den såkalte primærresponsen, hvor lavaffinitets IgM-antistoffer utskilles. IgM består av fem (eller seks) antistoffmonomerer (H 2 L 2 ) 5/(6) (35) og er en meget effektiv komplementaktivator. På tross av en lav affinitet finnes ti (eller 12) antigenbindingssteder. Man sier derfor at IgM har høy bindingsaviditet. Kimsenterreaksjonen er grunnlaget for den såkalte sekundærresponsen. I B-cellefollikler finnes en spesialisert celle kalt follikulærdendrittisk celle (FDC). Denne celletypen har et annet opphav enn dendrittiske celler og mangler MHC-klasse II-molekyler, men har rikelig med komplementreseptorer og Fc-reseptorer (3). Antigener som aktiverer komplement eller som binder IgG, dekker derfor follikulærdendrittiske celler. B- celler som aktiveres, gjennomgår en meget kraftig celledeling hvor deres antistoffreseptorgener muteres i en aktiv prosess der AIDproteinet (activation-induced deaminase) er sentralt (36). B-celler med hensiktsmessige mutasjoner binder bedre antigen på overflaten av follikulærdendrittisk celler. De klarer derfor mer effektivt å ta opp antigenet og presentere til CD4-positive T-celler og selekteres dermed for videre overlevelse. T- celle CD40L ligerer CD40 på B-cellens overflate og induserer isotypeskifte, for eksempel fra IgM til IgG. Det er deretter to differensieringsmuligheter: B-cellen kan enten vandre til beinmargen og bli langlivede plasmaceller, eller bli hukommelsesceller klare til å reagere på en reinfeksjon (3). Plasmaceller utskiller 100 millioner antistoffmolekyler per sekund og overlever flere år i beinmargen. På denne måten får man en langvarig humoral immunitet der høyaffinitets isotypeskiftede antistoffer er ferdig fremstilt til neste smitteeksponering (3). Den vaksinerte James hadde altså sannsynligvis høyaffinitets IgG-antistoffer med spesifisitet for kukoppevirus i plasma og ekstracellulærvæsken. Når han så ble eksponert for koppevirus, kunne slike antistoffer kryssreagere med viruset og hindre videre spredning. I forhold til moderne vaksinestrategier er det mulig at B-celler er sekundære i forhold til hensynet til optimal DC-aktivering. Det er likevel vist at B-celler reagerer meget godt på MGR-ligander som CpG og LPS, og at B-celler uttrykker en rekke TLR. Antigener som aktiverer komplement er også ganger mer effektive til å fremkalle antistoffer i sekundærresponsen enn antigen som ikke er bundet til komplementfaktorer. Denne kraftige effekten forklares ved at B-celler har reseptor for komplementfaktor C3d og interaksjon med antigen-c3d komplekser på follikulærdendrittiske celler (3). Altså er det slik at B-celleresponser optimaliseres i nærvær av patogener eller deres produkter (CpG, o.l.), et fenomen som det er mulig å simulere ved vaksinering Tidsskr Nor Lægeforen nr. 19, 2006; 126
7 MEDISIN OG VITENSKAP Antistoffeffektorfunksjoner Antistoffisotyper varierer i evne til å igangsette biologiske effektorfunksjoner. Dette gjelder komplementaktivering, opsonisering (via Fc-reseptorer) og antistoffavhengig cellulær cytotoksisitet. Som en grov hovedregel kan man si at CD4-positive Th1-celler hjelper B-celler til å gjennomgå isotypeskifte til isotyper som er mer effektive ved disse tre prosessene. CD4-positive Th2-celler induserer IgE, som er nødvendig for immunresponser mot helminter. I tillegg induseres andre isotyper og subklasser av IgG. Også for B-celleresponser er det altså hensiktsmessig at dendrittiske celler igangsetter Th1-responser. Virussmittede celler vil også kunne uttrykke enkelte virusproteiner på sin overflate som antistoffer kan binde. Antistoffbinding til celleoverflater resulterer både i komplementaktivering og i antistoffavhengig cellulær cytotoksisitet. I dette siste angripes antistoffmerkede celler av Fc-reseptorbærende celler som NK-celler (3). MHC-peptidbindingslommer MHC-molekyler har meget stor interindividuell variasjon (3). Dette har konsekvenser for vaksinasjonsstrategier da MHC-molekyler varierer sterkt i evnen til å binde definerte peptider. I den peptidbindende gropen finnes lommer hvor bestemte aminosyrer eller sidekjeder kan feste seg. Slike lommer varierer i stor grad mellom personers HLA-molekyler. Det er derfor også oftest forskjellige peptider som presenteres fra et antigent protein hos forskjellige personer. På befolkningsnivå er det dermed som regel mer effektivt å vaksinere med preparater som inneholder hele proteiner, for å sikre at hver enkelt vaksinerte person blir immunisert med et protein som inneholder peptider det er mulig å binde og presentere. Immunitet i slimhinner Slimhinner og mucosaassosiert lymfoid vev (MALV) er meget viktig i vårt forsvar mot patogener (fig 7) (3, 37, 38). Det er ikke hensiktsmessig å reagere immunologisk mot matantigener, kroppen må altså klare å skille bakterier/virus fra for eksempel hveteproteiner (39). Dette kalles oral toleranse. Vaksiner som leveres gjennom slimhinner må altså fremstå som patogent. Mye tyder på at mønstergjenkjennelsesreseptorer har stor betydning for effektiviteten av slike vaksiner. Terapeutiske vaksiner og kreft Kreftceller kan overuttrykke proteiner, uttrykke muterte eller posttranslasjonelt modifiserte proteiner eller uttrykke helt unike tumor spesifikke proteiner, for eksempel hos kreftceller i B-cellerekken, som kan presentere BCR V-region- peptidsekvenser på MHC klasse II. Det er vist at både CD4-positive T-celler og CD8-positive T-celler kan spesifikt angripe kreftceller, et konsept som kalles immunovervåking (25, 26). På samme måte som for mikroorganismer, er optimal immunaktivering nødvendig for adekvate immunresponser mot kreftcellen. Resultater fra vaksineringsforsøk og immunterapi er noe blandet, men lovende. Det pågår en utstrakt internasjonal forskning for å utvikle og optimalisere effektive terapeutiske vaksiner. Jeg takker Hilde Omholt, Gro Tunheim og Hege Bunkholt Elstrand for kommentarer til manuskriptet. e-tab 2, e-fig 2 og e-fig 5 finnes i artikkelen på Litteratur 1. Jenner E. An inquiry into the causes and effects of the variolae vaccinae. London, Stewart AJ, Devlin PM. The history of the smallpox vaccine. J Infect 2005; 52: Bogen B, Munthe LA. Immunologi. Oslo: Universitetsforlaget, Brown JH, Jardetzky TS, Gorga JC et al. Threedimensional structure of the human class II histocompatibility antigen HLA-DR1. Nature 1993; 364: Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity. Cell 2006; 124: Poltorak A, He X, Smirnova I et al. Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene. Science 1998; 282: Ozinsky A, Underhill DM, Fontenot JD et al. The repertoire for pattern recognition of pathogens by the innate immune system is defined by cooperation between toll-like receptors. Proc Natl Acad Sci U S A. 2000; 97: Takeuchi O, Hoshino K, Akira S. Cutting edge: TLR2-deficient and MyD88-deficient mice are highly susceptible to Staphylococcus aureus infection. J Immunol 2000; 165: Takeuchi O, Kawai T, Muhlradt PF et al. Discrimination of bacterial lipoproteins by Toll-like receptor 6. Int Immunol 2001; 13: Hemmi H, Takeuchi O, Kawai T et al. A Toll-like receptor recognizes bacterial DNA. Nature 2000; 408: Alexopoulou L, Holt AC, Medzhitov R et al. Recognition of double-stranded RNA and activation of NF-kappaB by Toll-like receptor 3. Nature 2001; 413: Hayashi F, Smith KD, Ozinsky A et al. The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5. Nature : Gantner BN, Simmons RM, Canavera SJ et al. Collaborative induction of inflammatory responses by dectin-1 and Toll-like receptor 2. J Exp Med 2003; 197: Krutzik SR, Ochoa MT, Sieling PA et al. Activation and regulation of Toll-like receptors 2 and 1 in human leprosy. Nat Med 2003; 9: Hochrein H, Schlatter B, O Keeffe M et al. Herpes simplex virus type-1 induces IFN-alpha production via Toll-like receptor 9-dependent and -independent pathways. Proc Natl Acad Sci USA. 2004; 101: Krug A, French AR, Barchet W et al. TLR9-dependent recognition of MCMV by IPC and DC generates coordinated cytokine responses that activate antiviral NK cell function. Immunity 2004; 21: Yoneyama M, Kikuchi M, Matsumoto K et al. Shared and unique functions of the DExD/H-box helicases RIG-I, MDA5, and LGP2 in antiviral innate immunity. J Immunol 2005; 175: Heil F, Hemmi H, Hochrein H et al. Species-specific recognition of single-stranded RNA via tolllike receptor 7 and 8. Science 2004; 303: Kurt-Jones EA, Popova L, Kwinn L et al. Pattern recognition receptors TLR4 and CD14 mediate response to respiratory syncytial virus. Nat Immunol 2000; 1: Bieback K, Lien E, Klagge IM et al. Hemagglutinin protein of wild-type measles virus activates tolllike receptor 2 signaling. J Virol 2002; 76: Querec T, Bennouna S, Alkan S et al. Yellow fever vaccine YF-17D activates multiple dendritic cell subsets via TLR2, 7, 8, and 9 to stimulate polyvalent immunity. J Exp Med 2006; 203: Pulendran B, Ahmed R. Translating innate immunity into immunological memory: implications for vaccine development. Cell 2006; 124: Tonegawa S. Somatic generation of antibody diversity. Nature 1983; 302: Schulz O, Diebold SS, Chen M et al. Toll-like receptor 3 promotes cross-priming to virus-infected cells. Nature 2005; 433: Corthay A, Skovseth DK, Lundin KU et al. Primary antitumor immune response mediated by CD4+ T cells. Immunity 2005; 22: Dunn GP, Old LJ, Schreiber RD. The three Es of cancer immunoediting. Annu Rev Immunol 2004; 22: Pulendran B, Kumar P, Cutler CW et al. Lipopolysaccharides from distinct pathogens induce different classes of immune responses in vivo. J Immunol 2001; 167: Napolitani G, Rinaldi A, Bertoni F et al. Selected Toll-like receptor agonist combinations synergistically trigger a T helper type 1-polarizing program in dendritic cells. Nat Immunol 2005; 6: Roelofs MF, Joosten LA, Bdollahi-Roodsaz S et al. The expression of toll-like receptors 3 and 7 in rheumatoid arthritis synovium is increased and costimulation of toll-like receptors 3, 4, and 7/8 results in synergistic cytokine production by dendritic cells. Arthritis Rheum 2005; 52: Pulendran B, Kumar P, Cutler CW et al. Lipopolysaccharides from distinct pathogens induce different classes of immune responses in vivo. J Immunol 2001; 167: Dillon S, Agrawal A, Van Dyke T et al. A Toll-like receptor 2 ligand stimulates Th2 responses in vivo, via induction of extracellular signal-regulated kinase mitogen-activated protein kinase and c-fos in dendritic cells. J Immunol 2004; 172: Netea MG, Sutmuller R, Hermann C et al. Toll-like receptor 2 suppresses immunity against candida albicans through induction of IL-10 and regulatory T cells. J Immunol 2004; 172: Wille-Reece U, Flynn BJ, Lore K et al. HIV Gag protein conjugated to a Toll-like receptor 7/8 agonist improves the magnitude and quality of Th1 and CD8+ T cell responses in nonhuman primates. Proc Natl Acad Sci USA 2005; 102: Ridge JP, Di RF, Matzinger P. A conditioned dendritic cell can be a temporal bridge between a CD4+ T-helper and a T-killer cell. Nature 1998; 393: Sorensen V, Rasmussen IB, Sundvold V et al. Structural requirements for incorporation of J chain into human IgM and IgA. Int Immunol 2000; 12: Honjo T, Nagaoka H, Shinkura R et al. AID to overcome the limitations of genomic information. Nat Immunol 2005; 6: Brandtzaeg P, Johansen FE. Mucosal B cells: phenotypic characteristics, transcriptional regulation, and homing properties. Immunol Rev 2005; 206: Schneeman TA, Bruno ME, Schjerven H et al. Regulation of the polymeric Ig receptor by signaling through TLRs 3 and 4: linking innate and adaptive immune responses. J Immunol 2005; 175: Sollid LM, Jabri B. Is celiac disease an autoimmune disorder? Curr Opin Immunol 2005; 17: Manuskriptet ble mottatt og godkjent Medisinsk redaktør Petter Gjersvik. Tidsskr Nor Lægeforen nr. 19, 2006;
8 Det norske vaksinasjonsprogrammet Sammendrag Vaksineutviklingen har på mange måter vært «det muliges kunst», der man hele tiden har fulgt opp dagens kunnskap om infeksjoner og mikrober med nye preparater. Enhver vaksinasjon har som formål å forebygge sykdom. Vaksiner som brukes i et vaksinasjonsprogram, har dessuten et mål utover å beskytte enkeltindividet, nemlig å endre epidemiologien for den aktuelle sykdommen. I løpet av de kommende ti år vil vi få tilgang til flere vaksiner, men det er lite sannsynlig at det norske vaksinasjonsprogrammet blir radikalt forandret. På lengre sikt kan man tenke seg at økte kunnskaper om immunapparatet gjør det mulig å bygge opp vaksinasjonsprogrammet på en helt ny måte. Kanskje kan vaksiner hjelpe oss til å styre immunforsvaret slik at vi oppnår god generell beskyttelse mot sykdom, lite allergi og lite autoimmune sykdommer i tillegg til beskyttelse mot spesifikke infeksjoner. Engelsk sammendrag finnes i artikkelen på Oppgitte interessekonflikter: Ingen > Se også side 2504 Hanne Nøkleby hanne.nokleby@fhi.no Berit Feiring Nasjonalt folkehelseinstitutt Postbok 4404 Nydalen 0403 Oslo Moderne vaksinehistorie begynner med koppevaksinen i Starten bygger på kombinasjonen av en skarp observasjon og flaks (1). Først omkring 100 år senere, da verden fikk forståelse for bakterienes rolle i infeksjonssammenheng, kom grunnlaget for et systematisk arbeid. En rekke bakterier ble dyrket, drept og forsøkt som vaksiner. Vellykket behandling av difteri og tetanus med antitoksin fra hest ga grunnlag for utvikling av toksoidvaksiner. Med virologien kom virusvaksinene. Genteknologiens fremvekst ga store forhåpninger om nye vaksinemuligheter, men de er til nå bare i beskjeden grad innfridd. Slik har vaksineutviklingen på en måte vært «det muliges kunst», der man hele tiden fulgte opp dagens kunnskap med nye preparater. Noen vaksiner har overlevd nærmest uendret i nær 100 år, andre har gått i glemmeboken. De som er valgt ut til vaksinasjonsprogrammer, har likevel hatt spesielle egenskaper. Vaksinasjonsprogrammets utvikling Samlet sett er bruk av vaksiner sannsynligvis vår viktigste strategi i kampen mot sykdommer. Enhver vaksinasjon har som formål å forebygge sykdom. Men vaksinasjonsprogrammer har større siktemål: ikke bare å beskytte enkeltindividet, men å endre epidemiologien for sykdommen. Det mest ambisiøse målet er å utrydde sykdommen. Det har verden klart med kopper, og vi er nær målet for poliomyelitt (2). Mer beskjedne mål er å hindre smitte innen et land eller et større geografisk område (meslinger), eller å redusere forekomsten så mye at det også gir en viss beskyttelse av dem som ikke er vaksinert (kikhoste). Slike mål forutsetter at man når frem til store deler av målgruppen. Hvilken vaksinasjonsdekning som må til, sannsynligheten for å oppnå tilstrekkelig høy dekning og hva man risikerer hvis målet ikke nås, er spørsmål som må tas opp til vurdering før programmet startes. Risikoen ved et dårlig gjennomført program kan være at sykdommen forskyves til en annen aldersgruppe, der skadene blir langt større (3). Også vaksinasjonsprogrammet begynte med koppevaksine. I Danmark-Norge ble vaksinen påbudt i 1810, selv om påbudet neppe ble særlig strengt håndhevet. Vaksinen inngikk i vårt vaksinasjonsprogram i over 160 år, hele tiden som påbudt vaksine (tab 1). Tuberkulose var en fryktet sykdom på og 1900-tallet. Bedre levekår er den viktigste grunnen til tuberkulosen nesten har forsvunnet i vårt land. Men i 1947 var frykten for sykdommen fortsatt så stor at BCGvaksine ble tatt inn i vaksinasjonsprogrammet. I motsetning til de fleste andre land valgte Norge ikke å vaksinere spedbarn, men derimot tenåringer, på vei fra den obligatoriske skolen til «det virkelige livet», fordi det var da smitterisikoen var størst hos oss. BCG-vaksinen var påbudt de første årene, mens alle vaksiner som senere er tatt inn i programmet har vært frivillige. Da smittevernloven kom i 1995, ble også BCG-vaksinering frivillig. I dagens situasjon vurderes det om BCG-vaksine bør tas ut av det generelle programmet og bare tilbys grupper med økt risiko for tuberkulosesmitte. Difteriepidemiene herjet under den annen verdenskrig, og mange barn og voksne ble vaksinert. Vaksinen ble imidlertid ikke en del av et allment program før ti år senere, da den ble tilgjengelig som kombinasjonsvaksine sammen med vaksine mot tetanus og kikhoste (DTP-vaksine). Det siste var nok en fryktet sykdom. Den ble regnet blant barnesykdommene, som alle barn skulle gjennom, men var likevel årsak til mye lidelse, flere tilfeller av varige hjerneskader og noen dødsfall hvert år. Etter de store polioepidemiene i begynnelsen av 1950-årene, var poliomyelitt den store skrekken for mange foreldre. Poliovaksinen ble derfor tatt imot med stor glede i! Hovedbudskap Vaksinasjon har gjort alvorlige og tidligere vanlige sykdommer sjeldne Kravene til sikkerhet må være høyere for vaksiner enn for andre legemidler, fordi vaksine gis til et stort antall friske individer På lengre sikt kan modifisering av immunforsvaret gjennom vaksinering også gi gevinster utover beskyttelse mot bestemte sykdommer 2538 Tidsskr Nor Lægeforen nr. 19, 2006; 126:
9 MEDISIN OG VITENSKAP Vaksinasjonsdekningen var høy. Problemet var å skaffe vaksine til alle som ville ha (4). Innføring av vaksine mot meslinger var kanskje den første delen av programmet som skapte betydelig debatt her i landet (5). Meslinger hadde da alle hatt, det kunne vel ikke være farlig? For første gang var det vanskelig å få vaksinasjonsdekningen for en programvaksine opp mot 80 %, med den risikoen det innebærer for forskyvning av sykdommen til en aldersgruppe der konsekvensene kunne være mer alvorlige. Derimot var det ingen uenighet om at røde hunder var en meget alvorlig sykdom for gravide. Det var derfor liten motstand da vaksine mot røde hunder ble tilbudt jenter i ungdomsskolen i Større var usikkerheten da kombinasjonsvaksinen mot meslinger, kusma og røde hunder kom inn i programmet (6). Var det virkelig riktig å gi vaksine mot røde hunder til alle småbarn? Erfaring fra Norge og andre land har vist at dette var nødvendig og tilstrekkelig til å gjøre medfødt rubellasyndrom til historie (tab 1). Vaksinasjonsprogrammet i 2006 Muligheten til å forebygge en alvorlig sykdom med stor utbredelse har vært forutsetningen for å innlemme en vaksine i det norske vaksinasjonsprogrammet. Frem til 1990 var alle vaksiner i programmet (unntatt tetanusvaksine) rettet mot sykdommer som rammet de aller fleste, selv om langt fra alle fikk alvorlige forløp med komplikasjoner. Dette bildet ble annerledes da Hib-vaksinen ble innført. Haemophilus influenzae serotype b var uten tvil den bakterien som ga flest tilfeller av alvorlig invasive infeksjoner hos barn i de første fem leveårene, men det var bare et par hundre barn som ble rammet hvert år (7). Vaksinen virker kun mot type b, ikke mot de typene som er vanlig årsak til mer banale luftveisinfeksjoner. Det var likevel enighet om at sykdommen var så alvorlig for dem som ble rammet, at det var riktig å gi vaksinen til alle norske spedbarn (tab 2). Det samme argumentet kommer inn i enda sterkere grad når vi nå innfører sjuvalent pneumokokkonjugatvaksine. Det er ingen tvil om at alvorlige, invasive pneumokokkinfeksjoner forekommer hyppigere i de første to leveårene enn hos eldre barn. Det er heller ikke tvil om at vaksinen er effektiv (8). Den har også en viss effekt mot pneumoni og otitt (9), men bare en mindre del av disse infeksjonene er forårsaket av de pneumokokktypene som inngår i vaksinen. Totalt vil bare et fåtall av barna ha direkte nytte av pneumokokkvaksinen. Sykdommens konsekvenser gjør det likevel riktig å vaksinere alle. Vaksiner gis til tusenvis av barn for å hindre alvorlig sykdom som bare rammer en prosent eller enda færre. Det skiller vaksiner fra terapeutiske legemidler. Derfor er kravene til grundige utprøvninger på forhånd, Tabell 1 Innføring av vaksiner i vaksinasjonsprogrammet i Norge Vaksine Tatt i bruk Kommentarer Koppevaksine 1810 Påbudt. I programmet til 1976 BCG-vaksine 1947 Tenåringer. Påbudt til 1995, deretter frivillig DTP-vaksine 1952 Spedbarn. Frivillig Poliovaksine 1956 Skolebarn og spedbarn. Frivillig. Meslinger måneder. Frivillig. Erstattet av MMR Røde hunder 1978 Jenter i ungdomsskolen. Erstattet av MMR MMR måneder og 12 år. Frivillig Hib 1992 Spedbarn. Frivillig Pneumokker 2006 Spedbarn. Frivillig Tabell 2 Vaksinasjonsprogrammet i Norge i 2006 Alder Vaksine mot 3, 5 og 12 måneder Difteri, tetanus, kikhoste, poliomyelitt, Hib, pneumokokkinfeksjon 15 måneder Meslinger, kusma og røde hunder 7 8 år Difteri, stivkrampe, kikhoste, poliomyelitt 12 år Meslinger, kusma og røde hunder Ungdomsskolealder Tuberkulose, difteri, stivkrampe, poliomyelitt Tabell 3 Mulige nye vaksiner i vaksinasjonsprogrammet i 2016 Sykdommer det kan bli aktuelt å vaksinere mot Vaksinens status Kommentarer Hepatitt B Tilgjengelig Epidemiologi og behov i Norge må vurderes løpende. Kan bli aktuelt ved endringer. Tenåringsprogram? Vannkopper Tilgjengelig Behov og ventet effekt må vurderes løpende. Tilbud til ikke-immune tenåringer? Meningokokker gruppe C (eller ACYW) Tilgjengelig først og fremst med tanke på sikkerhet, strengere for vaksiner enn for noe annet legemiddel. En vaksine er som en forsikring, noe alle trenger fordi vi ikke vet hvem som blir rammet. Så langt det på noen måte er mulig, må det derfor sikres at vi ikke risikerer uventede, alvorlige reaksjoner med varige følger (10). Sikkerheten for vaksinene i dagens vaksinasjonsprogram er underbygd av erfaring fra bruk av mange millioner doser. Kan bli aktuelt hvis forekomsten i Norge øker Hepatitt A Tilgjengelig Fortsatt en reisevaksine? Influensavaksine til småbarn Tilgjengelig Måtte gis årlig til definerte aldersgrupper. Vil trolig bli vurdert HPV-virus Tilgjengelig 2006/2007 Vil trolig bli innført når dokumentasjonen vurderes som tilstrekkelig Rotavirus Tilgjengelig 2006 Epidemiologi og behov i Norge er under vurdering Herpes simplex Kliniske utprøvninger pågår Vurderes når den blir tilgjengelig RSV Hiv Utvikling pågår, men går langsomt. Neppe tilgjengelig før 2016 Terapeutiske vaksiner er kommet langt, men generell, profylaktisk vaksine er vanskelig. Neppe tilgjengelig før 2016 Bør innføres til spedbarn når den blir tilgjengelig Vil sannsynligvis bli innført når den kommer Om ti år nye vaksiner, men ingen revolusjon Da genteknologien gjorde sitt inntog i årene, var forventningene til nytten av slike teknikker i vaksinesammenheng skyhøye. Hittil har resultatene imidlertid vært moderate. Vaksinetilbudet domineres av «gammeldagse» vaksiner. Alle vaksiner i programmet er laget med tradisjonelle teknikker. De består av inaktiverte mikrober (hele eller deler), levende svekkede mikrober eller Tidsskr Nor Lægeforen nr. 19, 2006;
10 avgiftede toksiner. I global sammenheng har likevel én genteknologisk fremstilt vaksine vært et meget viktig fremskritt, vaksine mot hepatitt B. Det er imidlertid signaler som tyder på at dette nå er i ferd med å endre seg. Flere nye vaksiner, utviklet ved hjelp av genteknologiske metoder, er på trappene. Vaksine mot humant papillomvirus (HPV-vaksine) og rotavirus er her allerede (11, 12). Vaksine mot herpesinfeksjoner er ikke kommet så langt, men også her er det gjort fremskritt. Det er fortsatt vanskelig å komme frem til en vaksine mot RS-virus. De katastrofale forsøkene med slik vaksine i 1960-årene, der de vaksinerte fikk langt mer alvorlig sykdom enn de ikke-vaksinerte (13), gjør at forsøkene går langsomt fremover. Samtidig er dette en av de vaksinene barnemedisinen venter mest utålmodig på. Lokale epidemiologiske forhold er medvirkende til at vaksinasjonsprogrammet er forskjellig fra land til land. I Norge inngår ikke vaksine mot hepatitt B, meningokokk gruppe C og vannkopper i vaksinasjonsprogrammet, fordi sykdommene og/eller deres komplikasjoner er sjeldne i vårt land. Endringer i epidemiologi eller nye vurderinger kan føre til at vi velger å innføre generell vaksinasjon mot disse sykdommene også her i landet. I de nærmeste årene vil det sannsynligvis bli utviklet flere kombinasjonsvaksiner. Det vil være nødvendig for å få gitt de vaksiner vi ønsker uten å komme opp i et uakseptabelt antall stikk. Men det har flere ganger vist seg vanskelig å oppnå samme effekt som av enkeltvaksinene når flere vaksiner kombineres i én injeksjon. Så lenge hver vaksine må lages for seg og deretter blandes med de andre, er utvikling og produksjon av kombinasjonsvaksiner arbeids- og kostnadskrevende, og antall komponenter i hver vaksine vil være begrenset. Det arbeides også med å utvikle vaksiner som kan gis på andre måter enn ved injeksjon, først og fremst på slimhinner (peroralt, nesedråper), men også transkutant (plaster). Vaksineutvikling er så kostnadskrevende at man neppe vil bruke mye ressurser på å omformulere godt fungerende vaksiner til slike presentasjonsformer, men for nye vaksiner gir dette flere muligheter. I vaksinasjonsprogrammet frem mot 2016 kan vi vente flere nye vaksiner, kanskje nye vaksinasjonsregimer og kanskje bruk i andre aldersgrupper. Det mest sannsynlige er likevel at det ikke blir noen prinsipielle endringer i programmet slik vi kjenner det i dag (tab 3). Vaksinasjonsprogram for eldre? Hittil har «vaksinasjonsprogram» i praksis vært synonymt med barnevaksinasjonsprogrammet. Flere sykdommer slår imidlertid først og fremst til i livets ytterfaser, dvs. hos de yngste og de eldste. Vaksinering av eldre dukker derfor opp som et aktuelt og viktig tema. Årlig vaksinering mot influensa er anbefalt for alle over 65 år. Helse- og omsorgsdepartementet sendte våren 2006 på høring et forslag til en ny forskrift, som gjør dette til en del av det nasjonale vaksinasjonsprogrammet. Generell vaksinering av eldre mot pneumokokkinfeksjon er også anbefalt. Det kan bli en del av samme program. En vaksine mot herpes zoster er under utvikling, først og fremst beregnet på eldre. Den kan bli særlig viktig hvis vi velger å ta i bruk generell vaksinering mot vannkopper. Redusert forekomst av vannkopper gir mindre mulighet for naturlig boostring av immuniteten. Risikoen for å utvikle herpes zoster i høyere alder vil sannsynligvis øke (14). Det kan derfor være nyttig å se disse to vaksinene i sammenheng, når vi skal vurdere deres rolle i vaksinasjonsprogrammet. Om 20 år nye måter å tenke på? I de senere år er vi blitt klar over at vaksiner kan ha andre og mer uspesifikke effekter i tillegg til å beskytte mot en konkret sykdom. Det viste seg første gang da en meslingvaksine utviklet for å ha effekt allerede fra tre måneders alder, ble utprøvd i Afrika. Vaksinen var effektiv mot meslinger. Men da barna var fulgt opp til tre års alder, hadde jenter som hadde fått den nye vaksinen en total overdødelighet i forhold til dem som var vaksinert på tradisjonell måte (15). Epidemiologiske oppfølgingsundersøkelser tyder på at det ikke skyldtes problemer med den nye vaksinen, men en generell positiv effekt på overlevelse av den konvensjonelle meslingvaksinen. En tilsvarende positiv effekt er vist av BCG-vaksine til nyfødte, mens resultatene knyttet til DTP-vaksine er langt mer tvilsomme (16). Dette viser først og fremst at det er mye vi ikke vet om effekten av vaksiner, og for den saks skyld av infeksjoner, i tidlig barnealder. Sannsynligvis henger slike effekter sammen med hvordan stimuli spiller på det medfødte infeksjonsforsvaret (17), eller hvordan de er med på å styre immunapparatet i forskjellige retninger. Foreløpig må vi først og fremst ha dette i tankene hvis gamle vaksiner skal byttes ut med nye. Det er stort behov for en bedre vaksine mot tuberkulose i store deler av verden, men utprøvninger av nye vaksiner til spedbarn må sikre at vi ikke bare får effekt mot tuberkulose, men også opprettholder den gunstige effekten på generell overlevelse. I løpet av de neste 20 år vil vår viten om immunsystemet kanskje bli så stor at vi kan bruke den til å bygge opp det ideelle vaksinasjonsprogrammet. Gjennom bruk av de rette antigenene, og ikke minst riktig adjuvans (stoff som tilsettes for å øke responsen mot vaksineantigenene), på riktig tidspunkt, kan et vaksinasjonsprogram bidra til å målrette vårt immunforsvar. Målet vil være god generell beskyttelse mot sykdom, lite allergi og lite autoimmune sykdommer i tillegg til de spesifikke vaksineeffektene vi drar nytte av allerede i dag. Det er neppe noen som i dag tør å si hvordan et slikt program vil se ut. Men det er spennende utsikter, og mulighetene overgår sannsynligvis det vi kan forestille oss. Litteratur 1. Jenner E. An inquiry into the causes and effects of the variolae vaccinae, a disease discovered in some of the western counties in England, particularly Gloucestershire and known by the name of cow pox. London Trykt i: Camac CNB, red. Classics of medicine and surgery. New York: Dover, Progress towards global poliomyelitis eradication: preparation for the oral poliovirus vaccine cessation era. WHO WER 2004; 79: Panagiotopoulos T, Antoniadou I, Valassi-adam E. Increase in congenital rubella occurrence after immunisation in Greece: retrospective survey and systematic review. BMJ 1999; 319: Ørstavik I, Jakobsen E. Vaksinasjon mot poliomyelitt. Tidskr Nor Lægeforen 1971; 91: Lerche C. Bør vi vaksinere mot meslinger? Tidsskr Nor Lægeforen 1972; 92: Rønne T, Kaaber K, Petersen I. Kendskab og holdninger samt tilslutning de to første år til de nye vaccinationer mod mæslinger, fåresyge og røde hunde. Ugeskr Læger1989; 151: Claesson BA. Epidemiology of invasive Haemophilus influenzae type b disease in Scandinavia. Vaccine 1993; (suppl 1): Black S, Shinefield H, Fireman B et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Northern California Kaiser Permanente Vaccine Study Center Group. PIDJ 2000; 19: Kilpi T, Ahman H, Jokinen J et al. Protective efficacy of a second pneumococcal conjugate vaccine against pneumococcal acute otitis media in infants and children: randomized controlled trial of a 7-valent pneumococcal polysaccharide-meningococcal outer membrane protein complex conjugate vaccine in 1666 children. Clin Infect Dis 2003; 37: Chen RT, Glasser JW, Rhodes PH et al. Vaccine Safety Datalink Project: a new tool for improving vaccine safety monitoring in the United States. Pediatrics 1997; 99: Lowndes CM, Gill ON. Cervical cancer, human papillomavirus, and vaccination. BMJ 2005; 331: Glass RI, Parashar UD. The promise of new rotavirus vaccines. N Engl J Med 2006; 345: Kim HW, Canchola JG, Brandt CD et al. Respiratory syncytial virus disease in infants despite prior administration of antigenic inactivated vaccine. Am J Epidemiol 1969; 89: Oxman MN, Levin MJ, Johnson GR et al. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med 2005; 352: Aaby P, Knudsen K, Whittle H et al. Long-term survival after Edmonston Zagreb measles vaccination in Guinea-Bissau: increased female mortality rate. J Pediatr 1993; 122: Kristensen I, Aaby P, Jensen H. Routine vaccinations and child survival: follow up study in Guinea- Bissau, West Africa. BMJ 2000; 321: Siegrist CA. Neonatal and early life vaccinology. Vaccine 2001; 19: Manuskriptet ble mottatt og godkjent Medisinsk redaktør Petter Gjersvik Tidsskr Nor Lægeforen nr. 19, 2006; 126
11 MEDISIN OG VITENSKAP Uønskede hendelser etter vaksinering Sammendrag Det er lett å rette oppmerksomheten mot risikoen ved vaksiner når de sykdommene vi vaksinerer mot blir svært sjeldne. Vaksiner har tidligere ført til utilsiktede skader på grunn av produksjonsfeil og mangelfull kontroll. I dag er kravene til vaksinekontroll så strenge at risikoen for slike hendelser er nær null. Lokalreaksjoner og lette systemiske vaksinereaksjoner er relativt vanlig, og er som regel godt beskrevet når en vaksine blir godkjent. Vaksiner kan imidlertid medføre sjeldne reaksjoner, som bare kan avsløres ved overvåking av reaksjoner etter at vaksinen er tatt i bruk. Mistanke om slike hendelser kommer i dag oftest gjennom meldesystemer. Avklaring av mulig årsakssammenheng krever oftest store, epidemiologisk undersøkelser. Registrering av og åpenhet om vaksinereaksjoner er avgjørende for å opprettholde vaksinenes troverdighet. Engelsk sammendrag finnes i artikkelen på Oppgitte interessekonflikter: Se til slutt i artikkelen > Se også side 2504 Hanne Nøkleby hano@fhi.no Marianne A. Riise Bergsaker Divisjon for smittevern Nasjonalt folkehelseinstitutt Postboks 4404 Nydalen 0403 Oslo Vaksiner er et klassisk eksempel på det såkalte forebyggingsparadokset. Vellykket forebygging gjør den forebyggede tilstanden usynlig. Vi glemmer at den eksisterer. Dermed blir eventuelle negative effekter av det midlet som benyttes, dominerende i folks oppfatning av problemstillingen. Samtidig må vi innse at de første vaksinene langt fra var ufarlige. Da koppevaksinen ble tatt i bruke i 1796, foregikk det ingen systematisert produksjon og slett ikke noen kvalitetskontroll. Vaksinen ble bokstavelig talt overført fra arm til arm og kunne medføre overføring av andre sykdommer, som hepatitt B, difteri og meslinger. Selv om produksjonen ble noe bedre kontrollert omkring 100 år senere, kunne den levende vaksinen forårsake generaliserte infeksjoner, med encefalitt som den mest alvorlige. Så sent som i 1960-årene forekom encefalitt (1 : ved vaksinering i spedbarnsalder) og enkelte dødsfall på grunn av koppevaksine i Norge (1). Så lenge kopper ble opplevd som en stor trussel, var dette en akseptabel pris å betale sett fra samfunnets side. Etter at kopper ble en svært sjelden sykdom, raste det forståelig nok sterke diskusjoner om hvor lenge det var riktig å fortsette med koppevaksinen (2) før den ble tatt ut av det norske vaksinasjonsprogrammet i Også andre vaksiner har gitt store skader i situasjoner der produksjonen ikke har vært underlagt tilstrekkelig kontroll. I 1902 døde 13 barn i USA etter å ha blitt vaksiner med difterivaksine forurenset med tetanustoksin (3). Hendelsen førte til en ny lov om kravene til kontroll av vaksiner i USA. Det forhindret likevel ikke den såkalte Cutter-hendelsen i 1955, der ufullstendig inaktivering av poliovaksine førte til mer enn 200 tilfeller av paralytisk poliomyelitt. Vaksiner har således gjennom årene ført til alvorlige, uønskede hendelser. Som en følge av dette er kravene til vaksinekontroll og oppfølgingen av at kravene blir fulgt, i dag så strenge at risikoen for at en slik hendelse skal gjenta seg er svært nær null. I dag er spørsmålet derfor i hvilken grad vaksiner kan ha uforutsette uheldige virkninger, selv om produksjon og kontroll har foregått etter alle kunstens regler. Problemstillingen er aktuell for alle legemidler, men vaksiner skiller seg fra andre legemidler ved at de gis til store grupper av friske personer, oftest barn. Derfor må kravene til balanse mellom effekt og bivirkninger, og kravene til kunnskap om dette før preparatet tas i bruk, være høyere for vaksiner enn for andre legemidler. Vanlige vaksinereaksjoner På engelsk brukes i dag uttrykket «adverse events following immunisation», AEFI. I dette begrepet ligger det en tidsmessig, men ikke noen årsaksmessig, sammenheng. Uttrykket oversettes best med «uønskede hendelser etter vaksinering». Siden dette er et langt og tungt uttrykk, brukes på norsk oftest, og i denne artikkelen, vaksinereaksjoner om begrepet AEFI. Vaksinereaksjoner deles i lokale og systemiske reaksjoner. Lokalreaksjoner forekommer etter vaksinering med alle vaksiner, selv om hyppigheten varierer. Etter poliovaksine er lokalreaksjoner en raritet. Etter vaksinering med vaksiner som inneholder aluminiumssalter som adjuvans, slik som difteriog stivkrampevaksiner, vil minst 10 % oppleve rubor, hevelse og smerte på injeksjonsstedet i større eller mindre grad. Feilaktig injeksjonsteknikk, f.eks. subkutan injeksjon i stedet for intramuskulær, øker risikoen for lokalreaksjoner. Reaksjonen kommer gjerne først etter en dag eller to, og kan vare opptil en ukes tid (4). Reaksjonen på Hib-vaksine er annerledes, i det den kommer i løpet av få timer, dekker et stort område og oftest er over til neste dag (5). Lokalreaksjoner er så vanlig at både type og hyppighet kan fastslås i tidlige kliniske utprøvninger, og vil være godt beskrevet når vaksinen tas i vanlig bruk.! Hovedbudskap Alvorlige vaksinereaksjoner eller varige skader etter vaksiner forekommer uhyre sjelden Den største risikoen ligger i at alvorlige infeksjonssykdommer blir oversett fordi man tror symptomene skyldes en vaksine Registrering og oppfølging av vaksinereaksjoner og åpenhet om funnene er helt nødvendig for å opprettholde vaksinenes troverdighet Tidsskr Nor Lægeforen nr. 19, 2006; 126:
12 Ramme 1 Den første vaksinen mot rotavirusinfeksjon ble godkjent i 1998 og straks innført i vaksinasjonsprogrammetprogrammet i USA. I løpet av de første åtte månedenes bruk mottok det amerikanske medlesystemet for vaksinereaksjoner VAERS ni meldinger om invaginasjon kort tid etter vaksinering. Dette førte til at det straks ble gjennomført en større pasient-kontrollundersøkelse, med utgangspunkt i 429 barn innlagt for invaginasjon og kontrollpersoner. Studien konkluderte med at risikoen for å få invaginasjon var nesten 30 ganger høyere i løpet av de første dagene etter første vaksinedose enn ellers (7). Vaksinen ble straks trukket fra markedet. Det er ingen tvil om at dette var riktig for USA og andre vestlige land. Samtidig mistet land der rotavirusinfeksjoner er årsak til mange dødsfall hos spedbarn, tilgang til vaksinen, til tross for at en slik vaksine sannsynligvis ville reddet mange liv. Systemiske reaksjoner er langt sjeldnere (tab 1). Grader av uvelfølelse og feber regnes imidlertid blant de vanlige reaksjonene Tabell 1 Vaksinereaksjoner som kan skape bekymringer Vaksine Reaksjonstype Kommentar Difteri- og tetanusvaksine MMR-vaksine 1 MMR-vaksine 1 Store lokalreaksjoner (rubor, hevelse, ømhet), ofte av flere dagers varighet. Av og til feber Lette tilfeller av de aktuelle sykdommene etter 5 12 dager Trombocytopeni hos 1 av vaksinerte etter de fleste vaksiner. Hvor vanlig det angis å være, vil bl.a. avhenge av måten studiene er gjort. En rekke studier konkluderer med at % av alle småbarn får feber etter MMR-vaksine. Lette infeksjoner med feber er imidlertid meget vanlig i annet leveår, også hos dem som ikke blir vaksinert. I en finsk tvillingundersøkelse fikk den ene tvillingen MMR-vaksine og den andre placebo. Foreldrene førte «bivirkningsdagbok» for begge. Etter tre uker ble vaksinasjonen gjentatt på omvendt måte. Resultatene viste at det bare var 5 % høyere forekomst av feber hos den tvillingen som hadde fått ekte vaksine (6). Resten representerte vanlige infeksjoner for et barn i den alderen. De samme forfatterne har også vist at fordi man velger å vaksinere barna i en frisk periode, og småbarn mellom ett og to år er mye småsyke, vil forekomsten av vanlige forkjølelsessymptomer etc. øke hos så vel vaksinerte som hos barn som har fått placebo, i de første 7 9 dagene etter vaksinering. Barna går simpelthen tilbake fra å være uvanlig friske til sin vanlige helsetilstand. Dette beskrives gjerne som «den friske vaksineeffekten» (the healthy vaccinee effect) og kan ifølge forfatterne forklare mange av de symptomer som tilskrives vaksiner (7). En vanlig oppfatning, også blant helsepersonell, er at vaksiner kan føre til den sykdommen det vaksineres mot. De aller fleste vaksiner inneholder imidlertid ikke levende komponenter og kan således ikke forårsake Kan likne erysipelas, men gir bare lett forhøyet CRP. Ikke grunnlag for antibiotikabehandling Ufarlig. Smitte til ikke-immune aldri beskrevet Oftest forløp som mild ITP 2. Trombocytopeni ses hos ca. 1 av etter rubella Rubella Leddsymptomer Ikke økt forekomst av kroniske leddlidelser 1 Vaksine mot meslinger, kusma og røde hunder 2 Idiopatisk trombocytopenisk purpura Tabell 2 Noen mistenkte alvorlige vaksinereaksjoner Vaksine Reaksjon Mulig årsakssammenheng Kopper Encefalitt Ja Helcellevaksine mot kikhoste Encefalopati Sannsynligvis ikke MMR 1 Autisme Nei Hepatitt B Multippel sklerose Sannsynligvis ikke Influensa Guillain-Barrés syndrom 1: ved svineinfluensavaksine, benyttet i USA :1 mill ved senere vaksiner Vaksiner med thiomersal Autisme, hjerneskade Ingen holdepunkter til nå 1 Vaksine mot meslinger, kusma og røde hunder infeksjonssykdommer. Unntakene er de få vaksinene som består av levende, svekkede agenser, som vaksine mot meslinger, kusma, røde hunder og vannkopper. Hvis disse vaksinene forårsaker sykdom, har «vaksinesykdommen» en inkubasjonstid som andre infeksjoner. «Minimeslinger» eller tilsvarende røde hunder og kusma, forekommer etter en inkubasjonstid på 5 12 dager. Vaksineinfeksjonene er imidlertid alltid mindre alvorlige enn infeksjoner med «vilt» virus av meslinger, kusma og røde hunder vil være. Vaksinereaksjoner som er nevnt her, er aldri farlige i seg selv. Derimot kan det være farlig å oppfatte vaksine som årsak til en febersykdom og derfor unnlate å gjøre de undersøkelser og vurderinger man ellers ville gjort. Det kan få dramatiske følger hvis en meningitt blir oversett i tidlig fase, fordi personen fikk vaksine en dag eller to tidligere. Sjeldne vaksinereaksjoner Reaksjoner som i vaksinesammenheng kalles sjeldne, opptrer hos mindre enn én av vaksinerte. Så sjeldne reaksjoner kan være vanskelige å avsløre før vaksinen tas i vanlig bruk, selv om de kliniske utprøvingene omfatter svært mange personer gjerne langt flere enn I dag er man klar over denne risikoen. Legemiddelmyndighetene vil derfor vanligvis kreve meget detaljert overvåking av mulige reaksjoner i den første tiden etter at vaksiner er tatt i bruk. En slik overvåking førte til at man ble klar over en mulig sammenheng mellom vaksine mot rotavirus og invaginasjon (7) (ramme 1). Vaksinen ble trukket fra markedet så fort det forelå data for at årsakssammenheng var sannsynlig. Ytterligere undersøkelser kan tyde på at vaksinen var årsak til mange tilfeller av tarminfeksjoner, og at invaginasjon nærmest var «toppen av isfjellet» (8). Situasjonen er vanskeligere når det dukker opp mistanke om at en vaksine som er brukt i mange år, er årsak til alvorlige hendelser som hittil ikke er erkjent. Mistanken kan oppstå på forskjellige måter hos forskere, publikum eller leger. Utgangspunktet for mistanken er gjerne enkeltepisoder der det er tidsmessig sammenheng med vaksineringen. Ofte dreier det seg om en tilstand som opptrer spontant i den aktuelle aldersgruppen, men der pårørende eller andre lurer på hvorfor akkurat dette barnet ble rammet (tab 2). I dag oppstår slike mistanker ved registre som tar imot meldinger om vaksinereaksjoner. Det amerikanske vaksinereaksjonsregistret (Vaccine Adverse Event Registration System; VAERS) har vist seg særlig nyttig i denne sammenhengen. Systemet tar imot meldinger fra pasienter, helsepersonell og apotek og stiller ikke store krav til dokumentasjon (9). Hensikten er å gjøre systemet så lett tilgjengelig at det oppfanger eventuelle signaler, ikke å påvise årsakssammenheng eller samle informasjon om alle hendelser. Slike signaler må følges opp, raskt og grun Tidsskr Nor Lægeforen nr. 19, 2006; 126
13 MEDISIN OG VITENSKAP dig. Det første skritt vil ofte være en pasientkontroll-undersøkelse, der man finner ut om personer med den aktuelle tilstanden i større grad har fått vaksine enn en tilfeldig valgt kontrollgruppe. Oftest begrenses studien til en bestemt tidsperiode etter vaksinering, avhengig av hva man ser som mulig mekanisme for utløsning av reaksjonen. Mange mistanker kan avkreftes på denne måten (10). Hvis en begrenset pasient-kontroll-undersøkelse styrker hypotesen om en årsakssammenheng, kan det være nødvendig med større epidemiologiske undersøkelser med forskjellig metodikk for å nå frem til et sikkert svar. Men en tilstrekkelig stor undersøkelse kan i seg selv si noe om forekomsten av problemet, slik man gjennom en intervjuundersøkelse fastslo forekomsten av Guillain-Barrés syndrom etter influensavaksinering til ca. én på 1 million vaksinerte (11). Vaksinene i barnevaksinasjonsprogrammet gis i en alder der alvorlig tilstander debuterer eller oppdages (krampetilstander, krybbedød, autisme m.m.). Det kan ikke unngås at sykdomsdebut i en del tilfeller faller sammen med vaksineringen i tid. Da er grundig klinisk undersøkelse viktig. Vaksinereaksjoner gir imidlertid svært sjelden spesifikke funn. Det eneste unntaket vil være hendelser som skyldes infeksjon med levende agens fra vaksinen, der spesifikke mikrobiologiske undersøkelser kan vise at det dreier seg om infeksjon med vaksinevirus eller BCG-bakterier, ikke infeksjon med naturlige bakterier eller virus. Det gjør det vanskelig å avgjøre om vaksinen er (medvirkende) årsak til sykdommen i det enkelte tilfellet. Mistenkte vaksinereaksjoner bør derfor utredes på bakgrunn av symptomene som om pasienten ikke var blitt vaksinert, så andre mulige årsaker og behandlingsmuligheter ikke blir oversett. Mangelen på spesifikke funn gjør at sammenstilling av tilgjengelig viten er nødvendig for å skille mellom tilfeldig sammenfall i tid og årsakssammenheng (ramme 2) (12, 13). I enkelte situasjoner får en hypotesen om sammenheng mellom vaksine og alvorlig sykdom fotfeste hos publikum så fort mistanken er reist. Mistanken kan da være vanskelig å tilbakevise, selv om store og godt gjennomførte undersøkelser taler sterkt imot årsakssammenheng. Det er aldri mulig å vise med 100 % sikkerhet at noe ikke henger sammen. Mistanken om at MMR-vaksine kunne føre til autisme er et eksempel på dette (ramme 3) (14 17). Mistanken har ført til vaksinasjonsmotstand og lav vaksinasjonsdekning gjennom flere år, særlig i engelsktalende land, og er en medvirkende årsak til at det nå stadig er utbrudd av meslinger i forskjellige europeiske land (18, 19). Behov for registrering og åpenhet Blant alle som arbeider med vaksiner er det i dag enighet om at registrering av vaksinereaksjoner og åpenhet om det man finner er viktig. Her samarbeider vaksineprodusenter, legemiddelmyndigheter og de som har ansvar for sykdomsforebygging og vaksinasjonsprogrammer. Nye vaksiner får av og til markedsføringstillatelse på betingelse av at bruken de første årene blir fulgt opp med spesiell overvåking av vaksinereaksjoner, enten i form av kliniske utprøvninger (fase 4) eller som overvåkingsprogram. Vaksineprodusentene er pådrivere og hjelper til å sette opp overvåkingsprogram i samarbeid med den myndighet som har ansvaret for registrering av vaksinereaksjoner. Dette er nødvendig for å opprettholde vaksinenes troverdighet og dermed den forebyggingsmuligheten vaksinene innebærer. Overvåking i Norge Alvorlige reaksjoner knyttet til programvaksiner har vært meldingspliktig til System for vaksinasjonskontroll (SYSVAK) siden 2003 (før dette til Meldesystem for infeksjonssykdommer). Årlig meldes ca. 350 reaksjoner i Norge. For å gjøre systemet best mulig i stand til å fange opp signaler, har Helse- og omsorgsdepartementet bestemt at også mistanke om vaksinereaksjoner skal meldes (20). Meldingsplikten er lagt til helsepersonell (leger og helsesøstre). Systemet registrerer ikke meldinger fra privatpersoner. Hvis privatpersoner henvender seg til SYSVAK og forteller om mulige vaksinereaksjoner, blir de oppfordret til å ta det opp med helsestasjon eller lege og be om at hendelsen blir meldt. Hvis hendelsen har ført til konsultasjon hos lege eller sykehusinnleggelse, har Folkehelseinstituttet, som ansvarlig for SY- SVAK, tillatelse etter forskriften til å innhente tilleggsopplysninger slik at informasjonen om hendelsen blir så fullstendig som mulig. Alvorlige og uventede vaksinereaksjoner er også meldingspliktige til Legemiddelverket, på samme måte som alle andre legemiddelreaksjoner. Et dobbelt meldingssystem kan imidlertid være uheldig og føre til at begge systemene blir mindre fullstendige enn ønskelig. Legemiddelverket og Folkehelseinstituttet har derfor utviklet samarbeidsrutiner som skal sikre utveksling av meldinger etter nærmere regler. Veien fremover Oppfatningen om et «risikofritt samfunn» har i noen grad fått fotfeste i vår del av verden. I det ligger det at egentlig bør det aldri skje noe galt for noen av oss. Hvis personer rammes av alvorlige sykdommer eller hendelser, skyldes det at noen har gjort noe de ikke burde. I denne tankegangen kommer vaksiner, som et valgt tiltak, lett i søkelyset. Samtidig er fortsatt stor oppslutning om vaksinasjonsprogrammet en forutsetning for å beholde gevinstene ved allmenn vaksinasjon. Derfor er kravene til sikkerhetsdokumentasjon før vaksiner tas i bruk i dag sannsynligvis så strenge som de kan være, hvis det i det hele tatt skal være mulig å få tatt i bruk nye vaksiner. Ramme 2 Institute of Medicine (IOM) i USA har gjort en viktig jobb med å gå gjennom foreliggende litteratur på vaksinefeltet og gi klare vurderinger av hva foreliggende kunnskap sier om årsakssammenheng (12, 13). Her konkluderes det bl.a. med at det ikke er holdepunkter for årsakssammenheng mellom helcelle kikhostevaksine og krybbedød eller afebrile kramper. The Brighton Collaboration består av en gruppe fagpersoner på vaksinefeltet som har påtatt seg oppgaven med å utvikle kasusdefinisjoner og vurdere årsakssammenheng for en rekke tilstander som opptrer etter vaksinering. Stoffet finnes på deres hjemmeside Ramme 3 En beskrivelse av 12 barn med symptomkomplekset inflammatorisk tarmsykdom og autisme reiste en hypotese om at bildet kunne være forårsaket av MMR-vaksine (14). På bakgrunn av hypotesen ble det startet en rekke store, epidemiologisk undersøkelser (15, 16). Ingen av disse studiene bekreftet mistanken om årsakssammenheng. Særlig viktig var en dansk undersøkelse, der man på grunnlag av registerdata kunne vise at det ikke var høyere forekomst av autisme hos vaksinerte enn hos uvaksinerte (16). Hypotesen fikk imidlertid stor publisitet, særlig i engelsktalende land, men også i Norge (17). Publisiteten førte til betydelig usikkerhet rundt MMR-vaksinen, fallende vaksinasjonsdekning i mange land og utbrudd av meslinger med komplikasjoner og dødsfall (18, 19). Det tok mer enn fem år før situasjonen roet seg så mye at vaksinasjonsdekningen igjen nærmet seg utgangsnivået Som helsepersonell kan vi bidra ved å være åpne, fortelle om hva som blir gjort og hva vi vet, både av positiv og negativ art. Alt helsepersonell må gjøre det som er mulig for å unngå mistanker om en «skjult agenda» eller ønsker om å holde informasjon borte fra publikum. Det krever kunnskap om hva vaksiner består av og hvilke hendelser de kan eller ikke kan utløse. Det krever ikke minst tid, innlevelse og vilje til å ta foreldrenes bekymringer på alvor ved å diskutere deres problemer og oppfatninger på en åpen måte. Tidsskr Nor Lægeforen nr. 19, 2006;
14 Oppgitte interessekonflikter: Hanne Nøkleby har ingen oppgitte interessekonflikter. Marianne A. Riise Bergsaker har deltatt i en helseøkonomisk evaluering av pneumokokkvaksine, initiert av Wyeth Lederle, og på et rådgivningsmøte arrangert av samme firma. Litteratur 1. Gaustad V. Koppevaksinasjon. Tidsskr Nor Lægeforen 1971; 91: Lahelle O. Virusvaksiner (rundebordskonferanse). Tidsskr Nor Lægeforen 1971; 91: Ball LK, Evans G, Bostrom A. Risky business: challenges in vaccine risk communication. Pediatrics 1888; 101: Carlsson RM, Claesson BA, Kayhty H et al. Studies on a Hib-tetanus toxoid conjugate vaccine: effects of co-administered tetanus toxoid vaccine, of administration route and of combined administration with an inactivated polio vaccine. Vaccine 1999; 18: Peltola H, Heinonen OP. Frequency of true adverse reactions to measles-mumps-rubella vaccine. Lancet 1986; 1: Virtanen M, Peltola H, Paunio M et al. Day-to-day reactogenicity and the healthy vaccinee effect of measles-mumps-rubella vaccination. Pediatrics 2000; 106: E Murphy TV, Garguillo GM, Massoudi MS et al. Intussusception among infants given an oral rotavirus vaccine. N Engl J Med 2001; 344: Haber P, Chen RT, Zanardi LR et al. An analysis of rotavirus vaccine reports to the Vaccine Adverse Event Reporting System: more than intussusception alone? Pediatrics 2004; 113: Singleton JA, Lloyd JC, Mootrey GT et al. An overview of the vaccine adverse event reporting system (VAERS) as a surveillance system. VAERS Working Group. Vaccine 1999; 17: Ascherio A, Zhang SM, Hernán MA et al. Hepatits B vaccination and the risk of multiple sclerosis. N Engl J Med 2001; 344: Lasky T, Terracciano GJ, Magder R et al. The Guillain-Barre syndrome and the and Influenza vaccines. N Engl J Med 1998; 339: Howson CP, Howe CJ, Fineberg HV, red. Adverse effects of pertussis and rubella vaccines. Institute of Medicine. Washington, D.C.: National Academy Press, Stratton KR, Howe CJ, Johnston RB, red. Adverse effects associated with childhood vaccines. Evidence bearing on causality. Institute of Medicine. Washington, D.C.: National Academy Press, Wakefield AJ, Murch SH, Anthony A et al. Ileallymphodi-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. Lancet 1998; 351: Tilbaketrukket Lancet 1998; 351: Taylor B, Miller E, Farrington CP et al. Autism and measles, mumps and rubella vaccine: no epidemiological evidence for a causal association. Lancet 1999; 353: Madsen KM, Hviid A, Vestergaard M et al. A population-based study of measles, mumps, and rubella vaccination and autism. N Engl J Med 2002; 347: Nøkleby H. Vaksinasjon, inflammatorisk tarmsykdom og autisme er det noen sammenheng? Tidsskr Nor Lægeforen 2001; 121: McBrien J, Murphy J, Gill D et al. Measles outbreak in Dublin, Pediatr Infect Dis J 2003; 22: Ianazzio S, Ciofi M, Huberty-Krau P et al. Measles Surveillance annual report ( ). 20. Om SYSVAK-register-forskriften. Forskrift av 20. juni 2003 nr Rundskriv I-12/2003. Oslo: Helsedepartementet, Manus ble mottatt og godkjent Medisinsk redaktør Petter Gjersvik Tidsskr Nor Lægeforen nr. 19, 2006; 126
15 Medisin og vitenskap tema Vaksinasjon Vaksinering er det verdt pengene? Sammendrag Moderne vaksiner kan være meget kostbare, og samfunnet må vurdere vaksinasjon i forhold til annen forebygging og behandling. Økonomisk evaluering innebærer å kvantifisere kostnader og effekter av helsetiltak for å gi bedre grunnlag for prioriteringer. Hovedutfordringen er å få valide mål på helseeffektene, herunder bivirkninger og konsekvenser av flokkimmunitet og serotypeskifte. I denne artikkelen omtales metoder og metodevansker ved økonomisk evaluering av vaksinasjonsprogrammer, med vaksinasjon mot kikhoste og pneumokokksykdom som eksempler. Engelsk sammendrag finnes i artikkelen på Oppgitte interessekonflikter: Se til slutt i artikkelen Torbjørn Wisløff torbjorn.wisloff@kunnskapssenteret.no Nasjonalt kunnskapssenter for helsetjenesten Postboks 7004 St. Olavs plass 0130 Oslo Tore G. Abrahamsen Rikshospitalet-Radiumhospitalet og Universitetet i Oslo Marianne A. Riise Bergsaker Øistein Løvoll Nasjonalt folkehelseinstitutt Ivar Sønbø Kristiansen Institutt for helseledelse og helseøkonomi Universitetet i Oslo og Institut for Sundhedstjenesteforskning Syddansk Universitet Odense Hensikten med denne artikkelen er å peke på de spesielle utfordringer som reiser seg i forbindelse med evaluering av vaksinasjonsprogrammer. I artikkelen vil vi først beskrive hovedprinsippene i økonomisk evaluering, vise to eksempler der metoden er blitt anvendt på vaksiner og deretter drøfte noen av de metodeproblemer man står overfor i økonomisk evaluering av vaksiner. Et gjennomgående element vil være en norsk økonomisk evaluering av pneumokokkvaksine (1). Økonomisk evaluering Det sentrale ved økonomisk evaluering er å kvantifisere kostnader og helseeffekter ved ulike behandlinger. Metodene har vært omtalt i Tidsskriftet tidligere (2 7). Vi vil her konsentrere oss om det som er spesifikt for vaksinasjonsprogrammer og drøfte enkelte sentrale begreper. En økonomisk evaluering er oftest relevant bare for ett enkelt land eller én enkelt problemstilling. I praksis er det umulig å gjøre en ny klinisk effektstudie for hver ny økonomisk analyse. Man er derfor henvist til å analysere kostnader og effekter ved å simulere ulike behandlinger. Dette gjøres i en modell der man henter data om kostnader og effekter fra ulike kilder. Man utvikler typisk et beslutningstre der hver gren i treet representerer mulige beslutninger (f.eks. nytt behandlingsopplegg og tidligere behandlingsopplegg). Etter hver beslutning beskrives det kliniske hendelsesforløpet hos dem intervensjonene gjelder for (e-fig 1). Ved sykdommer som følges over lengre tid, vil et beslutningstre bli uoversiktlig pga. de mange grenene. I slike tilfeller benytter man heller en såkalt Markov-modell (8). Dette er i prinsippet en modell hvor pasienter over tid beveger seg mellom forskjellige medisinske tilstander. Det spesielle med en Markov-modell er at den ikke har minne, hvilket betyr at sannsynligheten for å bevege seg til en ny tilstand er uavhengig av det som har skjedd tidligere. Figur 2 viser prinsippet for en Markov-modell som simulerer forløpet av pneumokokksykdom i en populasjon. Alle individer i populasjonen er på ethvert tidspunkt i én av flere helsetilstander som er gjensidig utelukkende. Hver helsetilstand er representert ved en rombe. Alle individer starter i tilstanden «frisk», hvilket i denne forbindelse betyr at man ikke har eller har hatt pneumokokksykdom. Individene følges år for år til alle er døde 100 år senere. Til hvert leveår knyttes kostnader. Hvert eneste år er individene utsatt for risiko for pneumokokksykdom og dessuten for alminnelig dødelighet. Ved å følge dem med og dem uten vaksine kan man tallfeste merkostnader og unngått pneumokokksykdom. Valg av analysemetode, perspektiv, nåverdiberegning, effektmål og kostnadsberegning kan ha stor innflytelse på resultatet av økonomiske analyser. Det er derfor nødvendig at man for hver usikker variabel både velger en punktverdi (base-case value) og innhenter et estimat for usikkerheten i punktverdien. Det er standard for økonomiske evalueringer å utføre enveis sensitivitetsanalyser for alle usikre variabler i modellen ved å variere hver enkelt opp og ned innenfor nevnte grenser. I tillegg er det de seneste årene også blitt vanlig å gjøre såkalte probabilistiske sensitivitetsanalyser med Monte Carlo-simuleringer (9). Dette vil si at man tilegner en sannsynlighetsfordeling til de angitte variablene basert på anslag på punktestimater og grenser for variasjon. Man trekker så ett tilfeldig tall fra angitt sannsynlighetsfordeling for hver variabel og regner ut kostnader og effekter for de alternativene man sammenlikner. Denne operasjonen utføres typisk ganger for å finne frem til et anslag for hvilke verdier kostnader og effekter kan variere innenfor. Diskontering kan være et vanskelig begrep, og vi har derfor forsøkt å illustrere dette med eksempler (e-ramme 1, e-ramme 2, e-fig 3) (10, 11). To eksempler på økonomisk evaluering finnes i ramme 3 (12) og ramme 4 (e-fig 4) (13). Tabell 1 og tabell 2 illustrerer helsegevinster og kostnader per vunnet leveår fra eksemplet i ramme 4. Betydningen av gode kliniske data Kvaliteten på en økonomisk evaluering er helt avhengig av gode grunnlagsdata om blant annet forekomst av den aktuelle infeksjonen, smittsomhet og forholdet mellom bærerskap og sykdom, sykdomsvarighet og forekomst av sekveler og død. I Europa har! Hovedbudskap Økonomisk evaluering av vaksiner krever kvantifisering av helseeffekter og kostnader i simuleringsmodeller Store og langvarige randomiserte studier er nødvendig for å få gode effektestimater Muligheten for serotypeskifte og flokkimmunitet kan ha stor innflytelse på resultatene Diskontering og tidspreferanser har stor innflytelse på resultatene av vaksineevaluering 2670 Tidsskr Nor Lægeforen nr. 20, 2006; 126:
16 MEDISIN OG VITENSKAP det vært vanlig å utføre nasjonale evalueringer av nye vaksiner. I de fleste landene er det relativt homogene populasjoner og egne tradisjoner for diagnose og behandling. Ikke minst er de infeksjonsfremkallende mikrobenes epidemiologi rimelig begrenset når det gjelder forekomst av subgrupper, virulens og antibiotikafølsomhet. Generelt sett synes det som om oppfølgingsdata, slik som forekomst av sekveler, er vanskelig å få frem selv i såkalt utviklede land i Vest-Europa og Nord-Amerika. Norge burde være et foregangsland når det gjelder epidemiologiske data som bakgrunn for innføring av vaksiner. Vi har et godt utbygd og oversiktlig helsevesen med gode muligheter for infeksjonsregistrering. Meldingssystem for smittsomme sykdommer (MSIS) har ført oss et stykke på vei, men det er et vell av infeksjonsdata som ikke registreres der. Ved evalueringen av den sjuvalente pneumokokkvaksinen (1) manglet det nasjonale data over forekomst av pneumonier og otitter og over fordeling på etiologiske agenser. I stedet ble det brukt henholdsvis sykehusdata og resultater fra en dansk epidemiologisk undersøkelse (14). Enda mer problematisk var forekomst av senfølger av systemiske pneumokokkinfeksjoner, der det verken fantes nasjonale eller internasjonale data. Løsningen ble å få anslag fra et panel av nasjonale eksperter på området. Betydningen av serotypeskifte En forutsetning for at en vaksine skal ha beskyttende effekt mot en sykdom, er at de antistoffer og B- og T-celler som dannes, er rettet mot den mikroben som forårsaker sykdom. For enkelte sykdommer kan det være flere ulike varianter av mikroben, f.eks. ulike influensavirusstammer eller ulike serotyper av pneumokokker. De ulike variantene av mikroben kan være så forskjellige at vaksine rettet mot én variant ikke gir beskyttelse mot en annen. Dersom en vaksine bare er effektiv mot en viss andel av de ulike serotypene av f.eks. pneumokokker, kunne man vente at serotyper som ikke dekkes av vaksinen, blir mer vanlige (serotypeskifte). Dette ville gjøre vaksinen mindre klinisk effektiv. Etter innføringen av vaksine mot Haemophilus influenzae type b (Hib) i det norske barnevaksinasjonsprogrammet kom det et sterkt fall i antall meldte tilfeller av invasiv Haemophilus influenzae-infeksjon. I ettertid har det ikke kommet en økning av infeksjoner forårsaket av andre typer Haemophilus influenzae, og et serotypeskifte synes ikke å ha skjedd. Etter innføringen av pneumokokkonjugatvaksine i det amerikanske barnevaksinasjonsprogrammet er det observert et sterkt fall i antall rapporterte tilfeller av invasiv pneumokokksykdom innenfor de serotyper som inngår i vaksinen. Imidlertid har man observert en viss økning i tilfeller av pneumokokksykdom forårsaket av andre serotyper (15, 16). Noen studier kan imidlertid tyde på at serotypeskiftet var i gang allerede før vaksinen ble innført. Det er vanskelig å kvantifisere betydningen av serotypeskifte fordi endringer i sykdomsforekomst kan ha mange andre årsaker enn vaksinering. Serotypeskifte kan imidlertid ha en markert negativ effekt på vaksiners effekt og dermed deres kostnadseffektivitet. Flokkimmunitet Etter innføring av vaksinasjon mot en smittsom sykdom i en befolkning har man sett at fallet i forekomsten av sykdommen i befolkningen er større enn vaksinasjonsdekningen skulle tilsi. Forklaringen synes å være at sykdommen sprer seg dårligere i en befolkning jo flere som er immune. Dette fenomenet kalles flokkimmunitet (herd immunity), og det er til stede enten immuniteten skyldes gjennomgått sykdom eller vaksinasjon. Før innføring av vaksinasjon forløp sykdommer som meslinger og kikhoste i epidemier med få års mellomrom. De aller fleste barna fikk sykdommene som små, og etter en epidemi måtte man ha en viss tilvekst av nye mottakelige barn for at en ny epidemi skulle kunne bre seg. Sykdommens evne til å spre seg i en befolkning kan uttrykkes i det såkalte basale reproduksjonsantallet, R 0. R 0 er det gjennomsnittlige antallet nye sykdomstilfeller Ramme 3 Kikhostevaksine I en svensk artikkel vurderte forfatterne hvorvidt det var kostnadseffektivt å gjeninnføre kikhostevaksinasjon i det svenske barnevaksinasjonsprogrammet (12). Denne modellanalysen hadde effektestimater fra én svensk studie. I tillegg bygde modellen på diverse epidemiologiske og demografiske data. Modellen baserte seg på at effekten av vaksinen varer i fem år. Hovedresultatene i analysen var at antall tilfeller av kikhoste i Sverige ville gå ned fra til over en seksårsperiode. Man forventet at dette samtidig skulle føre til 147 millioner svenske kroner i «forbedret samfunnsøkonomisk resultat». Fordi analysen ga positive resultater for både helsegevinster og kostnader, sier vi at vaksinasjonen representer en dominant strategi. Dersom analyseresultatet er korrekt, er det ingen tvil om at kikhostevaksinering bør innføres. som hver syk person smitter i sin smittsomme periode i en stor populasjon av smittemottakelige individer. R 0 bestemmes av smittsomheten, kontakthyppigheten og smittevarigheten. Den vil variere fra sykdom Figur 2 Markov-modell som beskriver forløpet for en fødselskohort med tanke på pneumokokksykdom Tidsskr Nor Lægeforen nr. 20, 2006;
17 Ramme 4 Pneumokokkvaksine I analysen ble kostnader og helseeffekter ved å innføre pneumokokkvaksinering av alle norske spedbarn beregnet. Vi sammenliknet her livstidsforløpet for en vaksinert fødselskohort ( fødte) med en tilsvarende kohort uten vaksinering (1). Simuleringsmodellen fanget opp effekter på forekomst av pneumoni, invasiv pneumokokksykdom, otitt og sekvele etter disse sykdommene. Effektestimatene ble hentet fra studier i Finland (otitt) og USA (pneumoni og invasiv pneumokokksykdom). Estimatene fra USA ble justert med tanke på norsk serotypefordeling. Data for forekomst av invasiv pneumokokksykdom ble hentet fra MSIS, mens forekomst av pneumonier og otitter ble basert på henholdsvis sykehusdata og resultater fra en dansk epidemiologisk undersøkelse. Livskvalitet ved sekveler ble verdsatt med tall fra en amerikansk database (13). Modellen fanget også opp muligheten for at vaksinering av barn reduserer forekomsten av invasiv pneumokokksykdom hos voksne (flokkimmunitet). Modellanalysen viste at vaksinasjon av én fødselskohort gir 69 vunne leveår eller 142 kvalitetsjuserte leveår (diskontert 4 %: henholdsvis 23,5 år og 52,1 år) (tab 1). Dersom man også inkluderte flokkimmunitet, ble den samlede leveårsgevinst 101 leveår (udiskontert) Vaksinasjon av spedbarn koster ca. 100 millioner kroner (med fire doser per barn). De samlede livstidskostnader for pneumokokkrelatert sykdom var i gjennomsnitt kroner per barn uten vaksine og kroner med vaksine (indirekte kostnader ikke inkludert). Tabell 2 viser merkostnad per vunnet (kvalitetsjustert) leveår ved å innføre spedbarnsvaksinering (både kostnader og helseeffekter diskontert). Kostnad-effekt-forholdet er mer gunstig om man trekker inn indirekte kostnader, dvs. at vaksinasjon reduserer produksjonsbortfallet ved pneumokokkrelatert sykdom og død. Dette forholdet blir også mer gunstig om man kvalitetsjusterer leveårene, fordi vaksinering forebygger otitter og alvorlige sekvele. Vaksinasjon er også mer kostnadseffektiv dersom man antar at tre vaksinedoser gir samme beskyttelse som fire. Ved probabilistisk sensitivitetsanalyse var det mindre enn 1 % sannsynlighet for at vaksinering er kostnadseffektivt under forutsetning av fire doser vaksine og at man ser bort fra indirekte kostnader og flokkimmunitet (e-fig 4). til sykdom og også noe fra befolkning til befolkning. Eksempelvis er R 0 ca. 15 for meslinger, men bare 2 3 for influensa. For at en sykdom skal kunne bre seg og øke i forekomst, må R 0 være større enn 1. Dersom R 0 er mindre enn 1, vil spredningen begrenses og sykdommen dø ut. Dersom R 0 er lik 1, har vi en endemisk situasjon. Man kan ut fra R 0 beregne hvilken vaksinasjonsdekning, eller rettere sagt hvilken grad av immunitet, man må ha i befolkningen for at man skal kunne få kontroll med en sykdom, den såkalte flokkimmunitetsterskel (herd immunity threshold). Denne er definert som 1 1/R 0. Jo høyere R 0 for en sykdom er, desto høyere flokkimmunitetsterskel eller vaksinasjonsdekning må man ha for å få kontroll. I denne beregningen må man også ta med vaksinenes effektivitet, som aldri vil være 100 %. For å oppnå kontroll med meslinger i en befolkning må man ha et flokkimmunitetsnivå på over 90 %. Når man gjør økonomisk evaluering av vaksiner, vil flokkimmuniteten kunne komme inn som en ekstra bonus med stor betydning for vaksinens kostnadseffektivitet. Innføringen av sjuvalent konjugert pneumokokkvaksine hos spedbarn i USA har, foruten betydelig fall i forekomst i de vaksinerte gruppene, ført til et fall i forekomsten av invasiv pneumokokksykdom hos grupper av voksne. Effekten har vært størst i aldersgrupper som kan passe med foreldre- og besteforeldregenerasjonen. Vi vet at for denne sykdommen er det et stort antall friske bærere, særlig gjelder det små barn. Mindre sykdom og færre bærere blant barn gir mindre smittepress mot voksne. Den norske analysen av pneumokokkvaksine viste at flokkimmunitet hadde avgjørende betydning for om vaksinen kan betraktes som kostnadseffektiv (1). Diskusjon Pasientrettighetsloven slår fast at «retten (til helsehjelp) gjelder bare dersom pasienten kan ha forventet nytte av helsehjelpen, og kostnadene står i rimelig forhold til tiltakets effekt». Den siste bisetningen betyr i praksis at samfunnet har behov for å kvantifisere kostnader og nytte av helsetiltak. Foreløpig er det bare for blåreseptordningen at dette prinsippet er satt i system. Når man tar i betraktning at vaksinering av et årskull for én sykdom kan koste 100 millioner kroner, er det naturlig at økonomisk evaluering også benyttes for vaksiner og annen behandling for den saks skyld. To spørsmål blir påtrengende når samfunnet bruker økonomisk evaluering for prioritering i helsepolitikken. For det første: Hva er helsevesenets målsetting? Her finner man for det meste uforpliktende og upresise formuleringer i offentlige dokumenter. Politiske diskusjoner om for eksempel nedlegging av sykehus bærer bud om at målsettingen er meget mer enn å maksimere befolkningens helse. Fordi økonomiske analyser av helsetiltak måler kostnadene ved å øke livskvalitet og livslengde, er de til lite eller ingen nytte dersom beslutningstakere skulle ha andre mål med helsevesenet. For det andre: Hvor mye skal samfunnet være villig til å betale for helseforbedringer? Dersom samfunnet ikke vil eller tør sette en grense her, vil økonomisk evaluering i praksis få liten praktisk betydning. I Norge er det foreslått at samfunnet i utgangspunktet ikke skal være villig til å betale mer enn kroner eller kroner for et (godt) leveår (11, 17). Det gjenstår å se hva norske helsemyndigheter mener om dette kjernespørsmålet. Da regjeringen høsten 2005 foreslo å innføre pneumokokkvaksinering av spedbarn, kunne det virke som om medieoppmerksomhet snarere enn økonomisk evaluering var utslagsgivende. Etter vår oppfatning ville det være ønskelig at økonomisk evaluering fungerer som premissleverandør for helsepolitikken snarere enn som unnskyldning for beslutninger som i realiteten har en annen begrunnelse. Verdien av metoden må likevel vurderes i lys av den usikkerheten de økonomiske analyser er basert på (7). Med moderne dataprogrammer er det forholdsvis enkelt å utvikle analyser som er svært kompliserte. Resultatene blir likevel ikke mer pålitelige enn forutsetningene de hviler på. Økonomiske evalueringer av vaksiner innebærer samme typer usikkerhet som evaluering av andre helsetiltak. I de fleste tilfeller er usikkerhet med henblikk på helseeffekt det viktigste enkeltbidrag til den samlede usikkerhet. Store, langvarige randomiserte studier med måling av både effekt og eventuelle bivirkninger står sentralt. Den norske evalueringen av pneumokokkvaksine (1) var i hovedsak bygd på tre kliniske studier av relativt kort varighet. Det er sterkt ønskelig at kliniske studier er bedre enn det som her var tilfellet. Ansvaret ligger hos så vel produsenter som myndigheter. Myndighetene bør stille strengere krav til klinisk dokumentasjon og i sterkere grad enn hittil selv finansiere studier for å sikre uavhengighet og relevans. Her spiller publikums legitime krav på dokumentasjon av bivirkninger en viktig rolle. Verdien av å unngå symptomer og plager står sentralt i økonomisk evaluering. Kvalitetsjustering av leveår har hittil vært den mest anvendbare metoden, men måling av livskvalitet er en vanskelig og omstridt aktivitet (3). I likhet med det som er tilfellet i andre land mangler vi i Norge gode data om ressursforbruk i medisinsk behandling. Ofte er man henvist til å benytte ekspertanslag i kostnadsanalysen, men heldigvis betyr ikke dette så mye for den samlede usikkerhet i analysen. Flokkimmunitet og serotypeskifte representerer spesielle utfordringer i økonomisk evaluering av vaksinasjonsprogrammer. Disse fenomenene kan ha betydelig innflytelse på resultatene når man evaluerer vaksiner og 2672 Tidsskr Nor Lægeforen nr. 20, 2006; 126
18 MEDISIN OG VITENSKAP Tabell 1 Helsegevinster (udiskonterte) ved å vaksinere en norsk fødselskohort (n = ) Uten flokkimmunitet Med flokkimmunitet Unngåtte hjernehinnebetennelser blant vaksinerte barn 7,2 7,2 Unngåtte blodforgiftninger blant vaksinerte barn 5,2 5,2 Unngåtte lungebetennelser blant vaksinerte barn 49,7 49,7 Unngåtte mellomørebetennelser blant vaksinerte barn 3 063, ,1 Unngåtte dødsfall blant vaksinerte barn 0,8 0,8 Unngåtte hjernehinnebetennelser blant voksne 0 10,4 Unngåtte blodforgiftninger blant voksne 0 24,3 Vunne leveår Vunne kvalitetsjusterte leveår (QALY) Tabell 2 Kostnad (i norske kroner) per (kvalitetsjustert) leveår avhengig av forutsetninger om flokkimmunitet, indirekte kostnader og hvorvidt tre eller fire doser vil være like effektivt. Både kostnader og helseeffekter er diskontert 4 % per år Kostnad per vunnet leveår (kr) Kostnad per QALY 1 (kr) Indirekte kostnader Flokkimmunitet Fire doser Tre doser Fire doser Tre doser Ikke inkludert Ikke inkludert Ikke inkludert Inkludert Inkludert Ikke inkludert Kostnadsbesparende Inkludert Inkludert Kostnadsbesparende 1 Kvalitetsjustert leveår (quality adjusted life years) Kostnadsbesparende Kostnadsbesparende andre tiltak mot infeksjonssykdommer (18). For å fange opp disse fenomenene bør man fortrinnsvis benytte dynamiske simuleringsmodeller, som er mer kompliserte enn de statiske modellene som er omtalt foran. Når langtidseffektene av flokkimmunitet bygges inn i dynamiske modeller, blir de samlede helseeffekter større enn i statiske modeller og behandlingen i virkeligheten mer kostnadseffektiv enn de statiske modeller skulle tilsi (19). Økonomisk evaluering av vaksiner er preget av usikkerhet. Betyr dette at det er mer usikkerhet i økonomisk evaluering enn i de kliniske vurderinger? Svaret er nei. Hvis klinikere anfører at de har god dokumentasjon for en vaksine, tenker de i praksis på kliniske effekter i et korttidsperspektiv, ikke på kostnadsaspektet. Dersom man skulle velge å treffe beslutninger på dette grunnlaget, har man utelatt potensielt essensielle elementer i beslutningsgrunnlaget. Vi mener at økonomisk evaluering av vaksiner tilfører en ny dimensjon i evalueringen av vaksineprogrammer, både fordi den fanger opp flere av de elementer som bør inngå i beslutningene om vaksinering, og fordi økonomisk evaluering håndterer usikkerhet på en mer systematisk måte enn kliniske vurderinger alene. Dette betyr ikke at en økonomisk evaluering kan eller skal diktere beslutninger. Enten det er helsemyndigheter eller politikere som fatter beslutninger, vil det alltid inngå et viktig element av verdivurderinger. Målsettingen med økonomisk evaluering av vaksiner er ikke å diktere beslutninger, men å sørge for et bedre grunnlag for å fatte de riktige beslutningene. Oppgitte interessekonflikter: Forfatterne bruker pneumokokkvaksine som ett av eksemplene på økonomisk evaluering, og studien ble initiert av Wyeth Lederle. Torbjørn Wisløff mottok honorar for statistiske analyser, og Ivar Sønbø Kristiansen og Torbjørn Wisløff har fått reisestøtte for å presentere studien på internasjonale konferanser. e-fig 1, e-fig 3, e-fig 4, e-ramme 1 og e-ramme 2 finnes i artikkelen på Litteratur 1. Wisløff T, Abrahamsen TG, Bergsaker MA et al. Cost effectiveness of adding 7-valent pneumococcal conjugate (PCV-7) vaccine to the Norwegian childhood vaccination program. Vaccine 2006; 24: Kristiansen IS. Økonomiske analyser av helsetiltak: om kostnad-nytte- og kostnad-effekt-analyser som hjelpemiddel for bedre ressursbruk. Tidsskr Nor Lægeforen 1990; 110: Nord E. Kvalitetsjusterte leveår muligheter, begrensninger, alternativer. Tidsskr Nor Lægeforen 1992; 112: Nord E. Veiledende verditall for kostnad-nytte-analyser av helsetjenester. Tidsskr Nor Lægeforen 1996; 116: Kristiansen IS, Andersen CK. Bør samfunnet prioritere kostbare sykdommer? Tidsskr Nor Lægeforen 2001; 121: Nord E. Helseøkonomi kort innføring i nyttekostnads-analyser. Tidsskr Nor Lægeforen 2002; 122: Kristiansen IS, Stavem K, Linnestad K et al. Evaluering av medisinske metoder kan vi stole på kostnad-effekt-analyser? Tidsskr Nor Lægeforen 2003; 123: Sonnenberg FA, Beck JR. Markov models in medical decision making: a practical guide. Med Decis Making 1993; 13: Ades AE, Claxton K, Sculpher M. Evidence synthesis, parameter correlation and probabilistic sensitivity analysis. Health Econ 2006; 15: Olsen JA. Time preferences for health gains: an empirical investigation. Health Econ 1993; 2: Veileder i samfunnsøkonomiske analyser. Oslo: Finansdepartementet, Nordlund A, Kornfalt R, Lithman T. Vaccination mot kikhosta en hãlsoeconomisk vinst. Läkartidningen 1996; 93: Harvard Centre for Risk Analysis. harvard.edu/cearegistry/ ( ). 14. Stangerup SE, Tos M. Epidemiology of acute suppurative otitis media. Am J Otolaryngol 1986; 7: Black S, Shinefield H, Fireman B et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Northern California Kaiser Permanente Vaccine Study Center Group. Pediatr Infect Dis J 2000; 19: Black SB, Shinefield HR, Hansen J et al. Postlicensure evaluation of the effectiveness of seven valent pneumococcal conjugate vaccine. Pediatr Infect Dis J 2001; 20: Kristiansen IS. Hvor mye bør samfunnet være villig til å betale for helseforbedringer? Verdien av liv og helse. Oslo: Helseøkonomisk forskningsprogram, Universitetet i Oslo, 2003: Brisson M, Edmunds WJ. Economic evaluation of vaccination programs: the impact of herdimmunity. Med Decis Making 2003; 23: Welte R, Postma M, Leidl R et al. Costs and effects of chlamydial screening: dynamic versus static modeling. Sex Transm Dis 2005; 32: Manuskriptet ble mottatt og godkjent Medisinsk redaktør Petter Gjersvik. Tidsskr Nor Lægeforen nr. 20, 2006;
19 Vaksinasjon i et utviklingsperspektiv Sammendrag Vaksinering er et effektivt virkemiddel, men produksjon og distribusjon av vaksiner er en utfordring. Mer enn tre firedeler av alle verdens barn blir vaksinert, men vi må nå flere. Helse generelt og vaksinasjon spesielt spiller en viktig rolle for den økonomiske veksten i fattige land. Vaksinasjon av barn har i de senere år fått en sentral plass i utviklingen av nye samarbeidsformer, strategier og finansiering av helserettet og annen utviklingshjelp. Norge har stått sentralt i dette arbeidet. Mange nye og lovende vaksiner er under utvikling. Forutsatt rettferdig distribusjon vil disse vaksinene bli kjærkomne tilbud til store befolkningsgrupper, også til dem som fortsatt ikke har tilgang til adekvat kurativ medisin. Det er mange utfordringer i arbeidet med å nå marginaliserte befolkningsgrupper, dvs. de som trenger vaksinebeskyttelse aller mest. Oppgitte interessekonflikter: Se til slutt i artikkelen Halvor Sommerfelt halvor.sommerfelt@cih.uib.no Senter for internasjonal helse Universitetet i Bergen Armauer Hansens hus 5021 Bergen og Divisjon for smittevern Nasjonalt folkehelseinstitutt Tore Godal Statsministerens kontor Vår egen historie har vist at økonomisk utvikling, mindre fattigdom og en jevnere fordeling av godene bidrar vesentlig til bedret folkehelse. Sengene som vikingtidens og middelalderens folk sov i, var korte ikke fordi de sovende «halvsatt med sverdet i hånd, klare til kamp», men fordi folk flest var kortvokste, et resultat av den onde sirkelen av gjentatte infeksjoner og dårlig ernæring. Man antar at bedret folkehelse i vår del av verden først og fremst var en konsekvens av den sosioøkonomiske utviklingen. Holdningen til helse og utvikling i fattige land i og 70-årene var i stor grad basert på denne historiske forståelsen. Man mente at folkehelsen i utviklingsland mest effektivt kunne bedres ved å bedre de sosioøkonomiske kår blant folk flest. Forskning gjennom de siste 15 år har vist at det også er en effekt den andre veien bedret helse kan bidra vesentlig til økonomisk utvikling (1). Denne forståelsen kulminerte i et viktig dokument i 2001, kalt Report of the Commission on Macroeconomics and Health (2). Det ble bestilt av daværende generaldirektør for Verdens helseorganisasjon (WHO), Gro Harlem Brundtland. I rapporten staket man ut en strategi der spesifikke helseintervensjoner står sentralt i bekjempelsen av fattigdom og i utviklingslandenes økonomiske utvikling. Parallelt med denne rapporten utviklet FN sine tusenårsmål (3), der spesifikke helseintervensjoner, særlig rettet mot mødre- og barnehelse og mot bekjempelse av de store infeksjonssykdommene, sidestilles med andre utviklingstiltak, slik som bedret utdanning og fattigdomsbekjempelse. Det er ikke tilfeldig at disse to prosessene var koblet begge ble ledet av økonomen Jeffrey D. Sachs. Bloom & Canning har påvist sammenhengen mellom redusert barnedødelighet, lavere fertilitet og økonomisk vekst. De innførte begrepet «den demografiske gave» (the demographic gift), en aldersdistribusjon der en større del av befolkningen er i produktiv alder (1). Basert på denne forståelsen er det iverksatt en rekke målrettede tiltak for å bedre barns helsetilstand og gi dem større overlevelsessjanser (4 7). Det fjerde tusenårsmålet sier at dødeligheten blant barn under fem år skal reduseres med to tredeler fra 1990 til 2015, et ambisiøst mål der full dekning med de seks basisvaksinene (BCG, stivkrampe, difteri, kikhoste, polio og meslinger) er en viktig komponent. Etter at dekningen med disse vaksinene falt i løpet av 1990-årene, kom det mot slutten av dette tiåret en ny giv, ikke bare for å øke basisvaksinasjonsdekningen, men også for å introdusere nye vaksiner mot andre viktige infeksjonssykdommer. Man innså raskt at ingen organisasjon alene i vesentlig grad kunne styrke vaksinasjonsprogrammene i den tredje verden og at man trengte en allianse av partnere. The Global Alliance for Vaccines and Immunization (GAVI) ble skapt. I september 1999 donerte Bill Gates 750 millioner dollar for en femårsperiode. Dette sprengte den vanlige oppfatning av utviklingshjelp som et offentlig anliggende. Samarbeid med privat sektor ble nå ansett som grunnleggende. GAVI ble formelt lansert på Verdens økonomiske forum (World Economic Forum) i Davos i januar 2000 og har som målsetting å beskytte barn og voksne i alle verdens land, uavhengig av sosioøkonomisk status, mot vaksineforebyggbare sykdommer (ramme 1). Fem år senere kunne WHO og UNICEF vise til resultatene av GAVIs satsing. Vaksinedekningen med basisvaksiner var på vei oppover igjen (fig 1), over 1,7 millioner liv var reddet, og nesten 100 millioner barn var blitt vaksinert mot hepatitt B. Femårsprosjektet ble forlenget til 15 år, og GAVI blir modell for utprøvning av nye finansieringsmekanismer. Innsatsen vil bli tre ganger så stor. Bill Gates bidrar med nye 750 millioner, og sammen med solide bevilgninger fra vestlige land, først Norge og Nederland, deretter Storbritannia, USA, Frankrike, Sverige og Danmark, blir det gitt muligheter for langsiktig satsing. For første gang blir det gitt bindende tiårsrammer for u-hjelp. GAVI konsentrerte seg om de 75 fattigste landene i verden. For å komme raskt i gang og for å sikre en omfattende tilnærming bestemte man at alle land skulle stå fritt til å sende inn søknader om støtte. Mange var nervøse for at GAVI gapte over for mye for raskt. Ville det ikke være bedre å satse på en håndfull «demonstrasjonsland»? Argumentet om at man gikk for fort frem og at man ikke visste i hvilke land GAVI mest effektivt kunne bidra, vant frem. Siden det dreide seg om nye penger, var det viktig at man satset! Hovedbudskap Vaksinasjon er en effektiv intervensjon, men med komplisert produksjon og distribusjon Helse og vaksinasjon spiller en viktig rolle for økonomisk vekst i fattige land I de senere år er det utviklet nye samarbeidsformer, strategier og finansieringsformer Nye og lovende vaksiner kan, forutsatt rettferdig distribusjon, være et vesentlig bidrag til bedre folkehelse i fattige land 2674 Tidsskr Nor Lægeforen nr. 20, 2006; 126:
20 MEDISIN OG VITENSKAP på noe nytt og ikke subsidierte eller erstattet pågående arbeid. I GAVI bestemte man seg for også å satse på vaksiner som ennå ikke var innført i den fattigste del av verden, nemlig vaksiner mot gulfeber, hepatitt B og Haemophilus influenzae type b (Hib). GAVI kom også til den konklusjon at for å sikre økt vaksinedekning måtte man satse på å støtte helsetjenesten. Men hvordan kunne man gjøre dette på en måte som harmonerte med bred sektorstøtte, som var blitt rådende politikk for utviklingssamarbeid? Ideen om å betale for oppnådde resultater slo rot. Fordi betalingen var basert på innsats, skulle det være opp til landet selv å bestemme hvordan midlene skulle brukes. Dette ville være forenlig med sektorstøtteprinsippet. De tre første årene ble landene gitt forskudd på bagrunn av planer om økt vaksinasjonsdekning. Det var stor optimisme rundt tusenårsskiftet. Brundtlands høyre hånd i WHO, Jonas Gahr Støre, tok initiativ til en massiv innsats mot aids, malaria og tuberkulose, med GAVI som mal. G8 tok opp ideen, og et globalt fond mot aids, malaria og tuberkulose ble skapt. Hittil har man skaffet til veie i overkant av 10 milliarder dollar, og resultatene er i ferd med å komme. Motforestillinger Innovasjon stimulerer til motforestillinger. Kort tid etter at GAVI ble etablert, ble det reist en rekke kritiske spørsmål, som kort kan oppsummeres slik: Er det tilrådelig at filantropiske organisasjoner som Bill and Melinda Gates Foundation (BMGF) og mer eller mindre bindende gaver fra enkelte lands myndigheter blir viktige pilarer når det gjelder vaksinering av verdens barn? Hvor bærekraftig blir et globalt vaksinasjonsprogram som er basert på slike gaver? Risikerer vi at verdens vaksinasjonsprogrammer blir for avhengig av GAVI og bryter sammen når alliansen etter planen skulle opphøre etter fem år? GAVI er heller ikke underlagt demokratisk kontroll, slik som WHO, hvor hvert enkelt land har en stemme. I GAVIs styre på 15 medlemmer er mottakerlandene underrepresentert i forhold til giverorganisasjonene og giverlandene. Vaksineindustrien har to representanter, en fra industrialiserte land og en fra utviklingsland. En annen motforestilling er at en av GAVIs forutsetninger for å støtte introduksjon av nye vaksiner er at søkerlandet kan dokumentere at det har oppnådd minst 50 % dekning med den siste dosen av difteri-stivkrampe-kikhoste-vaksinen. 50 % dekning er lavt, langt under det man oppnådde i de aller fleste land på slutten av 1980-årene. Det er også fremholdt at GAVI i de første årene brukte omtrent to tredeler av sine midler på introduksjon av hepatitt B-vaksinen og den vesentlig dyrere Hib-vaksinen, mens bare en tredel gikk til å styrke helsesektortiltak, primært for å øke dekningsgraden av basisvaksinene. Dette står i kontrast til målsettingen om at 80 % av landene med GAVIstøtte innen rimelig tid skulle oppnå 80 % dekning med basisvaksinene i samtlige distrikter. Argumentet var at vaksinasjon med «dollarvaksinene» bør iverksettes først når nesten alle landets barn får «pennyvaksinene». Hvis ikke, risikerer vi at land med suboptimal basisvaksinasjonsdekning satser på de nye vaksinene. Dersom midlene fra GAVI og andre kortsiktige programmer blir borte, risikerer man i disse landene å stå igjen med et svekket vaksinasjonsprogram. Et argument har vært at suboptimal dekning skyldes et for svakt helsesystem, inkludert mangel på utdannet personell, at vaksiner går tapt pga. mangel på muligheter til kjølig lagring og dårlig utnyttelse av multidoseampuller. GAVI burde derfor i større grad satse på styrking av helsevesenet i det enkelte land slik at man får et bærekraftig system for å få basisvaksinene ut til flere. Hvordan kritikken kan håndteres Vi vil her ta for oss hvert av disse punktene for å forsøke å illustrere hvordan GAVI og dens partnere forsøker å håndtere denne konstruktive kritikken. Bærekraft for vaksinasjonsprogrammer i utviklingsland er et springende punkt. For å sitere Jeffrey Sachs, nå direktør ved The Earth Institute (8) og spesialrådgiver for FNs generalsekretær: «Det er ikke hjelp i ett eller to år, det er hjelp i 20 år vi trenger. Det Gates har gjort er fantastisk, men Gates kan ikke ta ansvaret for dette alene.» Ideelt sett bør hvert land, med støtte fra WHO, ha tilstrekkelige økonomiske og menneskelige ressurser til full dekning med samtlige tilgjengelige vaksiner mot de store infeksjonssykdommene. Situasjonen er imidlertid en annen, og GAVI forsøker sammen med nasjonale og internasjonale partnere å bidra til å øke den langsiktige vaksinasjonsdekningen. Flere prinsipper benyttes for å bidra til implementeringseffektivitet og langsiktighet. Prestasjonsbaserte bevilgninger Frem til 2005 kunne land med under 80 % basisvaksinasjonsdekning søke om midler til å styrke kapasiteten. Begrensningen på 80 % er nå hevet med den hensikt å bidra til å styrke helsesystemene ytterligere, også i land med forholdsvis god dekningsgrad. Landene bestemmer selv hvordan helsesystemene best bygges opp for å øke dekningsgraden. Senere tilskudd er betinget av at landene kan dokumentere økt vaksinasjonsdekning. Bill og Melinda Gates har bidratt med betydelige midler til The Global Alliance for Vaccines and Immunization (GAVI). Foto Adrian Wyld, AP/SCANPIX Innkjøpsfond Land med over 50 % dekning med basisvaksinene kan altså søke om midler til vaksinasjon med de nyere og mindre brukte vaksinene mot hepatitt B og Haemophilus influenzae type b, som kan gis sammen med difteri-stivkrampe-kikhoste-vaksinen og gulfebervaksinen. Ved å koordinere innkjøp av disse vaksinene gjennom UNICEF er etterspørselen økt betydelig og blitt mer stabil og forutsigbar. Da GAVI ble opprettet, var det bare én produsent, nå er det blitt flere, særlig i utviklingsland. Dette vil stabilisere produksjonen og ventelig føre til betydelig prisreduksjon. Langsiktige bevilgninger Så langt har Brasil, Frankrike, Italia, Norge, Spania, Sverige, Storbritannia og Sør-Afrika gått sammen om å etablere International Finance Facility for Immunization (IFFIm) (9), som gir langsiktige og forpliktende bevilgninger til GAVI til innkjøp av både basisvaksiner og de nyere vaksinene. Midlene skal også gå til å styrke helsesystemene. GAVI arbeider i et tiårsperspektiv, Ramme 1 De strategiske målsettingene for GAVI, Global Alliance for Vaccines and Immunization, kan oppsummeres slik: Øke tilgangen til bærekraftige vaksinasjonstilbud Øke bruken av sikre og kostnadseffektive vaksiner og fremme andre egnede helsefremmende tiltak ved vaksinasjonskontaktene Støtte nasjonale og internasjonale tiltak for akselerert kontroll av vaksineforebyggbare sykdommer Akselerere utvikling og introduksjon av nye vaksiner og relevante teknologier Akselerere forsknings- og utviklingstiltak for vaksiner rettet primært mot bruk i utviklingsland Bidra til at bedret vaksinasjonsdekning står sentralt i internasjonalt utviklingsarbeid Tidsskr Nor Lægeforen nr. 20, 2006;
NITO Bioingeniørfaglig Institutt kurs i Immunologi The Edge, Tromsø, 11. februar 2015. Generell Immunologi
 NITO Bioingeniørfaglig Institutt kurs i Immunologi The Edge, Tromsø, 11. februar 2015 Generell Immunologi Tor B Stuge Immunologisk forskningsgruppe, IMB Universitetet i Tromsø Innhold: 1. Immunsystemets
NITO Bioingeniørfaglig Institutt kurs i Immunologi The Edge, Tromsø, 11. februar 2015 Generell Immunologi Tor B Stuge Immunologisk forskningsgruppe, IMB Universitetet i Tromsø Innhold: 1. Immunsystemets
Forløp av ikke-adaptiv og adaptiv immunrespons. Mononukleære celler, metylfiolett farging
 Forløp av ikke-adaptiv og adaptiv immunrespons Mononukleære celler, metylfiolett farging 1 Nøytrofile granulocytter Gjenkjennelsesprinsipper medfødt vs. adaptiv immunitet Toll Like Receptors Mikroorganismer
Forløp av ikke-adaptiv og adaptiv immunrespons Mononukleære celler, metylfiolett farging 1 Nøytrofile granulocytter Gjenkjennelsesprinsipper medfødt vs. adaptiv immunitet Toll Like Receptors Mikroorganismer
1. Medfødt og ervervet immunitet. Karl Schenck, V2015
 1. Medfødt og ervervet immunitet Karl Schenck, V2015 Medfødt og ervervet immunforsvar Antimicrobial peptides «Alltid beredt!» Relativt uspesifikt Må aktiveres Spesifikt Komponenter av medfødt immunitet
1. Medfødt og ervervet immunitet Karl Schenck, V2015 Medfødt og ervervet immunforsvar Antimicrobial peptides «Alltid beredt!» Relativt uspesifikt Må aktiveres Spesifikt Komponenter av medfødt immunitet
Oppgave: MED1100-3_OPPGAVE2_V18_ORD
 Side 15 av 46 Oppgave: MED1100-3_OPPGAVE2_V18_ORD Del 1: Hvilke av de følgende celler uttrykker normalt (i hvilende tilstand) HLA klasse II molekyler hos mennesket? Angi de tre riktigste svarene. Fibroblaster
Side 15 av 46 Oppgave: MED1100-3_OPPGAVE2_V18_ORD Del 1: Hvilke av de følgende celler uttrykker normalt (i hvilende tilstand) HLA klasse II molekyler hos mennesket? Angi de tre riktigste svarene. Fibroblaster
Generell immunologi og immunforsvaret på 45 minutt
 Generell immunologi og immunforsvaret på 45 minutt NITO BIOINGENIØRFAGLIG INSTITUTT, Immunologi og immunologiske metoder, etterutdanningskurs 27. 28.november 2018 Kirsti Hokland bioingeniør og universitetslektor
Generell immunologi og immunforsvaret på 45 minutt NITO BIOINGENIØRFAGLIG INSTITUTT, Immunologi og immunologiske metoder, etterutdanningskurs 27. 28.november 2018 Kirsti Hokland bioingeniør og universitetslektor
Selv. Trygg Ignorere. Farlig. Fremmed. Immunsystemet: Generelt, og om allergi spesielt. Immunsystemets utfordring. Medfødte og ervervete immunsystemet
 U N I V E R S I T E T E T I B E R G E N Immunsystemet: Generelt, og om allergi spesielt Silke Appel Broegelmanns Forskningslaboratorium Klinisk Institutt 2 Universitetet i Bergen silke.appel@ Immunsystemets
U N I V E R S I T E T E T I B E R G E N Immunsystemet: Generelt, og om allergi spesielt Silke Appel Broegelmanns Forskningslaboratorium Klinisk Institutt 2 Universitetet i Bergen silke.appel@ Immunsystemets
Oppgave: MED1100-3_OPPGAVE2_H16_KONT
 Side 10 av 35 Oppgave: MED1100-3_OPPGAVE2_H16_KONT Del 1: Ola har en arvelig betinget kombinert immundefekt med mangel på både T-celler og B-celler. Ola får derfor gjentatte Hvorfor er Ola beskyttet mot
Side 10 av 35 Oppgave: MED1100-3_OPPGAVE2_H16_KONT Del 1: Ola har en arvelig betinget kombinert immundefekt med mangel på både T-celler og B-celler. Ola får derfor gjentatte Hvorfor er Ola beskyttet mot
Hva er en vaksine? Hanne Nøkleby, Nasjonalt folkehelseinstitutt
 Hva er en vaksine? Hanne Nøkleby, Nasjonalt folkehelseinstitutt Utgangspunktet Mange infeksjonssykdommer gir langvarig / livslang immunitet Vaksinering har som mål å få kroppen til å utvikle samme immunitet
Hva er en vaksine? Hanne Nøkleby, Nasjonalt folkehelseinstitutt Utgangspunktet Mange infeksjonssykdommer gir langvarig / livslang immunitet Vaksinering har som mål å få kroppen til å utvikle samme immunitet
BIOS 1 Biologi
 . Figurer kapittel 10: Menneskets immunsystem Figur s. 281 En oversikt over immunsystemet og viktige celletyper.> Immunsystemet Uspesifikt immunforsvar Spesifikt immunforsvar Ytre forsvar: hindrer mikroorganismer
. Figurer kapittel 10: Menneskets immunsystem Figur s. 281 En oversikt over immunsystemet og viktige celletyper.> Immunsystemet Uspesifikt immunforsvar Spesifikt immunforsvar Ytre forsvar: hindrer mikroorganismer
5. T cellers effektorfunksjoner
 Immunologi 3. semester, V2015 5. T cellers effektorfunksjoner Karl Schenck Institutt for oral biologi Noen typer effektor T celler 3 3 IFNg IL-4 IL-17 IL-10 TGFb TGFb IL-4 Secretory IgA Enhance mast cell
Immunologi 3. semester, V2015 5. T cellers effektorfunksjoner Karl Schenck Institutt for oral biologi Noen typer effektor T celler 3 3 IFNg IL-4 IL-17 IL-10 TGFb TGFb IL-4 Secretory IgA Enhance mast cell
Flervalgsoppgaver: Immunsystemet
 Flervalgsoppgaver - immunsystemet Hver oppgave har ett riktig svaralternativ. Immunsystemet 1 Vaksinasjon der det tilføres drepte, sykdomsfremkallende virus gir A) passiv, kunstig immunitet B) aktiv kunstig,
Flervalgsoppgaver - immunsystemet Hver oppgave har ett riktig svaralternativ. Immunsystemet 1 Vaksinasjon der det tilføres drepte, sykdomsfremkallende virus gir A) passiv, kunstig immunitet B) aktiv kunstig,
Grunnkurs C. Janne Dahle-Melhus Kommuneoverlege Sola kommune Smittevernoverlege Stavanger kommune
 Grunnkurs C Janne Dahle-Melhus Kommuneoverlege Sola kommune Smittevernoverlege Stavanger kommune 1 Hvorfor vaksinere? Muligheten til å forebygge alvorlig sykdom med stor utbredelse har vært forutsetningen
Grunnkurs C Janne Dahle-Melhus Kommuneoverlege Sola kommune Smittevernoverlege Stavanger kommune 1 Hvorfor vaksinere? Muligheten til å forebygge alvorlig sykdom med stor utbredelse har vært forutsetningen
Kua, gutten og lymfeknuten immunologiske prinsipper for vaksinasjon
 MEDISIN OG VITENSKAP Tema Vaksinasjon Medisin og vitenskap tema Vaksinasjon Kua, gutten og lymfeknuten immunologiske prinsipper for vaksinasjon 2532 7 Sammendrag Vaksiner stimulerer immunsystemet ved å
MEDISIN OG VITENSKAP Tema Vaksinasjon Medisin og vitenskap tema Vaksinasjon Kua, gutten og lymfeknuten immunologiske prinsipper for vaksinasjon 2532 7 Sammendrag Vaksiner stimulerer immunsystemet ved å
4. Antigenpresentasjon til T celler. MHC molekyler.
 Immunologi 3. semester, V2015 4. Antigenpresentasjon til T celler. MHC molekyler. Karl Schenck Institutt for oral biologi TcR og MHC molekyler Noen hovedgrupper T celler som forlater thymus T celler med
Immunologi 3. semester, V2015 4. Antigenpresentasjon til T celler. MHC molekyler. Karl Schenck Institutt for oral biologi TcR og MHC molekyler Noen hovedgrupper T celler som forlater thymus T celler med
Immunitet hos eldre. Lisbeth Meyer Næss Divisjon for smittevern. Vaksinedagene 2010
 Immunitet hos eldre Lisbeth Meyer Næss Divisjon for smittevern Vaksinedagene 2010 Andelen eldre i befolkningen øker 14 % av befolkning 12 10 8 6 4 2 2010 2020 2060 0 67-79 80- Alder Antall > 65 år 2010:
Immunitet hos eldre Lisbeth Meyer Næss Divisjon for smittevern Vaksinedagene 2010 Andelen eldre i befolkningen øker 14 % av befolkning 12 10 8 6 4 2 2010 2020 2060 0 67-79 80- Alder Antall > 65 år 2010:
Hensikten med et vaksinasjonsprogram
 Hensikten med et vaksinasjonsprogram Individuell vaksinasjon versus samfunnsrettet vaksinasjonsprogram Hanne Nøkleby Nasjonalt folkehelseinstitutt Hva skiller vaksinasjonsprogram fra annen vaksinering?
Hensikten med et vaksinasjonsprogram Individuell vaksinasjon versus samfunnsrettet vaksinasjonsprogram Hanne Nøkleby Nasjonalt folkehelseinstitutt Hva skiller vaksinasjonsprogram fra annen vaksinering?
Vaksineprinsipper og immunrespons
 Vaksineprinsipper og immunrespons - Hvordan virker vaksiner på immunforsvaret vårt? Lisbeth Meyer Næss Seniorforsker Divisjon for Smittevern Folkehelseinstituttet Nordisk naturmedisinsk fagkongress 2015
Vaksineprinsipper og immunrespons - Hvordan virker vaksiner på immunforsvaret vårt? Lisbeth Meyer Næss Seniorforsker Divisjon for Smittevern Folkehelseinstituttet Nordisk naturmedisinsk fagkongress 2015
Hvorfor er det viktig med høy vaksinasjonsdekning, og hvordan oppnå det? Hanne Nøkleby Folkehelseinstituttet Agderkonferansen 2016
 Hvorfor er det viktig med høy vaksinasjonsdekning, og hvordan oppnå det? Hanne Nøkleby Folkehelseinstituttet Agderkonferansen 2016 Hvorfor fokus på vaksinasjonsprogrammet? All vaksinasjon tar sikte på
Hvorfor er det viktig med høy vaksinasjonsdekning, og hvordan oppnå det? Hanne Nøkleby Folkehelseinstituttet Agderkonferansen 2016 Hvorfor fokus på vaksinasjonsprogrammet? All vaksinasjon tar sikte på
Immunologi 5 Effektormekanismer Trond S. Halstensen
 Immunologi 5 Effektormekanismer Trond S. Halstensen Aktivering av naive/memory T celler Th1 / Th2 konseptet Regulatoriske mekanismer T-cytotoxiske celler T-celler gjenkjenner lineære peptider presentert
Immunologi 5 Effektormekanismer Trond S. Halstensen Aktivering av naive/memory T celler Th1 / Th2 konseptet Regulatoriske mekanismer T-cytotoxiske celler T-celler gjenkjenner lineære peptider presentert
Cellebiologiske prosesser som respons på virusinfeksjon
 Cellebiologiske prosesser som respons på virusinfeksjon PBM 336 2005 Siri Mjaaland Infeksjoner - immunresponser 1 Figure 2-49 Interferoner Uspesifikk immunitet viral infeksjon stimulerer direkte produksjon
Cellebiologiske prosesser som respons på virusinfeksjon PBM 336 2005 Siri Mjaaland Infeksjoner - immunresponser 1 Figure 2-49 Interferoner Uspesifikk immunitet viral infeksjon stimulerer direkte produksjon
T celle aktivering og HLA Trond S. S. Halstensen
 T celle aktivering og HLA Trond S. S. Halstensen T-celler og Thymus T cellens identifisering av antigener Human Leukocyt Antigen (HLA) restriksjon, CD4 og CD8 Antigen prosessering: cytosol- og endocytisk
T celle aktivering og HLA Trond S. S. Halstensen T-celler og Thymus T cellens identifisering av antigener Human Leukocyt Antigen (HLA) restriksjon, CD4 og CD8 Antigen prosessering: cytosol- og endocytisk
B celler og antistoffer
 Immunologi 3. semester, V2015 Forelesning 3: B celler og antistoffer Karl Schenck Institutt for oral biologi I dag Innledning Struktur lymfeknuter og milt Migrasjon av leukocytter Primær og sekundær respons
Immunologi 3. semester, V2015 Forelesning 3: B celler og antistoffer Karl Schenck Institutt for oral biologi I dag Innledning Struktur lymfeknuter og milt Migrasjon av leukocytter Primær og sekundær respons
Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran, mobil tlf. nr
 Side 1 av 6 Norges teknisknaturvitenskapelige universitet Fakultet for naturvitenskap og teknologi Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran, mobil tlf. nr. 906 30 861
Side 1 av 6 Norges teknisknaturvitenskapelige universitet Fakultet for naturvitenskap og teknologi Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran, mobil tlf. nr. 906 30 861
Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran mobil tlf. nr Sensurdato: 3 uker fra eksamen + 10 dager
 Side 1 av 7 Norges teknisknaturvitenskapelige universitet Fakultet for naturvitenskap og teknologi Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran mobil tlf. nr. 906 30 861
Side 1 av 7 Norges teknisknaturvitenskapelige universitet Fakultet for naturvitenskap og teknologi Institutt for biologi Faglig kontaktperson(er) under eksamen: Diem Hong Tran mobil tlf. nr. 906 30 861
Vaksiner en liten historikk. Hanne Nøkleby
 Vaksiner en liten historikk Hanne Nøkleby Det begynte i Asia: Kina 3000 år f.kr: inhalasjon av pulver fra koppeskorper! Variolisiering: inokuloasjon av pustelmateriale fra lett tilfelle av kopper Kanskje
Vaksiner en liten historikk Hanne Nøkleby Det begynte i Asia: Kina 3000 år f.kr: inhalasjon av pulver fra koppeskorper! Variolisiering: inokuloasjon av pustelmateriale fra lett tilfelle av kopper Kanskje
6. Antistoffklasser og deres funksjon Komplementsystemet. Immunisering. Hypersensitivitet. Toleranse.
 Immunologi 3. semester, V2015 6. Antistoffklasser og deres funksjon Komplementsystemet. Immunisering. Hypersensitivitet. Toleranse. Karl Schenck Institutt for oral biologi Antistoffklasser og deres funksjon
Immunologi 3. semester, V2015 6. Antistoffklasser og deres funksjon Komplementsystemet. Immunisering. Hypersensitivitet. Toleranse. Karl Schenck Institutt for oral biologi Antistoffklasser og deres funksjon
'1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ
 '1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ $XGXQÃ1HUODQGÃ 'HWÃHUÃLQJHQÃWYLOÃRPÃDWÃYDNVLQHULQJÃHUÃHQÃDYÃKRYHGJUXQQHQHÃWLOÃDWÃILVNHRSSGUHWWÃ KDUÃYRNVWÃWLOÃHQÃDYÃ1RUJHVÃVW UVWHÃQ ULQJHUÃLÃO SHWÃDYÃGHÃVLVWHÃÃnUHQHÃ7UDVVÃLÃ
'1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ $XGXQÃ1HUODQGÃ 'HWÃHUÃLQJHQÃWYLOÃRPÃDWÃYDNVLQHULQJÃHUÃHQÃDYÃKRYHGJUXQQHQHÃWLOÃDWÃILVNHRSSGUHWWÃ KDUÃYRNVWÃWLOÃHQÃDYÃ1RUJHVÃVW UVWHÃQ ULQJHUÃLÃO SHWÃDYÃGHÃVLVWHÃÃnUHQHÃ7UDVVÃLÃ
GMO og samfunnsnytte. GMO-vurderingskriterier PGD og ukjent bærerstatus Norsk vaksineoppfinnelse
 Tidsskrift fra Bioteknologinemnda Nr. 4/2009 18. årgang GMO og samfunnsnytte GMO-vurderingskriterier PGD og ukjent bærerstatus Norsk vaksineoppfinnelse Genmodifisert sukkerbete Vi er alle «bønder» Syntetisk
Tidsskrift fra Bioteknologinemnda Nr. 4/2009 18. årgang GMO og samfunnsnytte GMO-vurderingskriterier PGD og ukjent bærerstatus Norsk vaksineoppfinnelse Genmodifisert sukkerbete Vi er alle «bønder» Syntetisk
An#bio#karesistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseins#tu;et 6. November 2015
 An#bio#karesistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseins#tu;et 6. November 2015 Mulig vaksineeffekt mot an#bio#karesistens Redusere mengden infeksjoner som krever an#bio#kabehandling Redusere
An#bio#karesistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseins#tu;et 6. November 2015 Mulig vaksineeffekt mot an#bio#karesistens Redusere mengden infeksjoner som krever an#bio#kabehandling Redusere
INNHOLD 13. SEKSJON I Introduksjon
 INNHOLD 13 SEKSJON I Introduksjon 14 SEKSJON I, INTRODUKSJON KAPITTEL 1 Innledningen til immunologien. En oversikt TEMA Medfødt og ervervet infeksjonsforsvar danner kroppens forsvar mot mikrorganismer.
INNHOLD 13 SEKSJON I Introduksjon 14 SEKSJON I, INTRODUKSJON KAPITTEL 1 Innledningen til immunologien. En oversikt TEMA Medfødt og ervervet infeksjonsforsvar danner kroppens forsvar mot mikrorganismer.
Har vi et barnevaksinasjonsprogram som virker? Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Folkehelseinstituttet
 Har vi et barnevaksinasjonsprogram som virker? Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Folkehelseinstituttet Vaksiner redder liv Lørdagsseminar UiO 26. april 2014 Hva er
Har vi et barnevaksinasjonsprogram som virker? Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Folkehelseinstituttet Vaksiner redder liv Lørdagsseminar UiO 26. april 2014 Hva er
Barnevaksinasjonsprogrammet sett med folkehelsebriller
 Barnevaksinasjonsprogrammet sett med folkehelsebriller Hanne Nøkleby, Folkehelseinstituttet 27.09.2018 Hva er forskjellen på vaksinasjonsprogram og annen vaksinasjon? All vaksinasjon tar sikte på å beskytte
Barnevaksinasjonsprogrammet sett med folkehelsebriller Hanne Nøkleby, Folkehelseinstituttet 27.09.2018 Hva er forskjellen på vaksinasjonsprogram og annen vaksinasjon? All vaksinasjon tar sikte på å beskytte
Immunitet mot rubella. Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015
 Immunitet mot rubella Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015 Utgangspunktet: Forespørsel fra en mikrobiologisk avdeling: Hvordan skal vi tolke prøvesvar der vi finner antistoff mot rubella,
Immunitet mot rubella Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015 Utgangspunktet: Forespørsel fra en mikrobiologisk avdeling: Hvordan skal vi tolke prøvesvar der vi finner antistoff mot rubella,
KROPPENS FORSVARSMEKANISMER
 KROPPENS FORSVARSMEKANISMER Immunitet = fri for, uberørt av Immunologi Immunsystemet Uspesifikke forsvarsmekanismer Ytre- og indre forsvarslinje Spesifikke forsvarsmekanismer Cellulære forsvar (T-celler)
KROPPENS FORSVARSMEKANISMER Immunitet = fri for, uberørt av Immunologi Immunsystemet Uspesifikke forsvarsmekanismer Ytre- og indre forsvarslinje Spesifikke forsvarsmekanismer Cellulære forsvar (T-celler)
Grunnleggende immunologi
 Grunnleggende immunologi Anne Storset anne.storset@nmbu.no Institutt for Mattrygghet og infeksjonsbiologi Norges miljø- og biovitenskapelige universitet 1 Sykdom Ervervet immunitet Medfødt immunitet Fysiske
Grunnleggende immunologi Anne Storset anne.storset@nmbu.no Institutt for Mattrygghet og infeksjonsbiologi Norges miljø- og biovitenskapelige universitet 1 Sykdom Ervervet immunitet Medfødt immunitet Fysiske
1 FYS3710 Immunologi
 1 2 Immunsystemet Dette kan best sammenlignes med et allestedsnærværende geriljaforsvar mot fremmede molekyler 3 Definisjoner av begreper. Infeksjon: Invasjon i kroppen av infeksiøse agens. Disse omfatter
1 2 Immunsystemet Dette kan best sammenlignes med et allestedsnærværende geriljaforsvar mot fremmede molekyler 3 Definisjoner av begreper. Infeksjon: Invasjon i kroppen av infeksiøse agens. Disse omfatter
Vaksiner før og nå (med litt om herpes zoster og ebola)
 Vaksiner før og nå (med litt om herpes zoster og ebola) Hanne Nøkleby, Nasjonalt folkehelseinstitutt Hva er vaksiner og hvordan ble de til? Litt historikk Litt om det som skjer på vaksinefeltet Litt om
Vaksiner før og nå (med litt om herpes zoster og ebola) Hanne Nøkleby, Nasjonalt folkehelseinstitutt Hva er vaksiner og hvordan ble de til? Litt historikk Litt om det som skjer på vaksinefeltet Litt om
Barnevaksinasjonsprogrammet i Norge. Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt
 Barnevaksinasjonsprogrammet i Norge Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt Dagsseminar om vaksinasjon av barn, Bristol 2013 Hva er forskjellen
Barnevaksinasjonsprogrammet i Norge Marianne A. Riise Bergsaker Avdeling for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt Dagsseminar om vaksinasjon av barn, Bristol 2013 Hva er forskjellen
Antibiotikaresistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2016
 Antibiotikaresistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2016 Hvordan kan vaksiner motvirke antibiotikaresistens? Redusere mengden infeksjoner som krever antibiotikabehandling
Antibiotikaresistens: Er vaksiner løsningen? Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2016 Hvordan kan vaksiner motvirke antibiotikaresistens? Redusere mengden infeksjoner som krever antibiotikabehandling
«Immunterapi» Kreftutvikling. Myelomatose. Immunterapi. Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU
 «Immunterapi» Kreftutvikling Myelomatose Immunterapi Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU 1 Kreft er genetiske sykdommer i den forstand at det alltid
«Immunterapi» Kreftutvikling Myelomatose Immunterapi Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU 1 Kreft er genetiske sykdommer i den forstand at det alltid
Utvikling av nye vaksiner. Hanne Nøkleby, Nasjonalt folkehelseinstitutt
 Utvikling av nye vaksiner Hanne Nøkleby, Nasjonalt folkehelseinstitutt Utfordringer De vaksinene som er «lette å lage» har vi allerede De vaksinene det nå arbeides med, er vanskelige: Gjennomgått sykdom
Utvikling av nye vaksiner Hanne Nøkleby, Nasjonalt folkehelseinstitutt Utfordringer De vaksinene som er «lette å lage» har vi allerede De vaksinene det nå arbeides med, er vanskelige: Gjennomgått sykdom
Vaksinering av personer med nedsatt immunforsvar
 Vaksinering av personer med nedsatt immunforsvar FIRM konferanse Bodø 25.08.13 Eigil Gulliksen Forsvaret Stamina Bryggeklinikken Disposisjon Kort om immunsvikt Immunsvikt og vaksinering generelt Immunsvikt
Vaksinering av personer med nedsatt immunforsvar FIRM konferanse Bodø 25.08.13 Eigil Gulliksen Forsvaret Stamina Bryggeklinikken Disposisjon Kort om immunsvikt Immunsvikt og vaksinering generelt Immunsvikt
Barn påp. reise. 8. sept. 2006 Harald Hauge overlege
 Barn påp reise 8. sept. 2006 Harald Hauge overlege Risiko for alvorlig infeksjoner hos de minste barnna NORMENN PÅ REISE ÅR 2006 Ca. 1,2 mill. nordmenn dro ut av Norge juli med fly!! 1 av 3 blir syke på
Barn påp reise 8. sept. 2006 Harald Hauge overlege Risiko for alvorlig infeksjoner hos de minste barnna NORMENN PÅ REISE ÅR 2006 Ca. 1,2 mill. nordmenn dro ut av Norge juli med fly!! 1 av 3 blir syke på
Alkoholens effekter på immunsystemet
 Alkoholens effekter på immunsystemet NFRAM Jubileumskonferanse i Bodø 12.10.16. Asle Enger, klinikkoverlege Trasoppklinikken Om alkohol og økt infeksjonsrisiko «I praksis hver eneste celle i kroppen kan
Alkoholens effekter på immunsystemet NFRAM Jubileumskonferanse i Bodø 12.10.16. Asle Enger, klinikkoverlege Trasoppklinikken Om alkohol og økt infeksjonsrisiko «I praksis hver eneste celle i kroppen kan
Grunnleggende kunnskap for vaksineutvikling
 Strategisamling FHF Trondheim 1. juni 2001 Grunnleggende kunnskap for vaksineutvikling Siri Mjaaland Veterinærinstituttet / FHI Bakgrunn Virussykdommer stort problem for oppdrettsnæringen Dagens vaksiner
Strategisamling FHF Trondheim 1. juni 2001 Grunnleggende kunnskap for vaksineutvikling Siri Mjaaland Veterinærinstituttet / FHI Bakgrunn Virussykdommer stort problem for oppdrettsnæringen Dagens vaksiner
Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU
 Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU 1 3 typer immunterapi; Antistoffer som aktiverer immunforsvaret mot kreftcellene. (Anti-CTLA4, -PD1/PD1L) Antistoffer som binder kreftceller
Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU 1 3 typer immunterapi; Antistoffer som aktiverer immunforsvaret mot kreftcellene. (Anti-CTLA4, -PD1/PD1L) Antistoffer som binder kreftceller
Vaksinering av immunsupprimerte. Hanne Nøkleby Nasjonalt folkehelseinstitutt
 Vaksinering av immunsupprimerte Hanne Nøkleby Nasjonalt folkehelseinstitutt Tre spørsmål før vaksinering av immunsupprimerte pasienter: Kan det være farlig å vaksinere? Har vaksinen effekt? Er det behov
Vaksinering av immunsupprimerte Hanne Nøkleby Nasjonalt folkehelseinstitutt Tre spørsmål før vaksinering av immunsupprimerte pasienter: Kan det være farlig å vaksinere? Har vaksinen effekt? Er det behov
Vaksinering og vaksineskepsis i Nesodden Kommune. Liv Bertheussen Tangløkken Hagen kommuneoverlege og fastlege i Nesodden kommune
 Vaksinering og vaksineskepsis i Nesodden Kommune Liv Bertheussen Tangløkken Hagen kommuneoverlege og fastlege i Nesodden kommune Barnevaksinasjonsprogrammet *Barnevaksinasjonsprogrammet startet i 1952
Vaksinering og vaksineskepsis i Nesodden Kommune Liv Bertheussen Tangløkken Hagen kommuneoverlege og fastlege i Nesodden kommune Barnevaksinasjonsprogrammet *Barnevaksinasjonsprogrammet startet i 1952
Første Tann. Bakterie kolonisering Immunreaksjon? Streptokoccus Mut. Toleranse? IgA mot Str. Mut? IgG beskytter. Ekslusjon og toleranse?
 Første Tann Bakterie kolonisering Immunreaksjon? Streptokoccus Mut. Toleranse? IgA mot Str. Mut? IgG beskytter Ekslusjon og toleranse? Naturlig Immunitet Barrierer Hud: Fysisk sterk, Normal bakterie flora,
Første Tann Bakterie kolonisering Immunreaksjon? Streptokoccus Mut. Toleranse? IgA mot Str. Mut? IgG beskytter Ekslusjon og toleranse? Naturlig Immunitet Barrierer Hud: Fysisk sterk, Normal bakterie flora,
Innhold. Kikhoste 05.11.2015. Barnevaksinasjonsprogrammet - går det mot amerikanske tilstander?
 Barnevaksinasjonsprogrammet - går det mot amerikanske tilstander? Øystein Riise, barnelege Avd. for vaksine Divisjon for smittevern Innhold Hvorfor har vi et barnevaksinasjonsprogram? Utviklingen av programmet
Barnevaksinasjonsprogrammet - går det mot amerikanske tilstander? Øystein Riise, barnelege Avd. for vaksine Divisjon for smittevern Innhold Hvorfor har vi et barnevaksinasjonsprogram? Utviklingen av programmet
Pnemokokkvaksine i barnevaksinasjonsprogrammet
 Pnemokokkvaksine i barnevaksinasjonsprogrammet Marianne A. Riise Bergsaker, overlege Avdeling for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt 1 Vaksinedagene 2006 Pressemelding Nr.: 5
Pnemokokkvaksine i barnevaksinasjonsprogrammet Marianne A. Riise Bergsaker, overlege Avdeling for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt 1 Vaksinedagene 2006 Pressemelding Nr.: 5
Influensa og immunsystemet Kristin G-I Mohn HUS, Influensasenteret i Bergen 13.06.13
 Influensa og immunsystemet Kristin G-I Mohn HUS, Influensasenteret i Bergen 13.06.13 Vakkert og virulent Virus - virulens - virkning Virus replikerer i luftveiene Aerosoler smitter Hemaggluttinin (HA)
Influensa og immunsystemet Kristin G-I Mohn HUS, Influensasenteret i Bergen 13.06.13 Vakkert og virulent Virus - virulens - virkning Virus replikerer i luftveiene Aerosoler smitter Hemaggluttinin (HA)
Vaksinasjon av helsepersonell i sykehjem Hva og hvorfor?
 Vaksinasjon av helsepersonell i sykehjem Hva og hvorfor? Overlege Ragnhild Raastad Avd. for smittevern, OUS Vaksiner en forbannet velsignelse Fram til 1940 var det ikke våpen, men infeksjoner som tok
Vaksinasjon av helsepersonell i sykehjem Hva og hvorfor? Overlege Ragnhild Raastad Avd. for smittevern, OUS Vaksiner en forbannet velsignelse Fram til 1940 var det ikke våpen, men infeksjoner som tok
for overlevelse, men med risiko for kreft Fagdagene 10. juni 2010, Bodil Kavli
 Ervervet immunitetnødvendig for overlevelse, men med risiko for kreft Fagdagene 10. juni 2010, Bodil Kavli 1 Ervervet (spesifikk) immunitet Celle-mediert immunrespons Løselig immunrespons jenkjenner/ responderer
Ervervet immunitetnødvendig for overlevelse, men med risiko for kreft Fagdagene 10. juni 2010, Bodil Kavli 1 Ervervet (spesifikk) immunitet Celle-mediert immunrespons Løselig immunrespons jenkjenner/ responderer
AKTUELLE VAKSINER FOR HELSEARBEIDERE OG HVILKET TILBUD FINNES?
 AKTUELLE VAKSINER FOR HELSEARBEIDERE OG HVILKET TILBUD FINNES? Regionmøte i smittevern Solstrand 30. mai 2018 Trude Duelien Skorge Bedriftslege Bedriftshelsetjenesten i Helse Bergen Agenda 1. Bakgrunn
AKTUELLE VAKSINER FOR HELSEARBEIDERE OG HVILKET TILBUD FINNES? Regionmøte i smittevern Solstrand 30. mai 2018 Trude Duelien Skorge Bedriftslege Bedriftshelsetjenesten i Helse Bergen Agenda 1. Bakgrunn
Immunologi 6 Hypersensitivitetsmekanismer Trond S. Halstensen
 Immunologi 6 Hypersensitivitetsmekanismer Trond S. Halstensen Repetisjon av antigenpresentasjon og effektormekanismer Type I-V immunreaksjoner T-celler gjenkjenner lineære peptider presentert i HLA (Human
Immunologi 6 Hypersensitivitetsmekanismer Trond S. Halstensen Repetisjon av antigenpresentasjon og effektormekanismer Type I-V immunreaksjoner T-celler gjenkjenner lineære peptider presentert i HLA (Human
Figurer og tabeller kapittel 13 Immunforsvar, smittespredning og hygiene
 Side 262 Øre med ørevoks Øye med tårer Munn med spytt og slimhinner Slimhinner med normalflora Flimmerhår og slim i luftveier Hud med normalflora Magesyre Slimhinner med normalflora i urinveier og skjede
Side 262 Øre med ørevoks Øye med tårer Munn med spytt og slimhinner Slimhinner med normalflora Flimmerhår og slim i luftveier Hud med normalflora Magesyre Slimhinner med normalflora i urinveier og skjede
TNF/BiO og dermatologiske utfordringer. Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS
 TNF/BiO og dermatologiske utfordringer Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS Viktige dermatologiske lidelser som behandles med monoklonale
TNF/BiO og dermatologiske utfordringer Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS Viktige dermatologiske lidelser som behandles med monoklonale
Vaksineskepsis. Hanne Nøkleby Folkehelseinstituttet 14. November 2017
 Vaksineskepsis Hanne Nøkleby Folkehelseinstituttet 14. November 2017 Er vaksineskepsis et problem i Norge? Difteri Stivkrampe Kikhoste Polio Hib Pneumokokk Meslinger Kusma Rødehunder Landsbasis, 2016 95,739
Vaksineskepsis Hanne Nøkleby Folkehelseinstituttet 14. November 2017 Er vaksineskepsis et problem i Norge? Difteri Stivkrampe Kikhoste Polio Hib Pneumokokk Meslinger Kusma Rødehunder Landsbasis, 2016 95,739
VAKSINERE NÅ? Aktuelt om vaksinasjon og sykdommer hos hest
 VAKSINERE NÅ? Aktuelt om vaksinasjon og sykdommer hos hest PASS PÅ HESTEN DIN Luftveisinfeksjoner og andre smittsomme sykdommer kan idag spres raskt fordi hester transporteres i større grad i forbindelse
VAKSINERE NÅ? Aktuelt om vaksinasjon og sykdommer hos hest PASS PÅ HESTEN DIN Luftveisinfeksjoner og andre smittsomme sykdommer kan idag spres raskt fordi hester transporteres i større grad i forbindelse
Medikamentell Behandling
 www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
FORSKRIFT OM KOMMUNENS VAKSINASJONSTILBUD I HENHOLD TIL DET NASJONALE VAKSINASJONSPROGRAMMET
 FORSKRIFT OM KOMMUNENS VAKSINASJONSTILBUD I HENHOLD TIL DET NASJONALE VAKSINASJONSPROGRAMMET Fastsatt av Helse- og omsorgsdepartementet (dato) med hjemmel i lov 19. november 1982 nr. 66 om helsetjenesten
FORSKRIFT OM KOMMUNENS VAKSINASJONSTILBUD I HENHOLD TIL DET NASJONALE VAKSINASJONSPROGRAMMET Fastsatt av Helse- og omsorgsdepartementet (dato) med hjemmel i lov 19. november 1982 nr. 66 om helsetjenesten
Hva er myelomatose? Hva er immunterapi?
 Hva er myelomatose? Hva er immunterapi? Anders Sundan Senter for myelomforskning KREFTFORENINGEN 1 Kreft er genetiske sykdommer i den forstand at det alltid er genetiske forandringer (mutasjoner) i kreftcellene
Hva er myelomatose? Hva er immunterapi? Anders Sundan Senter for myelomforskning KREFTFORENINGEN 1 Kreft er genetiske sykdommer i den forstand at det alltid er genetiske forandringer (mutasjoner) i kreftcellene
Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning
 Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning Gustav Gaudernack Immunologisk avdeling Institutt for Kreftforskning Oslo Universitetsykehus-Radiumhospitalet Helse- og omsorgskonferansen
Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning Gustav Gaudernack Immunologisk avdeling Institutt for Kreftforskning Oslo Universitetsykehus-Radiumhospitalet Helse- og omsorgskonferansen
Immunsystemets dobbeltrolle i kreftutvikling
 MED-3950 5.-årsoppgaven Profesjonsstudiet i medisin ved Universitetet i Tromsø Immunsystemets dobbeltrolle i kreftutvikling Nora Ness MK-09 97533239, nora.ness4@gmail.com Veileder: Elin Richardsen IMB,
MED-3950 5.-årsoppgaven Profesjonsstudiet i medisin ved Universitetet i Tromsø Immunsystemets dobbeltrolle i kreftutvikling Nora Ness MK-09 97533239, nora.ness4@gmail.com Veileder: Elin Richardsen IMB,
Tuberkulose.
 Tuberkulose behov for mer effektiv behandling og nye vaksiner behov for å forstå vert-mikrobe forholdet bedre Persontilpasset behandling: immunterapi + antibiotika www.ntnu.edu/cemir Forskning på tuberkulose
Tuberkulose behov for mer effektiv behandling og nye vaksiner behov for å forstå vert-mikrobe forholdet bedre Persontilpasset behandling: immunterapi + antibiotika www.ntnu.edu/cemir Forskning på tuberkulose
KARAKTERISERING AV IgG1 OG IgG3 ANTISTOFFER DANNET ETTER VAKSINERING MED MenBvac
 Hovedoppgave i farmakognosi for graden cand. pharm. KARAKTERISERING AV IgG1 OG IgG3 ANTISTOFFER DANNET ETTER VAKSINERING MED MenBvac av Marit Øfsdahl Avdeling for farmasøytisk kjemi Farmasøytisk institutt
Hovedoppgave i farmakognosi for graden cand. pharm. KARAKTERISERING AV IgG1 OG IgG3 ANTISTOFFER DANNET ETTER VAKSINERING MED MenBvac av Marit Øfsdahl Avdeling for farmasøytisk kjemi Farmasøytisk institutt
Høringsnotat - forslag til endringer i blåreseptforskriften
 Høringsnotat - forslag til endringer i blåreseptforskriften Helse- og omsorgsdepartementet sender med dette forslag til endringer i Forskrift om stønad til dekning av utgifter til viktige legemidler mv.
Høringsnotat - forslag til endringer i blåreseptforskriften Helse- og omsorgsdepartementet sender med dette forslag til endringer i Forskrift om stønad til dekning av utgifter til viktige legemidler mv.
Colostrum FAQ. Hyppig stilte spørsmål om LRs Colostrum-produkter
 Colostrum FAQ Hyppig stilte spørsmål om LRs Colostrum-produkter Innholdsfortegnelse I. Hva er colostrum? S 3 II. Hvilket dyr kommer colostrum fra? S 3 III. Hva skjer med kalvene? S 3 IV. Hvorfor er colostrum
Colostrum FAQ Hyppig stilte spørsmål om LRs Colostrum-produkter Innholdsfortegnelse I. Hva er colostrum? S 3 II. Hvilket dyr kommer colostrum fra? S 3 III. Hva skjer med kalvene? S 3 IV. Hvorfor er colostrum
Figurer kap 6: Menneskets immunforsvar Figur s. 156
 Figurer kap 6: Menneskets immunforsvar Figur s. 156 kjemiske forbindelser bakterie røde blodceller fagocytt kapillæråre Huden blir skadet, og mikroorganismer kommer inn i kroppen. Mange fagocytter beveger
Figurer kap 6: Menneskets immunforsvar Figur s. 156 kjemiske forbindelser bakterie røde blodceller fagocytt kapillæråre Huden blir skadet, og mikroorganismer kommer inn i kroppen. Mange fagocytter beveger
Læringsutbyttebeskrivelse
 Inngår i emne: MED-1501 Medisin og odontologi 1. studieår Oppdatert dato: 10. november 2018 Godkjent av Studieplanutvalget medisin: 04.12.18 Omfang: 5 uker Faglig innhold Delemnet introduserer studenten
Inngår i emne: MED-1501 Medisin og odontologi 1. studieår Oppdatert dato: 10. november 2018 Godkjent av Studieplanutvalget medisin: 04.12.18 Omfang: 5 uker Faglig innhold Delemnet introduserer studenten
Immunsystemet Immunterapien og dens ulike former Kreftsykdommer som behandles Bivirkninger av immunterapi Laboratorieanalyser nå og i fremtiden
 AGENDA Immunsystemet Immunterapien og dens ulike former Kreftsykdommer som behandles Bivirkninger av immunterapi Laboratorieanalyser nå og i fremtiden 1 IMMUNSYSTEMET Immunsystemet vårt er designet for
AGENDA Immunsystemet Immunterapien og dens ulike former Kreftsykdommer som behandles Bivirkninger av immunterapi Laboratorieanalyser nå og i fremtiden 1 IMMUNSYSTEMET Immunsystemet vårt er designet for
HIV / AIDS -infeksjon - behandling
 HIV / AIDS -infeksjon - behandling HIV / AIDS 1981 første gang anerkjent som distinkt sykdom Opprinnelig overført fra sjimpanse Viruset kan ha sirkulert fra 1915-1941 Trolig sirkulert blant populasjoner
HIV / AIDS -infeksjon - behandling HIV / AIDS 1981 første gang anerkjent som distinkt sykdom Opprinnelig overført fra sjimpanse Viruset kan ha sirkulert fra 1915-1941 Trolig sirkulert blant populasjoner
BCG - flytting av spedbarnsvaksinasjon - vaksinasjon av helsefagstudenter
 BCG - flytting av spedbarnsvaksinasjon - vaksinasjon av helsefagstudenter Synne Sandbu, overlege Avd. for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt Vaksinedagene 2014 2 Følger av at
BCG - flytting av spedbarnsvaksinasjon - vaksinasjon av helsefagstudenter Synne Sandbu, overlege Avd. for vaksine Divisjon for smittevern Nasjonalt folkehelseinstitutt Vaksinedagene 2014 2 Følger av at
Utvikling av kreftvaksiner
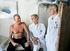 Utvikling av kreftvaksiner Gustav Gaudernack Dagens Medisin Arena Kreft og prioritering 10.04.13 Section for Immunology Dept. of Cancer Research Oslo University Hospital- Norwegian Radium Hospital Status
Utvikling av kreftvaksiner Gustav Gaudernack Dagens Medisin Arena Kreft og prioritering 10.04.13 Section for Immunology Dept. of Cancer Research Oslo University Hospital- Norwegian Radium Hospital Status
Får vi et vaksinasjonsprogram for voksne? Hanne Nøkleby Folkehelseinstituttet
 Får vi et vaksinasjonsprogram for voksne? Hanne Nøkleby Folkehelseinstituttet Oppdrag fra Helse- og omsorgsdepartementet: Utrede opprettelsen av et vaksinasjonsprogram for voksne tilsvarende barnevaksinasjonsprogrammet
Får vi et vaksinasjonsprogram for voksne? Hanne Nøkleby Folkehelseinstituttet Oppdrag fra Helse- og omsorgsdepartementet: Utrede opprettelsen av et vaksinasjonsprogram for voksne tilsvarende barnevaksinasjonsprogrammet
Myelomatose. Aymen Bushra0Ahmed.0MD.0PhD Seksjonsoverlege: Hematologisk0seksjon Haukeland0Universitetssykehus. Onsdag
 Myelomatose Aymen Bushra0Ahmed.0MD.0PhD Seksjonsoverlege: Hematologisk0seksjon Haukeland0Universitetssykehus Onsdag005.11.18 Hva er kreft og hvorfor/hvordan oppstår kreft? Hva er benmargen Hva er myelomatose
Myelomatose Aymen Bushra0Ahmed.0MD.0PhD Seksjonsoverlege: Hematologisk0seksjon Haukeland0Universitetssykehus Onsdag005.11.18 Hva er kreft og hvorfor/hvordan oppstår kreft? Hva er benmargen Hva er myelomatose
Vaksinasjon av utsatte grupper: - Flyktninger og asylsøkere - Personer med (medfødt) immunsvikt. Hanne Nøkleby Folkehelseinstituttet
 Vaksinasjon av utsatte grupper: - Flyktninger og asylsøkere - Personer med (medfødt) immunsvikt Hanne Nøkleby Folkehelseinstituttet Hensikt med å vaksinere flyktninger og asylsøkere Hindre utbrudd i mottak
Vaksinasjon av utsatte grupper: - Flyktninger og asylsøkere - Personer med (medfødt) immunsvikt Hanne Nøkleby Folkehelseinstituttet Hensikt med å vaksinere flyktninger og asylsøkere Hindre utbrudd i mottak
Diagnostikk og oppfølging av cøliakipasienter klinikers og patologs perspektiv
 Diagnostikk og oppfølging av cøliakipasienter klinikers og patologs perspektiv Knut E. A. Lundin, Medisinsk klinikk Inger Nina Farstad, Patologiklinikken Hva er cøliaki? Normal proksimal tynntarm (Marsh
Diagnostikk og oppfølging av cøliakipasienter klinikers og patologs perspektiv Knut E. A. Lundin, Medisinsk klinikk Inger Nina Farstad, Patologiklinikken Hva er cøliaki? Normal proksimal tynntarm (Marsh
Vaksinasjon noen oppdateringer. Hanne Nøkleby Folkehelseinstituttet 15. September 2015
 Vaksinasjon noen oppdateringer Hanne Nøkleby Folkehelseinstituttet 15. September 2015 Utvalgte temaer Influensa Meningokokker Rotavirus Meslinger Hepatitt B Influensavaksine en barnevaksine? Sykeligheten
Vaksinasjon noen oppdateringer Hanne Nøkleby Folkehelseinstituttet 15. September 2015 Utvalgte temaer Influensa Meningokokker Rotavirus Meslinger Hepatitt B Influensavaksine en barnevaksine? Sykeligheten
Om HPV-vaksinen i barnevaksinasjonsprogrammet
 Bokmål 2016 Vaksine for forebygging av livmorhalskreft tilbud til jenter i 7. klasse Informasjon til barn og foreldre Om HPV-vaksinen i barnevaksinasjonsprogrammet 1 Vaksine mot humant papillomavirus (HPV)
Bokmål 2016 Vaksine for forebygging av livmorhalskreft tilbud til jenter i 7. klasse Informasjon til barn og foreldre Om HPV-vaksinen i barnevaksinasjonsprogrammet 1 Vaksine mot humant papillomavirus (HPV)
Nytt om influensavaksiner. Hanne Nøkleby, Nasjonalt folkehelseinstitutt
 Nytt om influensavaksiner Hanne Nøkleby, Nasjonalt folkehelseinstitutt Nytt på influensavaksinefronten Erfaring med levende, nasal vaksine Influensavaksiner med adjuvans Helt nye influensavaksiner Levende,
Nytt om influensavaksiner Hanne Nøkleby, Nasjonalt folkehelseinstitutt Nytt på influensavaksinefronten Erfaring med levende, nasal vaksine Influensavaksiner med adjuvans Helt nye influensavaksiner Levende,
Vaksinasjonsprogrammet for HPV og oppfølgingsprogrammet HPVnorvaks. Hanne Nøkleby, Nasjonalt folkehelseinstitutt
 Vaksinasjonsprogrammet for HPV og oppfølgingsprogrammet HPVnorvaks Hanne Nøkleby, Nasjonalt folkehelseinstitutt HPV-humant papillomavirus Mer enn 120 kjente typer 30-40 affiserer slimhinner De fleste ufarlige,
Vaksinasjonsprogrammet for HPV og oppfølgingsprogrammet HPVnorvaks Hanne Nøkleby, Nasjonalt folkehelseinstitutt HPV-humant papillomavirus Mer enn 120 kjente typer 30-40 affiserer slimhinner De fleste ufarlige,
Innføring av hepatitt B-vaksine i barnevaksinasjonsprogrammet. Forslag til endringer i forskrift om nasjonalt vaksinasjonsprogram
 Helse- og omsorgsdepartementet Innføring av hepatitt B-vaksine i barnevaksinasjonsprogrammet Forslag til endringer i forskrift om nasjonalt vaksinasjonsprogram Høringsfrist: 17. april 2015 Innhold 1. Innledning...
Helse- og omsorgsdepartementet Innføring av hepatitt B-vaksine i barnevaksinasjonsprogrammet Forslag til endringer i forskrift om nasjonalt vaksinasjonsprogram Høringsfrist: 17. april 2015 Innhold 1. Innledning...
Juridiske rammer for Vaksinasjonsprogram i Norge
 Juridiske rammer for Vaksinasjonsprogram i Norge Møte i Faglig referansegruppe for nasjonale vaksinasjonsprogram 21.05.2019 Ellen Furuseth, overlege ved avdeling for vaksineforebyggbare sykdommer, FHI
Juridiske rammer for Vaksinasjonsprogram i Norge Møte i Faglig referansegruppe for nasjonale vaksinasjonsprogram 21.05.2019 Ellen Furuseth, overlege ved avdeling for vaksineforebyggbare sykdommer, FHI
HPV-vaksine - hvordan går det? Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt
 HPV-vaksine - hvordan går det? Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt HPV-vaksine i vaksinasjonsprogrammet HPV-vaksine ble inkludert i barnevaksinasjonsprogrammet fra høsten 2009
HPV-vaksine - hvordan går det? Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt HPV-vaksine i vaksinasjonsprogrammet HPV-vaksine ble inkludert i barnevaksinasjonsprogrammet fra høsten 2009
Bioteknologi i dag muligheter for fremtiden
 Bioteknologi i dag muligheter for fremtiden Arvestoff Genetisk materiale, DNA. Baser En del av et nukleotid som betegnes med bokstavene A, C, G og T. Med disse fire bokstavene skriver DNAtrådene sine beskjeder
Bioteknologi i dag muligheter for fremtiden Arvestoff Genetisk materiale, DNA. Baser En del av et nukleotid som betegnes med bokstavene A, C, G og T. Med disse fire bokstavene skriver DNAtrådene sine beskjeder
Forekomst og forebygging av kikhoste hos barn under 1 år
 Forekomst og forebygging av kikhoste hos barn under 1 år Margrethe Greve-Isdahl Overlege, Avdeling for Vaksine Divisjon for Smittevern Nasjonalt Folkehelseinstitutt Bakgrunn Flere industrialiserte land
Forekomst og forebygging av kikhoste hos barn under 1 år Margrethe Greve-Isdahl Overlege, Avdeling for Vaksine Divisjon for Smittevern Nasjonalt Folkehelseinstitutt Bakgrunn Flere industrialiserte land
Urinsyrekrystaller som adjuvans i fiskevaksiner
 Norges fiskerihøgskole Urinsyrekrystaller som adjuvans i fiskevaksiner Bjarte Langhelle Masteroppgave i fiskehelse (60 stp) Desember 2013 Forord Forord Denne oppgaven ble utført ved Norges fiskerihøgskole,
Norges fiskerihøgskole Urinsyrekrystaller som adjuvans i fiskevaksiner Bjarte Langhelle Masteroppgave i fiskehelse (60 stp) Desember 2013 Forord Forord Denne oppgaven ble utført ved Norges fiskerihøgskole,
Om HPV-vaksinen i barnevaksinasjonsprogrammet
 Bokmål Vaksine for forebygging av livmorhalskreft tilbud til jenter i 7. klasse Informasjon til barn og foreldre Om HPV-vaksinen i barnevaksinasjonsprogrammet 1 Fra høsten 2009 får alle jenter i 7. klasse
Bokmål Vaksine for forebygging av livmorhalskreft tilbud til jenter i 7. klasse Informasjon til barn og foreldre Om HPV-vaksinen i barnevaksinasjonsprogrammet 1 Fra høsten 2009 får alle jenter i 7. klasse
Malariavaksine. Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015
 Malariavaksine Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015 Malaria - forekomst Ca. 40 % av verdens befolkning bor i malariaområder Forekomst i 2013: Ca. 200 millioner tilfeller Ca. 600 000 dødsfall,
Malariavaksine Hanne Nøkleby Folkehelseinstituttet Vaksinedagene 2015 Malaria - forekomst Ca. 40 % av verdens befolkning bor i malariaområder Forekomst i 2013: Ca. 200 millioner tilfeller Ca. 600 000 dødsfall,
Immunologiens dag 29. april 2010 Vaksinasjon Norsk Selskap for Immunologi www.norwegianimmunology.org
 Immunologiens dag 29. april 2010 Vaksinasjon Norsk Selskap for Immunologi www.norwegianimmunology.org Forsidebildet er hentet fra: Arbeiderbevegelsens arkiv Immunologiens dag: Vaksinasjon Populærvitenskapelig
Immunologiens dag 29. april 2010 Vaksinasjon Norsk Selskap for Immunologi www.norwegianimmunology.org Forsidebildet er hentet fra: Arbeiderbevegelsens arkiv Immunologiens dag: Vaksinasjon Populærvitenskapelig
TUBERKULOSE OG FORHÅNDSREGLER FOREBYGGING VED VAKSINASJON. Marianne Breunig Fornes Smitteverndag 2019, Haugesund Kommune
 TUBERKULOSE OG FORHÅNDSREGLER FOREBYGGING VED VAKSINASJON Marianne Breunig Fornes Smitteverndag 2019, Haugesund Kommune Gyiiiiiii AGENDA Tuberkulose - Forekomst og kontroll VAKSINASJON - Generelt - Yrkesvaksinasjon
TUBERKULOSE OG FORHÅNDSREGLER FOREBYGGING VED VAKSINASJON Marianne Breunig Fornes Smitteverndag 2019, Haugesund Kommune Gyiiiiiii AGENDA Tuberkulose - Forekomst og kontroll VAKSINASJON - Generelt - Yrkesvaksinasjon
Vaksine mot kre/ Thea Eline Hetland, lege, PhD student, Avd. For Gynekologisk kre/, Radiumhospitalet
 Vaksine mot kre/ Thea Eline Hetland, lege, PhD student, Avd. For Gynekologisk kre/, Radiumhospitalet ca 200 ulike krebsykdommer Hva er kre/? Mange likehetstrekk Mye som skiller dem fra hverandre Ca 27
Vaksine mot kre/ Thea Eline Hetland, lege, PhD student, Avd. For Gynekologisk kre/, Radiumhospitalet ca 200 ulike krebsykdommer Hva er kre/? Mange likehetstrekk Mye som skiller dem fra hverandre Ca 27
HPV-vaksine: Endringer i barnevaksinasjonsprogrammet. Margrethe Greve-Isdahl Overlege Avdeling for vaksineforebyggbare sykdommer
 HPV-vaksine: Endringer i barnevaksinasjonsprogrammet Margrethe Greve-Isdahl Overlege Avdeling for vaksineforebyggbare sykdommer Endringer i barnevaksinasjonsprogrammet 1. Vaksinetype endres fra Gardasil
HPV-vaksine: Endringer i barnevaksinasjonsprogrammet Margrethe Greve-Isdahl Overlege Avdeling for vaksineforebyggbare sykdommer Endringer i barnevaksinasjonsprogrammet 1. Vaksinetype endres fra Gardasil
Influensavaksiner - fra produksjon til injeksjon
 Influensavaksiner - fra produksjon til injeksjon Kine Willbergh og Hilde Bakke Avdeling for vaksine Vaksinedagene 7.-8. september 2006 1 Disposisjon Influensavaksiner, ulike typer» Levende, svekket vaksine
Influensavaksiner - fra produksjon til injeksjon Kine Willbergh og Hilde Bakke Avdeling for vaksine Vaksinedagene 7.-8. september 2006 1 Disposisjon Influensavaksiner, ulike typer» Levende, svekket vaksine
Essayoppgaver termin 1C-1D 2010 Utsatt eksamen. Oppgave 1 (10 poeng) Morfologi Jostein Halgunset
 Essayoppgaver termin 1C-1D 2010 Utsatt eksamen Morfologi Jostein Halgunset Oppgave 1 (10 poeng) En 52 år gammel kvinne, som to år tidligere var operert for brystkreft med påfølgende cellegiftbehandling,
Essayoppgaver termin 1C-1D 2010 Utsatt eksamen Morfologi Jostein Halgunset Oppgave 1 (10 poeng) En 52 år gammel kvinne, som to år tidligere var operert for brystkreft med påfølgende cellegiftbehandling,
Hvor farlig er det å puste inn bioaerosoler?
 Hvor farlig er det å puste inn bioaerosoler? Symptomer og sykdom ved eksponering for bioaerosoler Helse effekter Infeksjon Patogener Toksiske effekter Mykotoksiner Inflammasjon Uspesifikt medfødt immunforsvar
Hvor farlig er det å puste inn bioaerosoler? Symptomer og sykdom ved eksponering for bioaerosoler Helse effekter Infeksjon Patogener Toksiske effekter Mykotoksiner Inflammasjon Uspesifikt medfødt immunforsvar
Tone Fredsvik Gregers. Alt du må vite om vaksiner
 Tone Fredsvik Gregers Alt du må vite om vaksiner HUMANIST FORLAG 2016 Humanist forlag 2016 Omslag: Lilo design Tilrettelagt for ebok av eboknorden as ISBN: 978-82-8282-128-5 (epub) ISBN: 978-82-8282-127-8
Tone Fredsvik Gregers Alt du må vite om vaksiner HUMANIST FORLAG 2016 Humanist forlag 2016 Omslag: Lilo design Tilrettelagt for ebok av eboknorden as ISBN: 978-82-8282-128-5 (epub) ISBN: 978-82-8282-127-8
