Glykosylering er nødvendig for internalisering og prosessering av prolegumain
|
|
|
- Ingunn Helland
- 7 år siden
- Visninger:
Transkript
1 Glykosylering er nødvendig for internalisering og prosessering av prolegumain Kan modent legumain tas opp i levende humane celler? Kristina Broe Bodin Larsen Mastergradsoppgave i farmasi Seksjon for farmasøytisk biovitenskap Farmasøytisk institutt Det matematisk-naturvitenskapelige fakultet UNIVERSITETET I OSLO Mai 2016
2 II
3 Glykosylering er nødvendig for internalisering og prosessering av prolegumain Kan modent legumain tas opp i levende humane celler? Kristina Broe Bodin Larsen Mastergradsoppgave i farmasi Veiledere: Professor Rigmor Solberg Professor Harald Thidemann Johansen Doktorgradsstipendiat Ngoc Nguyen Lunde III
4 Kristina Broe Bodin Larsen 2016 Glykosylering er nødvendig for internalisering og prosessering av prolegumain Kan modent legumain tas opp i levende humane celler? Kristina Broe Bodin Larsen Trykk: Reprosentralen, Universitetet i Oslo IV
5 Forord Den foreliggende masteroppgaven ble utført i perioden august 2015 til mai 2016, ved Seksjon for farmasøytisk biovitenskap, ved Farmasøytisk institutt, Universitetet i Oslo. Først av alt vil jeg takke mine hovedveiledere, professorene Rigmor Solberg og Harald Thidemann Johansen, som har gitt meg muligheten til å jobbe i forskningsgruppen ProTarg. Takk for all kunnskapsrik veiledning, oppfølging, rådgivning og inspirasjon gjennom hele masteroppgaven! Takk for at dere hele tiden har vært tilgjengelige for å svare på spørsmålene mine. Jeg vil rette en stor takk til veileder og doktorgradsstipendiat Ngoc Nguyen Lunde! Takk for god veiledning, all opplæring i laboratoriearbeidet og spennende diskusjoner som har vært avgjørende for gjennomføringen av denne oppgaven. Tusen takk for din tilgjengelighet og rådgivning! I tillegg vil jeg rette en takk til overingeniør Hilde Nilsen for god veiledning i laboratoriearbeidet og hyggelige samtaler! Jeg vil også takke alle på masterkontoret for et hyggelig år og mange fine stunder, spesielt takk til masterstudentene Mathias og Nuriddin. Jeg ønsker å takke for muligheten jeg fikk til å presentere deler av den foreliggende masteroppgaven ved Norsk Selskap for Farmakologi og Toksikologi (NSFT) Vintermøte Jeg er spesielt takknemlig for all støtte fra familien min, gjennom hele farmasistudiet! Til slutt vil jeg takke min samboer, Alexander, for all støtte og oppmuntring! Kristina Broe Bodin Larsen Oslo, mai 2016 V
6 VI
7 Sammendrag Cysteinproteasen legumain er en asparaginyl endopeptidase som er overuttrykt i flere humane maligne svulster, blant annet tykktarm-, bryst- og prostatakreft, samt i assosierte endotelceller og tumorassosierte makrofager (TAMs). Det er kjent at proformen av legumain (prolegumain, 56 kda) sekreres til tumormikromiljøet av kreftceller og TAMs. Både legumain og den mest potente endogene inhibitor cystatin E/M (14/17 kda) er normalt glykosylerte. Det er fremdeles uklart hvilken rolle glykosyleringen av legumain og cystatin E/M har i forhold til aktivitet, prosessering og transport. Oppregulering av legumain i kreftsammenheng er assosiert med metastasering, invasivitet og dårlig prognose, og legumain kan derfor være et lovende målmolekyl i utviklingen av nye spesifikke legemidler i kreftterapi. Forskningsgruppen vår har tidligere vist at prolegumain internaliseres i levende celler for deretter å prosesseres og aktiveres til moden form (36 kda), i tillegg til at cystatin E/M også kan internaliseres og deretter hemme legumain. Det er vist at N-bundet glykosylering spiller en viktig rolle både for transport og prosessering av legumain. Det er nylig beskrevet utviklingen og opptak av nye selektive biotinylerte legumainprober (inhibitorer), som kan detekteres etter internalisering og binding til legumain i levende celler. I denne studien ble viktigheten av glykosylering av både prolegumain og cystatin E/M i forhold til cellulært opptak studert, samt opptak av modent legumain alene og bundet til selektiv probe. Til studien ble det anvendt flere cellelinjer: én transformert adherent embryonal nyreepitelcellelinje (HEK293), to monoklonale transfekterte HEK293-cellelinjer (M38L, overuttrykker legumain; M4C, overuttrykker cystatin E/M) og to kolorektalkreftcellelinjer (HCT116 og SW620). Uglykosylerte proteiner ble dannet ved at cellene ble eksponert for tunikamycin, en hemmer av N-bundet glykosylering. Internaliseringsmekanismen ble studert med Dyngo-4a, en hemmer av klatrinmediert endocytose. Internalisering av modent legumain ble studert både med og uten binding til de legumainselektive probene MP-L01 og L03 og detektert etter etablering av Odyssey CLx Near-Infrared Imaging System. I denne studien vises helt nye funn for betydningen av glykosylering for cellulært opptak av legumain og cystatin E/M. Fullstendig uglykosylert prolegumain (47 kda) ble ikke internalisert, og glykosylering var nødvendig både for internalisering, prosessering og aktivering av prolegumain. Internalisering av cystatin E/M var derimot uavhengig av glykosylering. Det ble for første gang demonstrert at et kompleks av probe og legumain ble VII
8 tatt opp cellulært og detektert. Endocytosehemmeren Dyngo-4a inhiberte ikke internalisering av prolegumain eller kompleks av modent legumain bundet til probe, men reduserte opptaket av fri probe og hemmet prosesseringen av internalisert prolegumain. VIII
9 Abstract The cysteine protease legumain, an asparaginyl endopeptidase, is over-expressed in a number of human malignant tumors, including colorectal, breast and prostate cancer, as well as in associated endothelial cells and tumor-associated macrophages (TAMs). It is known that the proform of legumain (prolegumain, 56 kda) is secreted to the tumor microenvironment by cancer cells and TAMs. Both legumain and its most potent endogenous inhibitor cystatin E/M (14/17 kda) are endogenously glycosylated. It is still unknown the importance of glycosylation of legumain and cystatin E/M for activity, processing and transport. Legumain over-expression in cancer is associated with enhanced metastasis, invasiveness and poor prognosis, and legumain might be a promising target in the development of new specific drugs in cancer therapy. Our research group has previously shown that prolegumain is internalized by living cells, processed and activated to the mature form (36 kda), and that cystatin E/M also can be internalized and then inhibit legumain activity. It has been shown that N-linked glycosylation plays an important role for legumain transport and processing. It has recently been described the development and internalization of new selective biotinylated legumain probes (inhibitors), which are detected after internalization and binding to legumain in living cells. In this study, the importance of glycosylation for internalization of both prolegumain and cystatin E/M were studied. In addition, internalization of mature legumain alone and bound to selective probe were investigated. In this study several cell lines were used: one transformed adherent embryonic kidney cell line (HEK293), two monoclonal transfected HEK293-cell lines (M38L, legumain overexpressing; M4C, cystatin E/M over-expressing) and two colorectal cancer cell lines (HCT116 and SW620). Unglycosylated proteins were produced by treating cells with tunicamycin, an N-linked glycosylation inhibitor. The mechanism for internalization was investigated using Dyngo-4a, a clathrin-mediated endocytosis inhibitor. Internalization of mature legumain was studied with or without binding to two selective probes, MP-L01 and L03, and detected after establishment of Odyssey CLx Near-Infrared Imaging System. In this study new discoveries to the importance of glycosylation for cellular uptake of legumain and cystatin E/M are shown. Completely unglycosylated prolegumain (47 kda) was not internalized, and glycosylation was shown to be necessary for internalization, processing IX
10 and activation of prolegumain. However, internalization of cystatin E/M was independent of the glycosylation status. For the first time, it was demonstrated that a complex of probe and legumain was internalized and detected in living cells. Furthermore, the endocytosis inhibitor Dyngo-4a did not inhibit internalization of prolegumain or a complex of probe and legumain. However, Dyngo-4a reduced uptake of free probe and inhibited processing of internalized prolegumain. X
11 Innholdsfortegnelse Forord... V Sammendrag... VII Abstract... IX Innholdsfortegnelse... XI Forkortelsesliste... XV 1 Introduksjon Proteaser Legumain Legumainformer Syntese og transport av legumain Dyngo-4a, en dynamininhibitor Glykosylering av proteiner N-bundet glykosylering Legumain og N-bundet glykosylering Inhibering av N-bundet glykosylering med tunikamycin Proteaser og kreftutvikling Legumain og kreft Syntetiske legumainprober Mål med oppgaven Materialer og metoder Kjemikalier og reagenser Utstyrsliste Celledyrking HCT116-celler SW620-celler HEK293-celler M38L-celler M4C-celler Tining og utsåing av celler Splitting og dyrking av celler Telling og utsåing av celler XI
12 3.3.9 Produksjon av kondisjonert medium Eksponering av celler med legumain Eksponering av celler med legumain-selektive prober Eksponering av celler med legumain-probe-kompleks Eksponering av celler med endocytosehemmeren Dyngo-4a Høsting av celler og kondisjonert medium Fjerning av tunikamycin fra kondisjonert medium Totalproteinmåling Legumainaktivitetsmåling Gelelektroforese og immunoblotting Opparbeidelse av gelelektroforeseprøver Acetonfelling av proteiner Gelkjøring og immunoblotting ELISA Statistiske analyser Resultater Internalisering og funksjon av uglykosylert versus glykosylert legumain og cystatin E/M Fullstendig uglykosylert prolegumain blir ikke internalisert i HEK293-celler Endocytosehemmeren Dyngo-4a inhiberer prosessering og ikke opptak av prolegumain Både glykosylert og uglykosylert cystatin E/M blir internalisert i HCT116-celler Opptak og binding av legumainprober (-inhibitorer) til legumain i levende celler Proben MP-L03 tas opp og bindes til aktivt legumain i M38L-celler Legumain alene og i kompleks med proben MP-L01 internaliseres i HEK293- celler Internalisering av renset bovint legumain, MP-L01 og legumain-mp-l01- kompleks Dyngo-4a reduserer opptaket av MP-L01, men påvirker ikke internalisering av legumain Diskusjon Valg av cellemodeller Valg av tunikamycinkonsentrasjon og effekter XII
13 5.3 Glykosylering av legumain Internalisering og transport av glykosylert prolegumain Internalisering og transport av uglykosylert prolegumain Internalisering av cystatin E/M og effekt av glykosylering Legumain og endocytose Valg av endocytoseinhibitor Effekter av endocytoseinhibitoren Dyngo-4a Bruk av legumainprobe Legumainform på 25 kda Konklusjon Litteraturliste Vedlegg A: Oppskrifter for løsninger Vedlegg B: Resultater Vedlegg C: Poster presentert på Norsk Selskap for Farmakologi og Toksikologi (NSFT) Vintermøte XIII
14 XIV
15 Forkortelsesliste AEP: Asparaginylendopeptidase AP: Aktiveringspeptid Asn: Asparagin Asp: Aspartat CL: Cellelysat cm 2 : Kvadratcentimeter dh2o: Destillert vann DMEM: Dulbecco s Modified Eagle Medium DMSO: Dimetylsulfoksid DTT: Ditiotreitol EDTA: Etylendiamintetraacetat ER: Endoplasmatisk retikulum FBS: Føtalt kalveserum G: Glykosylert G418: Geneticin GAGs: Glukosaminoglykaner GlcNAc: N-acetylglukosamin GTP-ase: Guanosintrifosfathydrolaser HEK293: Human embryonic kidney 293 cells HRP: Pepperrotperoksydase, horseradish peroxidase kda: Kilodalton Ki: Inhibisjonskonstant KM: Kondisjonert medium XV
16 LSAM: Legumainaktivitetstabiliserende-domene M6F: Mannose-6-fosfat M6FR: Mannose-6-fosfat-reseptor NaCl: Natriumklorid NaOH: Natriumhydroksid nm: Nanometer nm: Nanomolar PBS: Fosfatbufret saltvann rer: rough endoplasmatisk retikulum RhProlegumain: Rekombinant humant prolegumain SDS: Natriumdodekylsulfat TAMs: Tumorassosierte makrofager TBS: Trisbufret saltvann UG: Uglykosylert UG*: Uglykosylert inneholdende tunikamycin UPR: Ufoldet proteinrespons V-ATP-ase: Vakulær H +- ATP-ase µm: Mikromolar Z-Ala-Ala-Asn-AMC: Benzyloksykarbonyl-alanin-alanin-asparagin-7-amino-4-metylkumarin XVI
17 1 Introduksjon 1.1 Proteaser Proteaser er kjent som proteolytiske enzymer, men ny litteratur har vist at enzymene i tillegg til å være proteolytiske også er viktige som signalmolekyler involvert i flere vitale prosesser [1]. En uforventet endring eller ubalanse i denne reguleringen kan medføre patologiske konsekvenser, slik som inflammasjon, kreft, kardiovaskulære- og nevrodegenerative sykdommer [1-3]. Proteaser har evner til å bryte ned proteiner og peptider ved spaltning av peptidbindinger, men det er store forskjeller i de proteolytiske enzymene [4]. Enzymene varierer blant annet i størrelse, struktur, spesifisitet, lokalisering og ph-avhengighet. Eksempelvis er serinproteasen faktor Xa i koagulasjonskaskaden selektive, mens cysteinproteaser er mindre selektive [2]. De ulike proteasene er klassifisert i databasen MEROPS etter proteasenes proteolytiske mekanismer [5]. Databasen har klassifisert proteasene inn i seks spesifikke klasser; aspartat-, cystein-, metallo-, serin-, glutamat- og treoninproteaser. Basert på proteasenes tredimensjonale struktur deles klassene deretter inn i klaner, som igjen deles inn i familier. Proteaser i samme familie har likheter i sine aminosyresekvenser, som antas å skyldes likt evolusjonært utgangspunkt [4-7]. Proteaser kalles også peptidaser. Avhengig av peptidasenes posisjon for spaltning i polypeptidkjeden deles de videre inn i eksopeptidaser og endopeptidaser. Eksopeptidaser spalter polypeptidkjeden i endene, enten fra N- eller C-terminale enden (N; aminopeptidase og C; karboksypeptidase) og endopeptidaser spalter inne i polypeptidkjeden [1]. En av de største proteaseklassene er gruppen cysteinproteasene. Cysteinproteasene deles inn i klaner; eksempelvis CA og CD, for deretter å deles inn i familier etter molekylstrukturen [7, 8]. I pattedyr er det fire godt studerte familier (C1, C2, C13 og C14) av cysteinproteasene. Til klan CA tilhører familiene C1 (cathepsin B, F, H, K, L, O, S, V, W og X) og C2 (calpainer), mens i klan CD tilhører familiene C13 (legumain) og C14 (caspaser) (Figur 1.1) [4]. 1
18 Figur 1.1. Klassifisering av mammalske proteaser ifølge MEROPS. Mammalske proteaser klassifiseres etter katalytiske mekanismer og strukturlikheter. Den første inndelingen i klasser baseres på deres katalytiske type; aspartat-, cystein-, metallo-, serin-, glutamat- og treoninproteaser. Deretter blir klassene delt inn i klaner, på bakgrunn av tredimensjonal proteinstruktur eller av aminosyrerekkefølgen i det katalytiske området til proteasen. Klanene deles inn i én eller flere familier etter likheter i aminosyresekvensen. Figuren er modifisert fra Rawlings et al [4]. Papainfamilien (C1) er den største blant familiene og består hovedsakelig av lysosomale enzymer. Enzymene er viktige i proteolyse i det lysosomale/endosomale systemet. Familiene calpain (C2) og caspase (C14) befinner seg i den cytosoliske delen av cellen. Legumainfamilien (C13) er hovedsakelig funnet i sene endosomer og lysosomer der det sure miljøet er viktig for den proteolytiske aktiviteten til enzymet [8]. 1.2 Legumain Proteasen legumain er en asparaginylendopeptidase (AEP) som tilhører cysteinproteasefamilien C13 i klan CD (Figur 1.1) [7]. Legumain er strukturelt beslektet med caspasene (C14), de bakterielle proteasene clostripain (C11) og gingipain (C25) fra de patogene bakteriene Clostridium histolyticum og Porphyromonas gingivali [9, 10]. Proteasen er ikke beslektet med de kjente cysteinproteasene fra C1-papainfamilien, slik som cathepsinene B, H, L og S [8]. 2
19 Legumain ble først identifisert i spirende nyrebønner, hvor proteasen bidrar til prosessering og modning av frølagringsproteiner [11, 12]. Aminosyresekvensen til proteasen viste seg å være homolog med et enzym identifisert i parasitten Schistosoma mansoni [13], som senere viste seg å ha AEP-aktivitet [14]. Proteasen ble identifisert i pattedyr og Chen et al. (1997) lykkes med å sekvensere og klone humant legumain [8]. Genet for legumain (LGMN) er lokalisert på kromosom 14q32.1, og proteinet består av 433 aminosyrer [8, 15]. Aktivitet og stabilitet av legumain har vist seg å være ph-avhengig, der legumain har phoptimum rundt ph 6 og blir ustabil ved høyere ph [8]. Den aktive formen av legumain viser høy substratspesifisitet for hydrolyse av peptidbindinger karboksyterminalt av aminosyren asparagin (Asn) i P1-posisjon, som er unikt blant proteaser [8, 16]. Det er kjent fra litteraturen at proteasen også kan spalte peptidbindinger etter aminosyren aspartat (Asp) ved ph 4, som likner egenskapene til caspasene [16-18]. I dag er det kjent at legumain er høyt uttrykt i nyrer, testikler og placenta, men proteasen er også sett til stede i de fleste vev [8]. Proteasen er hovedsakelig lokalisert i sene endosomer og lysosomer da sur ph er nødvendig for legumainaktivering [16]. Derimot er det også sett at legumain uttrykkes intracellulært, men sekreres og er aktiv ekstracellulært hvor den stabiliseres ved binding til integriner på celleoverflaten [19], samt i cytoplasma og i cellekjernen [18, 20]. Det er beskrevet i litteraturen at legumain prosesserer andre proteaser, slik som cathepsin B, H og L [21]. Legumain skiller seg ut fra C1- og C2-familiene av cysteinproteaser, da den ikke inhiberes av cysteinproteaseinhibitoren E-64 [8]. Aktiviteten til legumain bestemmes av endogene inhibitorer, hvor cystatin E/M er den mest potente (Ki = 0,0016 nm). Cystatin E/M er et sekretorisk protein og omtales som en potensiell tumorrepressor [22, 23]. Andre inhibitorer som påvirker aktiviteten til legumain, er cystatin C (Ki = 0,20 nm) og cystatin F (Ki = 10 nm) [23, 24] Legumainformer Mammalsk legumain uttrykkes som inaktiv proform, kalt prolegumain, med molekylvektstørrelse på 56 kda. Prolegumain inneholder et N-terminalt propeptid (Val 18 - Asp 25 ), et katalytisk domene (Gly 26 -Lys 289 ), et C-terminalt prodomene som består av et aktiveringspeptid (AP, Lys 287 -Asn 323 ), samt et legumainstabiliserings- og 3
20 aktivitetsmodulerende domene (LSAM, Asp 324 -Tyr 433 ), som stabiliserer det katalytiske domenet grunnet elektrostatiske interaksjoner ved nøytral ph (figur 1.2) [16, 19]. Det er kjent fra litteraturen at prolegumain foreligger som en homodimer, som er inaktiv da prolegumain har et cap -domene (LSAM) som dekker over det aktive setet [25]. Figur 1.2. Krystallstruktur av prolegumain. Illustrasjon av tre domener i prolegumain. Et legumainstabiliserings- og aktivitetsmodulerende domene (LSAM; beige), aktiveringspeptid (Lys 287 -Asn 323 ; blått) og et katalytisk domene med et aktivt sete (grønt, C189). For å oppnå fullstendig legumainaktivitet kreves spaltning av Lys-Arg-Lys 289 (α-sete; KRK 289 ) og Asn-Asp 324 (β-sete; ND 324 ). Det katalytiske cysteinet er skjermet av LSAM. Figuren er modifisert fra Dall et al [19]. I det sure miljøet i lysosomene blir prolegumain autoprosessert til en 47 kda inaktiv og en 46 kda aktiv intermediær form [9, 26] (Figur 1.3). Den inaktive intermediære formen dannes når ph er under 5,5 og medfører spaltning av det C-terminale propeptidet ved Asn 323 (Figur 1.3). Ved lavere ph (4,5) blir enzymet videre spaltet ved Asp 25 (ved N-terminal ende) til den aktive intermediære formen. Studier av legumains krystallstruktur viste at det bare er spaltning ved Asn 323 som er nødvendig for å oppnå fullstendig aktivt legumain, men ved ph over 4,5 vil LSAM-domenet fremdeles være bundet til det katalytiske domenet ved elektrostatiske interaksjoner, og den intermediære formen forblir inaktiv [19]. Studier av den intermediære modningsprosessen har vist å være reversibel og ph-avhengig, og trolig ikke avhengig av 4
21 spaltning ved Asp 25 [25]. Legumain kan videre bli prosessert til en aktiv moden monomer form på 36 kda, men dette trinnet er ikke autokatalytisk, men er avhengig av andre ukjente lysosomale proteaser [9, 25]. Figur 1.3. Prosessering av legumain. Inaktiv prolegumain (56 kda) syntetiseres ved nøytral ph 7.0. Prolegumain autoaktiveres til inaktiv intermediær form (47 kda) ved spaltning av Asn 323 (N) (ph 5.5) og videre til aktiv intermediær form (46 kda) ved spaltning av Asp 303/309 (D) (ph 4.0) på den C-terminale enden, samt spaltning N-terminalt etter Asp 21 og Asp 25. Legumain omdannes til aktiv moden form (36 kda; Gly 26 (G) -KRK 289 ) ved spaltning ved KRK 289 av ukjente proteaser og får asparaginylendopeptidase-aktivitet (AEP). N-terminal spaltning er ikke nødvendig for legumainaktivitet. Figuren er modifisert fra Dall et al. (2016) [26]. Det er beskrevet i litteraturen at sekrert prolegumain kan autoaktiveres [23] og at glukosaminoglykaner (GAGs) akselererer autoaktiveringen av prolegumain, trolig grunnet elektrostatisk interferens med prodomenet, som videre medfører blottlegging av det katalytiske setet [27] Syntese og transport av legumain Legumain syntetiseres som et inaktivt proenzym (56 kda) i ribosomer på cytoplasmatisk side av rough endoplasmatisk retikulum (rer), før enzymet transporteres videre til Golgiapparatet. Prolegumain får hovedsakelig satt på et mannose-6-fosfatmotiv (mannose-fosfat- GlcNAc (N-acetylglukosamin)) på veien gjennom rer og cis-golgi-nettverket. I trans-golginettverket fjernes GlcNAc, slik at enzymet kan bindes til mannose-6-fosfat-reseptor. Deretter translokeres mannose-6-fosfat-reseptor-prolegumain inn til prelysosomale endosomvesikler, kalt Clathrin coated (klatrinmediert) vesikkel. Enzymet dissosierer fra mannose-6-fosfat- 5
22 reseptoren for deretter translokeres fra endosomer til lysosomer, der fosfat-merkingen fjernes [28]. Lysosomene er prolegumains hovedlokalisering, der proformen blir aktivert til moden aktiv form (36 kda) ved sur ph [19, 29]. Det er kjent i litteraturen at legumain også er funnet i cellekjernen, at enzymet sekreres og kan detekteres på celleoverflaten, men nøyaktig hvordan enzymet translokerer fra lysosomene, er ukjent [19, 23]. Smith et al. (2012) har vist at sekrert prolegumain fra andre celletyper kan tas opp, for deretter å aktiveres i celler som uttrykker lite legumain [23]. Det er ikke kjent hvilken endocytosemekanisme som finner sted for internaliseringen Dyngo-4a, en dynamininhibitor Dynamin er et GTP-ase-protein som er essensielt for membranfusjon ved klatrinmediert endocytose i eukaryotiske celler. Dynamin polymeriseres for å danne en heliks rundt halsen av en produserende vesikkel oppstått fra plasmamembranen. Heliksen avsnører halsen til den nye vesikkelen ved hjelp av flere mekanismer som medfører membranfusjon og dannelse av klatrinmediert vesikkel [30]. Den første kjente dynamininhibitoren er Dynasore [31]. Dyngo-4a er en strukturlik Dynasoreanalog som antas å ha tilsvarende egenskaper som Dynasore, men brukes oftere i forskning da den har høyere potens i dynamininhibering [32, 33]. Dynamininhibitorer hemmer raskt og reversibelt dynaminaktiviteten og dermed klatrinmediert endocytose [30, 31]. 1.3 Glykosylering av proteiner Generelle post-translasjonelle modifikasjoner av proteiner inkluderer blant annet påsetting av karbohydrat- (glykosylering) og fosfatgrupper (fosforylering) i rer, hvor disse endringene på proenzymer sees som viktige for stabilitet og korrekt transport [28]. Det er beskrevet i litteraturen at legumain har 15 potensielle fosforyleringsseter [34], og det er vist at fosforyleringen tilsynelatende ikke er viktig for prosessering og aktivering [35]. Proteinglykosylering utføres ved at oligosakkaridenheter bindes kovalent til polypeptider, fem glykosyleringshovedtyper er kjent, der N- og O-koblet glykosylering er de vanligste typene [36]. 6
23 1.3.1 N-bundet glykosylering N-bundet proteinglykosylering starter i ER, modifiseres videre i Golgi-apparatet og sluttføres ved plasmamembranen, der proteinene enten sekreres eller inkorporeres i plasmamembranen [28]. En kompleks oligosakkaridstruktur (Glc3Man9GlcNAc2-PP-dolichol) med totalt 14 sukkermolekyler bindes til aminosyren asparagin (Asn) i målproteinet i lumen av rer [37]. For at N-glykosylering skal finne sted ved Asn-aminosyren på proteinet, kreves det en bestemt sekvens, Asn-X-S/T, hvor X svarer til en uspesifikk aminosyre (unntatt prolin), samt S og T er henholdsvis aminosyrene serin eller treonin. Det utføres flere modifikasjoner av den komplekse oligosakkaridstrukturen i ER og i Golgi-apparatet [37, 38]. I Golgi-apparatet er sluttproduktet i N-bundet glykosylering tre hovedtyper; høy-mannose, hybrid og kompleks (figur 1.4) [37, 38]. Figur 1.4. Hovedstrukturer av oligosakkarider ved N-bundet glykosylering. Figuren er modifiser fra Shandala et al. (2001) [37]. Sluttproduktet i N-bundet glykosylering kan videre modifiseres i Golgi-apparatet slik at glykosylerte proteiner sendes til lysosomer. Eksempelvis kan hovedtypen høy-mannose få et mannose-6-fosfat-motiv påkoblet i cis-golgi-nettverket [37]. I trans-golgi-nettverket blir dette spesifikke motivet gjenkjent av mannose-6-fosfat-reseptor som binder og sender proteinene til endo-lysosomene (figur 1.5) [37]. 7
24 Figur 1.5. N-bundet glykosylering av proteiner transportert til lysosomer. Prosessen er avhengig av spesifikke enzymer (ikke vist). Svarte firkanter representerer N-acetylglukosamin-oligosakkaridenheter, oransje ovalstrukturer representerer mannose-oligosakkaridenheter og P representerer fosfatenhet. I trans-golginettverket fjernes terminal N-acetylglukosamin-oligosakkaridenheter før proteinet transporteres til lysosomer. For at proteiner skal transporteres til lysosomer, kreves mannose-6-fosfat motivet (høyre). Figuren er modifisert fra Shandala et al. (2001) [37] Legumain og N-bundet glykosylering I aminosyresekvensen for humant legumain er det fire kjente sekvenser, Asn-X-S/T, som er potensielle glykosyleringsseter for N-bundet glykosylering (Asn 91, Asn 167, Asn 263 og Asn 272 ; figur 1.6A) [8]. Haugen et al. (upublisert data) har vist at minst tre av de fire potensielle glykosyleringssetene i legumain okkuperes av sukker, men hvilke seter som okkuperes, er fremdeles ikke klarlagt. Tidligere masterstudent i farmasi, Ingrid Damgaard, viste ved bruk av endoglykosidase Endo H at sukkermolekylene på legumain er av hovedtypen høy-mannose, samt at glykosyleringen av legumain er viktig både for prosessering og intracellulær transport av legumain til kjernen [35]. Masterstudent i farmasi, Roya Kasem, har tidligere vist at tunikamycin hemmer glykosyleringen av både prolegumain og aktivt modent legumain i tillegg til at glykosyleringen av legumain er viktig for autoaktivering, aktivitet og stabilitet [39]. Det er vist at endogent normalglykosylert prolegumain internaliseres i celler [23], men det er ukjent om celler kan ta opp uglykosylert prolegumain. Uglykosylert prolegumain og uglykosylert moden form har henholdsvis molekylvekter på 47 og 28 kda (figur 1.6B) [35]. 8
25 Figur 1.6. N-bundet glykosylering av legumain. A) Potensielle glykosyleringsseter (blå) på asparagin (Asn) i aminosyresekvensen til legumain. Figuren er modifisert fra masteroppgave (2015) [39]. B) Estimerte molekylvekststørrelser av glykosylerte (rød) og uglykosylerte (blå) former av legumain. 1.4 Inhibering av N-bundet glykosylering med tunikamycin Tunikamycin er et nukleosidantibiotikum som er isolert fra Streptomyces lysosuperificus [40]. Tunikamycin er et nyttig virkestoff i studier av N-bundet oligosakkarider og er viktig for å studere glykosylering i biologiske funksjoner [41]. I tillegg til å være et antibiotikum så inhiberer tunikamycin det første steget i biosyntesen av høy-mannoseoligosakkaridet, der overføringen av GlcNac-1-P hemmes, og produksjonen av lipidkoblede-oligosakkarider hemmes, som videre medfører at glykosyleringen av nysyntetiserte proteiner hindres [42]. De nødvendige konsentrasjonene av tunikamycin, som er kjent for å hindre glykosylering av proteiner, ligger mellom 0,1-10 µg/ml [42]. Eksponeringstiden med antibiotikumet er avgjørende for at det skal produseres uglykosylerte proteiner som erstatter de endogene 9
26 glykoproteinene, en behandlingstid på 24 timer er anbefalt [43]. Likevel må det tas hensyn til cellenes hastighet av metabolisme og syntese av proteiner slik at det produseres fullstendige uglykosylerte proteiner. Tunikamycin vil kunne ha toksiske effekter på celler, og dette kan skyldes at høye nivåer med uglykosylerte proteiner medfører ER-stress. Tunikamycin er en kjent induser av ER-stress og er anvendt i forskning til å undersøke de cellulære prosessene rundt denne mekanismen [44]. Cellen reagerer på ER-stress ved å sette i gang forsvarsmekanismen ufoldet proteinrespons (UPR) som kan medfører igangsetting av apoptose og eliminering av den defekte cellen [45]. 1.5 Proteaser og kreftutvikling I dag er kreft hovedårsaken til dødelighet i de fleste vestlige land med en estimert dødsrate på 8,2 millioner mennesker hvert år [46]. Kreft har komplekse og varierende årsaker som involverer endringer av genmaterialet i celler, som resulterer i uttrykk av onkogener og reduserer uttrykk av tumorrepressorgener. I utviklingen av kreft er både arv og miljøfaktorer viktige. Kjennetegn ved kreftutvikling er ukontrollert celledeling ved opprettholdelse av proliferative og replikative signaler, redusering av veksthemmende signaler, vedvarende angiogenese, vevsinvasjon og metastasering, samt hemmet apoptose (figur 1.7) [47]. Figur 1.7. Kjennetegn ved kreftutvikling. Illustrasjon av seks biologiske årsaker til kreftutvikling. Figuren er modifisert fra Hanahan et al. (2011) [47]. 10
27 I organet der den ukontrollerte celledelingen ved kreft startet, vil det kunne medføre opphopning av kreftceller og dannelse av en kreftsvulst. Kreftsvulsten kan videre metastasere ved at noen celler løsrives fra primærsvulsten og fraktes med lymfe- eller blodårene til andre deler av kroppen, der de fester seg og starter celledeling som resulterer i en sekundærsvulst. Metastasering er en kompleks prosess med flere trinn, som ikke er fullstendig klarlagt [48]. Serin- og metalloproteasene har blitt detaljert beskrevet som en del i kreftprogresjonen, men flere studier har også påpekt at cysteinproteasene spiller en viktig rolle i kreft ved å påvirke proliferasjon, invasjon, apoptose og metastasering [49]. Økte uttrykk av cathepsin B, L og legumain er assosiert med aggressive tumorer og dårlig prognose ved bryst-, tykktarm- og ovariekreft [50-52]. Det er også sett at tilstedeværelsen av cysteinproteaseinhibitorer korreleres med bedre prognose av ulike kreftformer [53]. Eksempelvis har den mest potente legumaininhibitoren cystatin E/M, vist å være en tumorsuppressor ved brystkreft [54], samt inhibere invasjon av human melanoma- [55] og oral karsinomaceller [22, 56] Legumain og kreft Legumain er overuttrykt som inaktiv proform (prolegumain) i flere maligne svulster, blant annet tykktarm-, bryst- og prostatakreft [18, 20, 57] og er et potensielt målmolekyl for kreftterapi [20]. I svulsten er legumain vist å være oppregulert, både i kreftceller, assosierte endotelceller, samt i tumorassosierte makrofager (TAMs), og høye nivåer av legumain er korrelert med dårlig prognose [23]. Legumain er hovedsakelig lokalisert i lysosomer, men i forbindelse med kreft er det vist at legumain også er lokalisert ekstracellulært [18]. I tumormikromiljøet er det ofte hypoksi, svakt sur ph og avvikende redoks-forhold som kan være gunstig for aktivering av prolegumain [18]. Legumains rolle i maligne cellers migrering og invasjon er ikke fullstendig kjent. Det er kjent at aktivt legumain kan aktivere progelatinase A (pro-mmp-2) til gelatinase A (aktiv-mmp-2) som antas å være viktig i spaltningen av ekstracellulær matriks [58]. 1.6 Syntetiske legumainprober Det er flere forskningsgrupper som har utviklet aktivitetsbaserte prober der målet er å selektivt binde til legumain og kunne detektere proben etter binding. Edgington et al. (2012) har utviklet en aktivitetsbasert probe, LE28, som kun fluorescerer ved binding til legumain 11
28 [59]. Poreba et al. (2016) har nylig syntetisert og karakterisert tre nye selektive, biotinmerkede og aktivitetsbaserte prober for legumain, kalt MP-L01, -L02 og -L03 [60]. Probene er biotinmerket (N-terminalt) som muliggjør deteksjon av deres binding til proteiner ved bruk av streptavidin ved immunoblotting. I tillegg har probene en elektrofil acyloksymetyl-gruppe (AOMK), kalt Warhead, som irreversibelt bindes kovalent til cystein i det aktive setet og inhiberer legumain. Normalt foretrekker legumain, som tidligere nevnt, asparagin (Asn) i P1-posisjon, men kan også spalte aminosyren aspartat (Asp) ved ph 4, da sidekjeden til Asp blir delvis protonert og ligner Asn. Aminosyren Asp gjenkjennes også av caspaser, og probene ble selektert ved screening av et bibliotek med Asp i P1-posisjon og en blanding av naturlige og unaturlige aminosyrer i P2-P4. De selekterte probene har en naturlig aminosyre i P2- og en unaturlig aminosyre i P3-posisjon, som er viktig for legumainselektiviteten. Ulikheten mellom MP-L01 og MP-L03 brukt i denne oppgaven, er at MP-L01 har umetylert, mens MP-L03 har en metylert Asp i P1-posisjon. I tillegg har MP-L03 en større og lipofil aminosyre i P4-posisjon enn MP-L01 [60]. Figur 1.8. Skjematisk struktur av legumainselektive aktivitetsbaserte prober. Probene er merket med en biotin-tag (N-terminalt; rød) for deteksjon med streptavidin. I P1-posisjon (grønn pil) sitter Asp som legumain foretrekker å spalte ved ph rundt 4. AOMK (blå) er en elektrofil acyloksymetyl-gruppe, kalt Warhead, som irreversibelt bindes kovalent til cystein i det aktive setet og inhiberer legumain. I M38L-celler, en monoklonal stabiltransfektert HEK293-cellelinje som overuttrykker legumain [23], ble det sett at begge MP-probene bindes kun til aktivt legumain, samt at MPprobene tas opp, binder og inhiberer legumain i levende celler [60]. Tiden det tok for at MPprobene ble internalisert og detektert i levende celler, var 8-24 timer [60]. 12
29 2 Mål med oppgaven Følgende problemstillinger ble undersøkt: 1) Hvilken rolle spiller glykosylering av prolegumain for internalisering og prosessering til moden aktiv form? 2) Hvilken rolle spiller glykosylering av cystatin E/M, den mest potente endogene legumaininhibitoren, for internalisering og inhibering av endogent legumain? 3) Etablere metode for bruk av Odyssey CLx Near-Infrared Imaging System (Li-Cor) til deteksjon ved immunoblotting. 4) Kan renset bovint legumain alene eller bundet til selektiv probe internaliseres i levende celler? 5) Vil endocytosehemmeren Dyngo-4a hemme opptak av prolegumain, modent legumain, fri legumainselektiv probe eller et kompleks av legumain og probe? 13
30 14
31 3 Materialer og metoder 3.1 Kjemikalier og reagenser Kjemikalier Aceton, C2H5OH Albuminstandard (23209) Ammediol, (HOCH2)2C(NH2)CH3 (2-Amino-2-metyl-1,3-propandiol) ( ) Bio-Rad Protein Assay Dye Reagent Concentrate ( ) Bovint legumain, homogenisert og renset fra storfenyre Bromofenolblå ( ) CHAPS, C32H58N2O7S (C3023-IG) Dinatrium-EDTA, Na2C10H16N2O8 (00064) DMEM Dulbecco s Modified Eagle Medium ( ) DMSO, dimetylsulfoksid, (CH3)2SO (D2650) DTT, ditiotreitol, C4H10O2S2 (438117) Dyngo-4a, C18H14N2O5 ( ) Edikksyre, CH3COOH ( ) FBS, føtalt kalveserum, fetal bovine serum (A15-151) Geit anti-human polyklonalt antistoff mot cystatin E/M (AF1286) Geit anti-human polyklonalt antistoff mot legumain (AF2199) G418 Geneticin, disulfat saltløsning, C20H40N4O10 x 2H2SO4 (G8168) Leverandør Merck, Darmstadt, Tyskland Thermo Scientific, Rockford, IL, USA Sigma-Aldrich, St. Louis, MI, USA Bio-Rad Laboratories, Hercules, CA, USA Produsert etter protokoll fra Yamane et al. (2002) [61] Bio-Rad Laboratories Sigma-Aldrich Ferak, Berlin, Tyskland Life Technologies, Carlsbad, CA, USA Sigma-Aldrich Sigma-Aldrich Sigma-Aldrich Merck PAA Laboratories, Pasching, Australia R&D Systems, Minneapolis, MN, USA R&D Systems Sigma-Aldrich 15
32 Hydrogenklorid, HCl (26614) IRDye 680LT Esel anti-geit immunoglobulin ( ) Sigma-Aldrich Li-Cor Biosciences, Cambridge, Storbritannia IRDye 800CW Esel anti-geit immunoglobulin ( ) IRDye 800CW Esel anti-mus immunoglobulin ( ) IRDye 800CW Streptavidin ( ) Geit anti-mus monoklonalt antistoff mot GAPDH ( ) Kanin anti-geit polyklonalt antistoff, immunoglobulin (PO160) Mus anti-human monoklonalt antistoff mot GAPDH (Sc-47724) Natriumdihydrogenfosfat, NaH2PO4 xh20 (6346) Natriumhydroksid, NaOH (6495) Natriumpyrovatløsning, 100 mm, C3H3NaO3 (S11-003) Natriumklorid, NaCl ( ) Natriumcitrat, Na3C6H5O7 x 2H2O (6448) NuPAGE Antioksidant NuPAGE LDS Sample Buffer (4X) NuPAGE MOPS Running Buffer (20X) (NP0001) NuPAGE (4-12 % Bis-Tris Gel), Novex (NP0322) Penicillin/Streptomycin ( U/ml) (P11-010) Ponceauløsning (P7170IL) Li-Cor Biosciences Li-Cor Biosciences Li-Cor Biosciences Bio-Rad Laboratories Dako Cytomation, Glostrup, Danmark Santa Cruz Biotechnology, TX, USA Merck Merck PAA Laboratories Merck Merck Life Technologies Life Technologies Life Technologies Life Technologies PAA Laboratories Sigma-Aldrich 16
33 Precision Plus Protein Dual Color Standards ( ) Rekombinant prolegumain, rhproleg (2199- CY) Restore Western Blot Stripping Buffer (21059) Sitronsyre, C6H8O7 x H2O ( ) SuperSignal WestDura Extended Duration Substrate (34075) Tris (base), C4H11NO3 (T1503) Tris/Glycin buffer (10X) (# ) Trypanblått 0,4 % Trypsin-EDTA 0,25 % ( ) Tunikamycin (654380) Tween 20 ( ) Tørrmelk Z-Ala-Ala-Asn-AMC, legumainsubstrat Bio-Rad Laboratories R&D Systems Thermo Scientific Merck Thermo Scientific Sigma-Aldrich Bio-Rad Laboratories Life Technologies Life Technologies Merck Bio-Rad Laboratories Normilk, Levanger, Norge Bachem, Bubendorf, Sveits 3.2 Utstyrsliste Utstyr BioHit Optifit tip pipettespisser (10, 200 og 1000 µl) Corning 75 cm 2 dyrkningsflaske (3275) Corning Sentristar, sentrifugerør (15 ml) (430791) Corning Sentristar, sentrifugerør (50 ml) (430921) Costar 12-brønnersbrett (3516) Costar 24-brønnersbrett (3524) Costar 48-brønnersbrett (3548) Leverandør Sartorius Biohit Liquid Handling Oy, Finland Corning Incorporated, NY, USA Corning Incorporated Corning Incorporated Corning Incorporated Corning Incorporated Corning Incorporated 17
34 Costar 96-brønners mikrotiterplate, svart (3915) Costar 5 ml pipette (4051) Costar 10 ml pipette (4101) Costar 25 ml pipette (4251) Countess Automated Cell Counter Dri-Block DM-2A ECL Semi-dry Blotters, blottemaskin ELISA-kit (MAB21992) Eppendorfrør (0.5-, 1.5-, 2- og 5 ml) Heraeus Fresco 21 Centrifuge ( ) Holten Lamin Air LAF-benk Inkubatorskap (Galaxy 170S) Molecular Imager ChemiDoc LabTM XRS+ (721BR03414) Nunc 96-brønners mikrotiterplate, blank (260836) Nitrocellulosemembraner, Hybond-ECL- Amersham Odyssey CLx Near-Infrared Imaging System Olympus CKX41 lysmikroskop PD MiniTrap G-25 kolonne PD-10 Desalting columns SUB Aqua 12 vannbad The Belly Dancer Victor X4 Multimode Plate Reader, mikroplateleser XCell SureLock Electrophoresis Cell Corning Incorporated Corning Incorporated Corning Incorporated Corning Incorporated Invitrogen, Life Technologies Techne, Cambridge, Storbritannia Amersham Bioscienses, Buckinghamshire, Storbritannia R&D Systems, Abingdon, USA Eppendorf AG, Hamburg, Tyskland Thermo Scientific Medinor, Oslo, Norge Eppendorf, New York, USA Bio-Rad Laboratories Nunc, Roskilde, Danmark GE Healthcare Bio-Sciences, Oslo, Norge Li-Cor Biosciences Olympus, Tokyo, Japan GE Healthcare Bio-Sciences GE Healthcare Bio-Sciences Grant, Cambridge, England Stovall Life Science, Greensboro, NC, USA Perkin Elmer Life and Analytical Sciences, Boston, MA, USA Life Technologies 18
35 3.3 Celledyrking HCT116-celler HCT116-celler (American Type Culture Collection, ATCC; CCL-247) er en adherent human epitelcellelinje som stammer fra tykk-/endetarmskreft (colorectal adenocarcinoma) fra en voksen mann. HCT116-cellene tilhører biosafety level 1 (BSL-1), der biosafety level beskriver sikkerhetsrisikoen ved arbeidet med cellene SW620-celler SW620-celler (ATCC; CCL-227) er en adherent human epitelcellelinje som stammer fra tykk-/endetarmskreft (colorectal adenocarcinoma; Duke s type C) fra en kaukasisk mann på 51 år, og er utviklet fra en metastatisk lymfeknute. SW620-cellene tilhører BSL HEK293-celler Human Embryonic Kidney (HEK) 293-celler (ATCC; CCL-1573) er en adherent cellelinje som stammer fra embryonale nyreepitelceller. Cellelinjen ble transformert ved innsetting av deler fra adenovirus-5-dna. HEK293-cellene tilhører BSL M38L-celler M38L-celler er en stabil monoklonal (klon 38) HEK293-cellelinje som overuttrykker legumain og tilhører BSL-2. Denne cellelinjen er transfektert med humant legumain-cdna i en pcdna3,1-plasmidvektor (plgmn)[23]. Plasmidvektoren har et resistensgen mot antibiotikumet Geneticin (G418). G418 er et aminoglykosidantibiotikum og har egenskaper som hemmer funksjonen av ribosomer som resulterer i celledød av celler som ikke inneholder plasmidvektoren M4C-celler M4C-celler er en stabil monoklonal (klon 4) HEK293-cellelinje som overuttrykker cystatin E/M og tilhører BSL-2. Denne cellelinjen er transfektert med humant cystatin E/M-cDNA i en ptracer -plasmidvektor (pcst6)[23]. Plasmidvektoren har et resistensgen mot 19
36 antibiotikumet Zeocin, et glykopeptid- og bleomysinantibiotikum. Zeocin inneholder Cu 2+. Når Cu 2+ går inn i cellen, blir det redusert til Cu + og dermed fjernet, slik at Zeocin aktiveres og bindes til DNA som induserer nedbrytning av dobbeltrådig DNA Tining og utsåing av celler Cellene gjennomgår en langsom nedfrysningsprosess med glyserol og DMSO (5 %), for å unngå at cellene perforeres under nedfrysning, og oppbevares i flytende nitrogen ved -196 o C [62]. Ved tining tas ampullen med cellene raskt ut av nitrogentanken og tines i sekunder på vannbad ved 37 o C med konstante bevegelser. Etter tining overføres cellematerialet til en celleflaske, 25 cm 2 (HEK293-celler) og 75 cm 2 (HCT116-, SW620-, M38L- og M4C-celler) som inneholder oppvarmet serumholdig medium (3,5 eller 10 ml) (vedlegg A 1.1). Deretter inkuberes cellene ved 37 o C med 5 % CO2, og mediet skiftes flere ganger de første dagene for å sikre optimale vekstforhold. Tining av celler ble utført av overingeniør Hilde Nilsen Splitting og dyrking av celler Cellelinjene HCT116, SW620, HEK293, M38L og M4C dyrkes i celleflasker (75 cm 2 ) tilsatt 10 ml serumholdig (10 %) medium. Splitting av cellene utføres når celletettheten er rundt % ved å suge av gammelt medium som kastes, for deretter å vaske bort restene av medium med 10 ml serumfritt medium (vedlegg A 1.2). For å løsne cellene tilsettes 2 ml Trypsin- EDTA (0,25 %), og cellene inkuberes ved 37 o C og 5 % CO2 til cellene løsner (ca. 4-5 minutter). Løse celler observeres visuelt og i mikroskop. Hvis ikke cellene har løsnet tilstrekkelig, kan inkuberingen forlenges 1 minutt. Trypsin-EDTA inaktiveres ved å tilsette 10 ml serumholdig medium. Trypsin inaktiveres ved at serum inneholder trypsininhibitorer som stopper proteolysen. Pipetteringen utføres med forsiktighet, og det skylles over hele bunnarealet i flasken for å få med flest mulig celler. Cellesuspensjonen overføres til et 50 ml rør som sentrifugeres ved 800 rpm i 5 minutter. Supernatanten suges av og kastes, mens cellepelleten resuspenderes i 10 ml nytt serumholdig medium. Utsåing til forsøk gjøres etter celletelling ved egen prosedyre (3.3.8). Når celletallet bestemmes, så kan riktig antall celler sås ut i forbindelse med forsøk. Til 10 ml medium tilsettes det alltid 160 μl av G418 (Geneticin ; sluttkonsentrasjon 800 µg/ml) antibiotikum for cellelinjen M38L og 15 µl Zeocin (sluttkonsentrasjon 150 µg/ml) til cellelinjen M4C. 20
37 3.3.8 Telling og utsåing av celler Celletelling utføres ved blanding av 10 μl trypanblått (0,4 %) og 10 μl cellesuspensjon i et 1,5 ml eppendorfrør, og 10 μl av denne blandingen tas ut til et tellekammer. Ved uttaket fra cellesuspensjonen er det viktig at cellene er godt suspendert for å hindre celleklumping og sedimentering som kan gi et uriktig celletall. Metoden baseres på at døde celler farges blå, da cellemembranen ikke er intakt, og trypanfarge kan trenger inn i de døde cellene, samt at en automatisk celleteller (Countess Automated Cell Counter) teller levende ufargede celler. Tellekammeret plasseres i celletelleren som teller totalt antall celler/ml, antall levende og døde celler/ml, samt % viabilitet. Det er antall levende celler/ml som brukes i beregningene av cellekonsentrasjon til forsøk. De ulike cellelinjene i eksperimentene sås ut i flasker (75 cm 2 ), 6-, 12-, 24- eller 48-brønners brett i serumholdig medium og inkuberes i 24 timer ved 37 o C Produksjon av kondisjonert medium Fra cellelinjene SW620, HCT116, HEK293, M38L og M4C produseres det kondisjonerte medier med henholdsvis glykosylerte og uglykosylerte sekrerte proteiner etter behandling uten og med tunikamycin. Celler sås ut i flasker (75 cm 2 ) med omtrent 5 x 10 6 celler/flaske i 10 ml serumholdig medium og inkuberes ved 37 o C i 24 timer. For fremstillingen av ulike kondisjonerte medier suges deretter det brukte serumholdige mediet av, og cellene vaskes forsiktig én gang med 10 ml serumfritt medium som deretter kastes. For produksjon av kondisjonert medium med glykosylerte proteiner tilsettes 10 ml serumfritt medium, og cellene inkuberes ved 37 o C i 24 timer. Neste dag fjernes mediet, og cellene reeksponeres med samme løsning under like betingelser i nye 48 timer. Deretter høstes mediet og cellelysat ved hjelp av metoden beskrevet i kapittel Til produksjon av kondisjonert medium fra DMSO-kontroll i forsøk tilsettes DMSO (0,01 %). Dannelse av uglykosylerte proteiner i kondisjonert medium utføres ved å tilsette 1 µl tunikamycin (stock 10 mg/ml i DMSO) i 10 ml serumfritt medium (sluttkonsentrasjon 1 µg/ml), som gis til cellene og inkuberes ved 37 o C i 24 timer. For å sikre at alle proteinene blir uglykosylerte, fjernes dette mediet neste dag, og cellene reeksponeres for ferskt medium med tunikamycin og inkuberes ved 37 o C i nye 48 timer. Deretter sjekkes flaskene i mikroskopet 21
38 for løse celler og morfologiske endringer før medium og cellelysat høstes som beskrevet i kapittel Eksponering av celler med legumain Det var ønskelig å se om legumain fra ulike kilder (kondisjonert medium, rekombinant eller renset protein) internaliseres i celler. Direkte eksponering med kondisjonert medium fra HEK293-, M38L-, HCT116- og SW620-celler gjøres ved at det tilsettes en blanding av 50 % (v/v) av kondisjonert medium (beskrevet i kapittel 3.3.9) og serumfritt medium til cellene. Direkte eksponering med rekombinant prolegumain (ca 57 kda) utføres ved dannelse av en stock der rekombinant prolegumain fortynnes i serumfritt medium, og ønsket volum tas ut og tilsettes direkte til mediet i cellebrønnen. For direkte eksponering med renset bovint legumain, tas det ut ønsket mengde volum fra 275 µm stock i citratbuffer (50 mm, ph 5) som fortynnes i legumain-assaybuffer (vedlegg A 3.1). Fra denne løsningen tilsettes det til cellene slik at sluttkonsentrasjonen blir 10 µm i cellebrønnen Eksponering av celler med legumain-selektive prober Direkte eksponering med de legumain-selektive probene MP-L01 og MP-L03 [60] utføres ved å fortynne probe (MP-L01 eller MP-L03; begge 10 mm stock i DMSO) med legumainassaybuffer. Det lages tilsvarende fortynninger av DMSO (kontroll). Fortynningene tilsettes direkte til mediet i cellebrønnen, og blandes lett ved rolige sirkelbevegelser med cellebrettet. I forsøkene var det ønskelig å tilsette så små volum som mulig med legumain-assaybuffer, for å unngå påvirkning av ph i mediet Eksponering av celler med legumain-probe-kompleks For å undersøke om et kompleks bestående av legumain bundet til probe tas opp i celler, ble legumain (M38L-cellelysat eller renset bovint legumain) og probe først blandet i et ekvimolart forhold i legumain-assaybuffer. Blandingen ble deretter inkubert i 30 minutter ved 30 o C for å sikre binding av probe til legumain. Deretter ble HEK293-cellene eksponert for inkubatet med eller uten forbehandling med Dyngo-4a (kapittel ). 22
39 Eksponering av celler med endocytosehemmeren Dyngo-4a For å undersøke mekanismen for internalisering av legumain og probe (kapittel ) ble celler forbehandlet med den klatrinmedierte endocytosehemmeren Dyngo-4a, 50 µm i serumfritt medium. Dyngo-4a er løst i DMSO til stock 10 mm som fortynnes. Det lages en tilsvarende fortynning med DMSO (kontroll). Cellene preinkuberes i én time ved 37 o C, for å sikre effekt av Dyngo-4a før ytterligere eksponering Høsting av celler og kondisjonert medium Før høstingen undersøkes hver flaske og brønn i mikroskopet for eventuelle løse celler og morfologiske forandringer. Kondisjonert medium høstes ved forsiktig avpipettering til 1,5 eller 2 ml eppendorfrør eller 15 ml rør. Deretter sentrifugeres mediet ved 800 rpm i 5 minutter, og supernatanten avpipetteres og overføres til et nytt rør. Resterende cellerester kastes eller i enkelte tilfeller vaskes med 1X PBS-løsning (vedlegg A 1.3) før videre cellelysering bestemt i henhold til protokoller. Høsting av adherente celler starter med én forsiktig vask med kald 1X PBS-løsning, der tilsetningen tilføres langs veggen av beholderen for å unngå at cellene løsner. I hver brønn vaskes det med 0,5 ml til 12-brønners brett, 1,5 ml til 6-brønnersbrett og 5 ml til celleflasker, og vaskeløsningen kastes. Høstingen utføres med enten legumainlysisbuffer (ph 5,8; vedlegg A 1.4) eller 3X SDSloading buffer/høstebuffer (med DTT; vedlegg A 1.5). Til 6-brønnersbrett tilsettes 200 μl og til flasker (75 cm 2 ) 1,5 ml av lysisbuffer. Beholderen vippes noen ganger for at cellene skal løsne og observeres visuelt eller via mikroskop. Deretter skylles beholderen med litt av lysatet ved hjelp av pipettering for å sikre at man får med det meste av cellematerialet. I noen tilfeller med tunikamycinbehandlede celler må det skrapes for at cellene skal løsne. Cellelysatet overføres til 1,5 ml eppendorfrør og krever forsiktig pipettering da lysisbufferen skummer, grunnet innhold av oktylglykosid (N-oktyl-β-D-glukopyranosid). Ved høsting av cellelysat i 3X SDS-loading buffer (med DTT) tilsettes 20, 50 eller 100 μl direkte i hver cellebrønn, og beholderen vippes noen ganger for at cellene skal lyseres. Med denne høstebufferen sees det ikke visuelt at cellene løsner. Men når det røres rundt med pipettespissen, blir lysatet seigt som tyder på lysering og DNA i blandingen. Cellelysatet overføres til et 1,5 ml eppendorfrør. 23
40 Cellelysatene som høstes i legumainlysisbuffer fryses ned ved - 70 o C i minutter og tines på varmeblokk ved 30 o C med tre repetisjoner for å sikre tilstrekkelig lysering av cellene. Cellelysatene sentrifugeres ved x G i 5 minutter ved 4 o C. Supernatanten avpipetteres og overføres til et nytt 1,5 ml eppendorfrør. Alle prøvene lagres ved - 70 C før videre analyser Fjerning av tunikamycin fra kondisjonert medium Det var ønskelig med uglykosylerte proteiner uten tilstedeværelse av tunikamycin i kondisjonert medium. Tunikamycin fjernes ved å sende medium gjennom en kolonne, PD10 Desalting columns. Kolonnen kalibreres først ved å tilsette omtrent 5 ml serumfritt medium, totalt 4 ganger. Deretter tilsettes et prøvevolum på 2,5 ml til kolonnen. Prøven elueres ved hjelp av gravitasjonskraften ved å tilsette 3,5 ml serumfritt medium, og eluatet samles opp i et nytt rør (gir 1,4 gangers fortynning av prøven). Tunikamycin blir opprenset fordi at lavmolekylære stoffer blir forsinket på kolonnen, men store proteiner beveger seg raskere og kan isoleres ved å samle opp den riktige fraksjonen av eluatet. Prøven kan også elueres ved hjelp av spinneprotokoll. Da spinnes den samme kolonnen med prøveløsning ved 1000 X G i 2 minutter, og fortynning av prøveløsningen unngås. 3.4 Totalproteinmåling Måling av totalprotein i cellelysat analyseres ved bruk av metoden beskrevet av Bradford [63]. Denne metoden er basert på at cellelysat tilsettes et fargestoff, Coomassie Plus Protein Assay Reagent. Denne rødbrune løsningen er sur, fargestoffet i løsningen bindes til negativt ladede anioner på proteiner og danner et stabilt kompleks av fargestoff og protein som gir blå farge. Som en konsekvens av denne bindingen vil det oppstå et skift i absorbsjonsmaksimum fra 465 nm til 595 nm som kan måles i en mikroplateleser. Intensiteten er direkte proposjonal med proteinmengden i cellelysatet. Det lages en standardkurve av albumin (0, 50, 100, 200, 300 og 400 µg/ml løst i legumainlysisbuffer), og det påsettes tre paralleller av 10 µl for hver konsentrasjon i en gjennomsiktig mikrotiterplate. Det påsettes også 10 µl av prøver (cellelysat høstet i legumainlysisbuffer) med 1-3 paralleller. Fargeløsningen fortynnes 1:5 med destillert vann (vedlegg A 2.1), og løsningen undersøkes for eventuelt bunnfall, før 200 µl av fortynnet 24
41 fargeløsning tilsettes i hver brønn. Deretter inkuberes mikrotiterplaten ved romtemperatur i 5 minutter før måling av absorbans i en mikroplateleser (Victor X4 Multimode Plate Reader) ved 595 nm. Totalproteinmåling utføres for å gjøre et korrekt uttak av cellelysat før acetonfelling i forbindelse med fremstilling av prøver til elektroforese og for å kunne korrigere enzymaktivitet i forhold til faktisk proteinmengde i prøven. 3.5 Legumainaktivitetsmåling Måling av enzymaktiviteten til legumain utføres etter metoden beskrevet av Chen et al. og modifisert av Johansen et al. [8, 64]. For å måle enzymaktiviteten til legumain anvendes det et spesifikt fluorescerende peptidsubstrat, Z-Ala-Ala-Asn-AMC. Dette substratet spaltes av legumain og medfører en frigjøring av en leaving group, AMC (7-amino-4-metylkumarin). AMC har en høyere fluorescens når den er fri enn når den er bundet til peptidsubstratet. Det påsettes 20 µl blindprøve, lysisbuffer eller legumain-assaybuffer (med DTT), avhengig av hva prøvene er fortynnet i, med tre paralleller og 20 µl cellelysatprøver med paralleller (1-3) i et svart 96-brønnersbrett. Brettet plasseres i en mikroplateleser (Victor X4 Multimode Plate Reader) ved 30 o C. Det dispenseres automatisk 100 µl legumain-assaybuffer med reduksjonsmiddel (ditiotreitol, DTT) i hver brønn, etterfulgt av 10 minutters pause før det automatisk tilsettes 50 µl av legumainsubstratløsning (34 µm; vedlegg A 3.2) som gir en sluttkonsentrasjon på 10 µm i brønnen. Etter tilsetningen av substratløsning ristes platen i 10 sekunder, samt i tre sekunder før hver påfølgende måling. Det utføres repeterende målinger for økningen i fluorescens over tid (30 minutter for M38L-cellelysat og 60 minutter for HEK293-, HCT116- og SM620-cellelysat) ved 360 nm for eksitasjon og ved 460 nm for emisjon. Til slutt kalkuleres økningen i fluorescens per sekund (df/sek) automatisk i hver celleprøve, og dette vil korrelere til spaltninger utført av legumain per tid. Legumainaktivitetsmålinger normaliseres deretter mot µg totalprotein (df/sek/protein) fra totalproteinmålinger (kapittel 3.4). 25
42 3.6 Gelelektroforese og immunoblotting Elektroforese og immunoblotting utføres etter metoden til Towbin [65], der metoden separerer og påviser spesifikke proteiner i cellelysater og kondisjonerte medier, slik som i påvisning av proteinene legumain og cystatin E/M i HEK293-, M38L-, M4C-, HCT116- og SW620-celler Opparbeidelse av gelelektroforeseprøver For å tilsette lik mengde totalprotein per brønn på gelen anvendes totalproteinmåling (kapittel 3.4). Utgangspunktet for konsentrasjonen velges etter cellelysatprøven som har den laveste totalproteinmålingen. Deretter fortynnes de resterende cellelysatprøvene i lysisbuffer slik at alle prøvene får lik konsentrasjon med totalprotein. Prøvene (elektroforeseprøver; vedlegg A 4.4.) bestående av cellelysat (13 µl, eventuelt fortynnet i destillert vann), DTT 0,5 M (2 µl) og 4X Sample Buffer (5 µl), blandes og varmes i 10 minutter ved 70 o C. Noen av celleprøvene høstes direkte i 3X Sample Buffer (kapittel ), men i motsetning til 4X Sample Buffer blir cellelysatene varmet i 10 minutter ved 95 o C Acetonfelling av proteiner I noen cellelysat høstet med lysisbuffer er det lite totalprotein. Det er derfor ønskelig å oppkonsentrere disse for å kunne påsette 15 µg totalprotein i gelelektroforesen. I et 1,5 ml eppendorfrør tilsettes 20 % cellelysat og 80 % iskald aceton, som virvles, for deretter å settes iskaldt (- 20 o C) i én time. Etter dette sentrifugeres prøvene i 20 minutter ved X G og 4 o C. Supernatanten avpipetteres forsiktig og kastet. Den resterende proteinpelleten tørkes i omtrentlig 30 minutter avhengig av mengde tilsatt aceton, og uten å overtørke pelleten. Pelleten løses deretter i vann (13 µl) og tilsettes 0,5 M DTT (2 µl) og 4X Sample Buffer (5 µl) til en elektroforeseprøve (kapittel 3.6.1) Gelkjøring og immunoblotting Det brukes 12-brønners polyakrylamidgel (NuPAGE 4-12 % Bis-Tris Gels) som plasseres i et gelelektroforesekar. I det indre karet tilsettes det 200 ml med elektroforesebuffer (NuPAGE Running buffer; vedlegg A 4.1) og 500 µl antioksidant (NuPAGE antioksidant). NuPAGE Dual Color protein standard (1-5 µl) og elektroforeseprøver (15 eller 20 µl) appliseres i 26
43 brønnene på gelen. Elektroforesebufferen (600 ml) tilsettes i det ytterste karet. Elektroforesen settes i gang og går med 200 volt i 60 minutter, slik at proteinene dras mot den positive anoden og separeres etter molekylstørrelse. Etter elektroforesekjøringen løsnes gelen og overføres til en nitrocellulosemembran (0,45 µm) som på forhånd er fuktet med blottebuffer (vedlegg A 4.2.). Proteinene på gelen overføres til membranen i en blottemaskin ved 25 volt i 30 minutter. For å verifisere at proteinene overføres til membranen tilsettes Ponceau fargeløsning til membranen i ett minutt. Ponceauløsning farger proteinene røde slik at de kan visualiseres og fotograferes. Løsningen vaskes bort med destillert vann og til slutt litt 1X TTBS (vedlegg A 4.3.). Videre blokkes membranen med 10 ml 5 % tørrmelk (løst i 1X TTBS) i 60 minutter. Membranen blokkes for å hindre uspesifikke bindinger av antistoffer til membranen ved at melkeproteiner bindes der prøveproteinene ikke allerede har bundet seg. Etter blokkingen overføres membranen til et 50 ml rør med 5 ml fortynnet primærantistoff mot ønsket analysert protein (fortynnet i 5 % tørrmelk med 1X TTBS), og rulles over natt ved 4 o C. Tabell 1 viser oversikt over primærantistoff og fortynninger brukt i denne oppgaven. Tabell 1: Oversikt over primærantistoffer brukt i oppgaven Primærantistoff Fortynning Geit anti-human polyklonalt antistoff mot legumain (AF2199) 1:1000 Geit anti-human polyklonalt antistoff mot cystatin E/M (AF1286) 1:250 Mus anti-human monoklonalt antistoff mot GAPDH (Sc-47724) 1: Neste dag vaskes membranen fire-fem ganger á 10 minutter med 1X TTBS før det tilsettes 10 ml fortynning av sekundærantistoff mot det respektive primærantistoffet (2 ml fortynnet i 1X TTBS med 5 % tørrmelk og 8 ml 1X TTBS). Membranen inkuberes med sekundærantistoffet (Tabell 2) i én time ved romtemperatur. Etter inkuberingen med sekundærantistoff vaskes membranen ytterligere fire-fem ganger á ti minutter med 1X TTBS før fremkalling. 27
44 Tabell 2: Oversikt over sekundærantistoffer anvendt ved fremkalling med Imager ChemiDoc LabTM XRS+ Sekundærantistoff brukt ved Molecular Imager Fortynning ChemiDoc LabTM XRS+ Kanin anti-geit polyklonalt antistoff, immunoglobulin (PO160) 1:2000 Geit anti-mus monoklonalt antistoff mot GAPDH ( ) 1:1500 For fremkalling ved bruk av Molecular Imager ChemiDoc LabTM XRS+ tilsettes det fremkallingsvæske, SuperSignal WestDura Extended Duration Substrate (totalt 5 ml). Fremkallingsvæsken inneholder et substrat for Horseradish Peroxidase (HRP), som danner en kjemisk reaksjon med sekundærantistoffer som er konjugert med enzymet HRP og medfører dannelse av et kjemiluminescerende lys som detekteres. Det brukes også direkte deteksjon av membranen ved fremkalling med Odyssey CLx Near- Infrared Imaging System. Her anvendes sekundærantistoffer som er merket med IRDye, infrarøde fluorescerende fargestoffer (Tabell 3). Ved fremkalling av membranen benyttes det infrarød laser som gir stabile fluorescerende signaler av spesifikke proteinbånd. Antistoffene er merket med IRDye som detekteres ved enten 700 nm (rødt) eller 800 nm (grønt), det kan detekteres to målproteiner samtidig, og samlokalisering gir gult signal. Tabell 3: Oversikt over sekundærantistoffer anvendt ved fremkalling med Odyssey CLx Near-Infrared Imaging System Sekundærantistoff brukt ved Odyssey CLx Near- Fortynning Infrared Imaging System IRDye 800CW Streptavidin ( ) 1:2500 IRDye 680LT Esel anti-geit immunoglobulin ( ) 1: IRDye 800CW Esel anti-geit immunoglobulin ( ) 1: IRDye 800CW Esel anti-mus immunoglobulin ( ) 1:
45 3.7 ELISA Konsentrasjonsbestemmelse av legumain ble analysert ved bruk av et kommersiell ELISA-kit (MAB21992, R&D Systems, Abingdon, USA) i henhold til protokoll fra produsenten. Målingene ble utført av stipendiat Ngoc Nguyen Lunde. 3.8 Statistiske analyser I denne oppgaven er dataene presentert som gjennomsnitt ± standard error of the mean (SEM). Forsøkenes gjennomsnitt beregnes fra antall gjentagelser, og antallet (n) varierer fra 1-5. Signifikansnivået i oppgaven ble valgt til å være p 0,05, og to-utvalgs t-test (uparet test, Mann-Whitney test) er anvendt som statistisk metode. Verdiene fra målingene som var statistisk signifikant forskjellige angis i figurene med én stjerne (*). De statistiske analysene ble beregnet ved hjelp av GraphPad Prism 6 (GraphPad Software, Inc., San Diego, CA, USA). 29
46 30
47 4 Resultater 4.1 Internalisering og funksjon av uglykosylert versus glykosylert legumain og cystatin E/M I litteraturen er det tidligere beskrevet at HEK293-celler kan internalisere både prolegumain og cystatin E/M utskilt fra andre celletyper, samt aktivere internalisert prolegumain [23]. Det var i denne oppgaven ønskelig å undersøke viktigheten av glykosyleringen av prolegumain og cystatin E/M for betydningen av cellulært opptak, prosessering av legumain og inhibitorisk funksjon av cystatin E/M, og HEK293-celler ble derfor inkubert med kondisjonert medium fra andre celletyper inneholdende sekrerte, enten glykosylerte (G) eller uglykosylerte (UG) proteiner Fullstendig uglykosylert prolegumain blir ikke internalisert i HEK293-celler Det ble samlet kondisjonerte medier fra HCT116-, SW620- og M38L-celler som inneholdt henholdsvis sekrerte uglykosylerte (UG) proteiner etter behandling av cellene med tunikamycin (1 µg/ml), mens kontrollceller ble behandlet med 0,1 % DMSO og sekrerte normalglykosylerte (G) proteiner. Immunoblotting av de kondisjonerte mediene (KM) viste at HCT116- og SW620-kontrollceller kun sekrerte glykosylert prolegumain (G; 56 kda; Fig. 4.1A). I eksperimentene med tunikamycin ble cellene først behandlet i 24 timer, deretter ble mediet skiftet og ytterligere eksponert i 48 timer (total eksponering i 72 timer) for å sikre at alle sekrerte proteiner var uglykosylerte. Morfologisk sett endret de tunikamycinbehandlede cellene seg ved at de klumpet seg sammen, ble rundere, samt at en del celler løsnet og døde sammenliknet med kontrollcellene. I disse to cellelinjene ble det observert to proteinbånd for legumain med molekylvekt 47 kda, sannsynligvis helt eller delvis uglykosylert prolegumain. Tilsvarende inkubering av M38L-cellene ga ett sterkt proteinbånd for glykosylert prolegumain (56 kda), og bare ett intenst proteinbånd på ca. 47 kda for uglykosylert prolegumain (Fig. 4.1A). Resultater fra forsøket viste vellykket produksjon av uglykosylert prolegumain. Lysatene etter inkubering av HEK293-celler med KM, fra henholdsvis HCT116-, SW620- og M38L-celler, viste at glykosylert (G) prolegumain fra HCT116-KM ga samme intensitet i 31
48 proteinbåndet for prolegumain (56 kda) som i kontrollcellene (Fig. 4.1B, brønn 2 vs. brønn 1 og 6), mens blottet viste sterkere intensitet i båndet for modent legumain (36 kda; brønn 2). Lignende observasjoner ble også sett etter dyrkning med KM fra SW620 og M38L (brønn 4 og 7). Dyrking av HEK293-celler i KM fra M38L ga også en økning i intensiteten av båndet som tilsvarer prolegumain (56 kda, brønn 7). A ) C ) H C T K M S W K M M 3 8 L -K M L e g u m a in D M S O G - G - G - T u n ik a m y c in - U G - U G - U G k D a 5 0 L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in * * H C T K M S W K M M 3 8 L -K M - G U G G U G G U G B ) k D a 5 0 L e g u m a in 3 7 G A P D H 3 7 H C T K M - G U G S W K M G U G M 3 8 L -K M G U G Figur 4.1. Produksjon, internalisering og prosessering av glykosylert versus uglykosylert prolegumain. A) HCT116-, SW620- og M38L-celler (5 x 10 6 celler/75 cm 2 flaske) ble inkubert med 1 µg/ml tunikamycin eller DMSO (kontroll; 0,1 %) i 48 t. Immunoblottet viser serumfritt kondisjonert medium (KM) med uglykosylert (UG) og glykosylert (G) prolegumain. B) HEK293-celler (0,5 x 10 6 celler/brønn) i 6-brønnersbrett ble inkubert i 24 timer med enten serumfritt medium alene (kontroll; brønn 1 og 6) eller med 50 % (v/v) KM fra A, henholdsvis HCT116- (brønn 2-3), SW620- (brønn 4-5), eller M38L-celler (brønn 7-8). Tunikamycin ble fjernet fra UGmediene før inkubering ved hjelp av PD10 Desalting columns. Et representativt immunoblott av legumain i cellelysat er vist, etter analyse ved hjelp av gelelektroforese, immunoblotting og fremkalling ved ChemiDoc. GAPDH ble brukt som housekeeping -kontroll, og det ble påsatt 15 µg totalprotein/brønn etter acetonfelling. C) Legumainaktivitet (df/sek) i cellelysatene fra B ble analysert ved bruk av et spesifikt fluoriserende peptidsubstrat (Z-Ala-Ala-Asn-AMC) og normalisert mot µg totalprotein (df/sek/totalprotein), og er presentert som gjennomsnitt ± SEM (n= 3-5, * p 0,05 mot kontroll, uparet t-test). 32
49 Ved tilsetning av uglykosylert (UG) prolegumain fra HCT116-KM ble det observert svakere intensitet av prolegumain (56 kda), og liknende intensitet for moden form (36 kda; brønn 3) som i kontrollen. Det ble i tillegg sett et svakt proteinbånd med molekylvekt ca. 52 kda (brønn 3) som ikke ble sett i kontrollen eller etter inkubering med glykosylert prolegumain (brønn 1, 2, 4 og 6). Tilsvarende ble også observert etter inkubering med sekrerte uglykosylerte proteiner fra SW620 (brønn 5) og M38L (brønn 8). For alle prøvene ble det påført samme mengde totalprotein (15 µg) av cellelysat etter acetonfelling, og immunoblottet viste et jevnt uttrykk av kontrollen GAPDH (36 kda) (Figur 4.1B). Resultatene fra immunoblottet viste at glykosylert prolegumain internaliseres og prosesseres i HEK293- celler, men at dette ikke skjer for uglykosylert prolegumain. Derimot var det en tendens til redusert uttrykk av egenprodusert glykosylert prolegumain når HEK293 ble inkubert med uglykosylert prolegumain. Som en bekreftelse på internalisering og prosessering av prolegumain var det interessant å måle legumainaktiviteten i cellelysatene etter inkubering av HEK293-cellene med KM inneholdende glykosylert eller uglykosylert prolegumain. Ubehandlede HEK293-celler hadde endogen legumainaktivitet på df/sek/µg totalprotein (Figur 4.1C). Inkubering med uglykosylerte proteiner fra HCT116-KM eller SW620-KM viste en overraskende signifikant nedgang i legumainaktiviteten sammenliknet med kontrollen. Observasjoner i legumainaktivitet etter inkubering med glykosylerte proteiner så ut til å være noe redusert med HCT116-KM som viste 20 % reduksjon og med SW620-KM som ga 30 % reduksjon i legumainaktivitet. Når cellene derimot ble tilsatt glykosylert prolegumain fra M38L-KM, ble det observert omtrent 60 % økning i enzymaktivitet, men økningen var ikke signifikant. Inkubering med uglykosylert prolegumain fra M38L-KM ga ingen endring i legumainaktiviteten. Dette tyder på at glykosylert prolegumain fra M38L-KM blir internalisert og prosessert til aktivt legumain, slik som observert ved immunoblotting (Figur 4.1B), men at internalisert uglykosylert prolegumain ikke fører til prosessering (M38L-KM), eller tvert imot medfører redusert (HCT116- og SW620-KM) legumainaktivitet. 33
50 4.1.2 Endocytosehemmeren Dyngo-4a inhiberer prosessering og ikke opptak av prolegumain Det er tidligere omtalt i litteraturen at Dyngo-4a inhiberer klatrinmediert endocytose [33, 66]. Det var derfor ønskelig å undersøke om prolegumain internaliseres via denne endocytosemekanismen. HEK293-celler ble forbehandlet uten eller med Dyngo-4a før inkubering med enten M38L-KM inneholdende sekrert glykosylert (G) og uglykosylert (UG) prolegumain, eller med rekombinant human prolegumain (rhprolegumain). Cellene som ble behandlet med Dyngo-4a ble farget lysebrune sett i mikroskopet, og satt bedre fast i cellebrettet under høsting enn cellene som ikke ble behandlet med Dyngo-4a. I tillegg til at behandling med Dyngo-4a medførte at cellelysatet ble farget lysebrunt ved høsting med lysisbuffer. Inkubering av HEK293-celler med Dyngo-4a alene (Fig. 4.2A, brønn 2) ga tilsvarende intensitet for prolegumain (56 kda) som i kontrollen (brønn 1), men overraskende fravær av proteinbånd for moden form av legumain (36 kda). Inkubering med M38L-KM viste at tilsetning av glykosylert (G) prolegumain ga omtrent like sterke proteinbånd for prolegumain (56 kda) som i kontrollen, men blottet viste sterkere båndintensitet for modent legumain (36 kda; brønn 1 versus 3). Når cellene ble inkubert med glykosylert prolegumain i tilstedeværelse av Dyngo-4a, ble det sett en uventent kraftig opphopning av prolegumain og mindre prosessert modent legumain (brønn 4). Resultatene fra blottet viser at Dyngo-4a ikke inhiberer internalisering av glykosylert prolegumain, men ser ut til å hemme prosessering av prolegumain til moden form. Ved tilsetning av uglykosylert (UG) prolegumain fra M38L-KM til cellene, ble det observert svakere intensitet, både av endogen glykosylert prolegumain (56 kda) og moden form (36 kda; brønn 5) i forhold til kontroll. Det ble i tillegg sett to svake proteinbånd med molekylvekt rundt ca. 52 kda, som ikke ble sett ved noen av de andre tilsetningene. Når cellene i tillegg til uglykosylert prolegumain ble tilsatt Dyngo-4a (brønn 6), ble det sett et sterkere proteinbånd for endogent glykosylert prolegumain (56 kda), men ingen legumainbånd for moden form (brønn 5 versus 6). Dette tyder på at uglykosylert prolegumain ikke blir internalisert og at den endogene prosesseringen av prolegumain til moden form blir inhibert av Dyngo-4a. 34
51 A ) H E K C L H E K K M k D a L e g u m a in G A P D H D y n g o -4 a M 3 8 L -K M - - G G U G U G - - R h P ro le g u m a in G G U G U G B ) L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in D y n g o -4 a M 3 8 L -K M - - G G U G U G - - R h P ro le g u m a in Figur 4.2. Internalisering og prosessering av prolegumain med og uten tilstedeværelse av endocytosehemmeren Dyngo-4a. HEK293-celler (0,5 x 10 6 celler/brønn) i 6-brønnersbrett ble inkubert i én time med enten serumfritt medium med DMSO (kontroll; 0,5 %) eller med Dyngo-4a (50 µm). Deretter ble cellene dyrket videre i 24 timer med enten DMSO eller Dyngo-4a (kontroller; brønn 1-2 og 9-10), 50 % (v/v) kondisjonert medium (KM) fra M38L-celler (brønn 3-6 og 11-14) eller rekombinant prolegumain (RhProlegumain 375 ng/ml; brønn 7-8 og 15-16) i serumfritt medium, før høsting av cellelysat (CL) og kondisjonert medium (KM). M38L-KM inneholdt enten glykosylert (G) eller uglykosylert (UG) prolegumain (KM vist i figur 4.1A). Tunikamycin ble fjernet fra UG-KM ved bruk av PD10 Desalting columns. A) Immunoblott av legumain i HEK293-CL og -KM etter analyse ved hjelp av gelelektroforese, immunoblotting og fremkalling ved ChemiDoc. GAPDH ble benyttet som housekeeping -kontroll, og det ble påsatt 15 µg totalprotein/brønn av cellelysat etter acetonfelling. B) Legumainaktivitet (df/sek) i cellelysatene fra A ble analysert ved bruk av et spesifikt fluoriserende peptidsubstrat (Z-Ala-Ala-Asn-AMC) og normalisert mot µg totalprotein (df/sek/totalprotein) (n= 1-4). Når rekombinant prolegumain ble tilsatt, ble det sett tilsvarende legumainuttrykk, både for pro- og moden form som i kontrollen, uten og med tilsetning med Dyngo-4a (brønn 7 og 8). Konsentrasjonen av tilsatt rekombinant prolegumain var lav (målt ved ELISA, data ikke vist), og blottet viste kun svake proteinbånd. Resultatene tyder på at det er endogent legumain som observeres. Immunoblottet viste en jevn påføring av totalprotein ved bruk av kontrollen GAPDH (36 kda). 35
52 KM ble høstet og analysert etter behandling av HEK293-cellene, uten og med Dyngo-4a. Immunoblotting av HEK293-KM etter inkubering med serumfritt medium (DMSO kontroll) viste et svakt proteinbånd for prolegumain (56 kda) og ingen proteinbånd for moden form (36 kda; brønn 9). Men ved samtidig tilsetning av Dyngo-4a ble det detektert et svakere legumainbånd (brønn 10). Når cellene ble inkubert med M38L-KM, ble det observert ett sterkt bånd for glykosylert prolegumain, både uten og med Dyngo-4a (brønn 11 og 12). Inkubering med M38L-KM fra tunikamycin-behandlede celler viste et dobbeltbånd for legumain med molekylvekt 47 kda, hvor det korteste båndet var mest intenst, og disse representerte mest sannsynlig helt eller delvis uglykosylert prolegumain (brønn 13). Det ble derimot detektert kun ett svakt legumainbånd på størrelse med det sterkeste nevnt ovenfor etter inkubering med uglykosylert prolegumain og tilstedeværelse av Dyngo-4a (brønn 14). Inkubering av cellene med rekombinant prolegumain viste lavt innhold av prolegumain i HEK293-KM, uansett om cellene ble behandlet med Dyngo-4a eller ikke (brønn 15 og 16), omtrent på nivå som i kontrollcellene (brønn 9 og 10). Resultatene fra immunoblotting tyder på at tilsetning av Dyngo-4a gir redusert prolegumain i mediet. Enzymaktivitetsdata fra cellelysatene viste at ubehandlede HEK293-celler hadde en endogen legumainaktivitet på df/sek/µg totalprotein (kontroll; Figur 4.2B). Ved tilsetning av Dyngo-4a ble det sett en nedgang på 30 % i legumainaktiviteten sammenliknet med ubehandlet kontroll. Etter inkubering med glykosylert prolegumain fra M38L-KM ble det derimot observert 50 % økning i legumainaktivitet (jfr. Fig. 4.2B), mens samtidig inkubering med Dyngo-4a ga 80 % reduksjon i aktiviteten. Inkubering med uglykosylerte proteiner fra M38L-KM medførte ingen endring i legumainaktiviteten sammenliknet med kontrollen, men samtidig inkubering med Dyngo-4a ga redusert aktivitet. Når cellene ble tilsatt rekombinant prolegumain, ble det også sett 20 % redusert legumainaktivitet, og aktiviteten ble ytterligere redusert med 40 % ved samtidig inkubering med Dyngo-4a. Behandlingene med Dyngo-4a ble bare utført én gang, men indikerer at Dyngo-4a ikke inhiberer opptak av glykosylert prolegumain (Figur 4.2A) og at prolegumain ikke internaliseres via klatrinmediert endocytose, men at Dyngo-4a inhiberer prosessering av prolegumain til moden form med tilhørende redusert legumainaktivitet. 36
53 4.1.3 Både glykosylert og uglykosylert cystatin E/M blir internalisert i HCT116-celler Legumains mest potente endogene inhibitor, cystatin E/M, blir sekrert i to former, en uglykosylert form på 14 kda og en glykosylert form på 17 kda [22]. Smith et al. (2012) har beskrevet at cystatin E/M internaliseres og er i stand til å inhibere intracellulær aktivitet av legumain [23]. Det var derfor interessant å undersøke viktigheten av glykosyleringen av cystatin E/M for internalisering og inhibitorisk funksjon. Når M4C-cellene som overuttrykker cystatin E/M ble inkubert med serumfritt medium (DMSO kontroll), ble det observert to proteinbånd, ett glykosylert (17 kda) og ett noe kraftigere uglykosylert (14 kda) proteinbånd for cystatin E/M (Figur 4.3 A). Ved dyrking av M4C-celler med tunikamycin ble det observert bare ett sekrert protein i KM med en molekylvekt på 14 kda tilsvarende uglykosylert (UG) cystatin E/M. Tunikamycin ble ikke fjernet (UG*) før videre inkubering av HCT116-celler med dette KM. Tilsvarende som under figur 4.1A, ble uglykosylert KM produsert ved å bytte medium etter 24 timer for å sikre mest mulig uglykosylerte proteiner i mediet. Immunoblotting av cellelysat fra HCT116-celler viste at cellene uttrykker svært lave endogene nivåer av begge former (14 og 17 kda) av cystatin E/M (Figur 4.3B). Inkubering med normalglykosylert (G) cystatin E/M sekrert fra M4C-celler viste internalisering av begge former i HCT116-cellene. Etter inkubering med fullstendig uglykosylert cystatin E/M og med tilstedeværelse av tunikamycin (UG*) ble det detektert kun ett kraftig proteinbånd på 14 kda intracellulært for uglykosylert cystatin E/M. Etter at tunikamycin ble fjernet (UG), ble også 14 kda proteinbåndet detektert, men proteinbåndet var mye svakere i intensitet sammenliknet med UG*. Dette kan enten skyldes fortynning av KM ved fjerning av tunikamycin på PD10- kolonne eller at tunikamycin har påvirket internaliseringen av cystatin E/M. Kondisjonert medium (KM) etter inkubering av HCT116-cellene ble også høstet og analysert for cystatin E/M ved immunoblotting (Fig. 4.3B). HCT116-celler viste å sekrere svært lave nivåer av cystatin E/M. Etter inkubering med KM-G fra M4C-celler ble begge de sekrerte formene av cystatin E/M detektert og med samme sterke intensitet. Når KM-UG fra M4Cceller ble tilsatt (både UG* og UG), ble det kun sett ett sterkt proteinbånd for uglykosylert cystatin E/M (14 kda). Funnene viste at begge former av cystatin E/M internaliseres i HCT116-celler og at denne prosessen ser ut til å være uavhengig av proteinets glykosyleringsgrad. 37
54 A ) C y s ta tin E /M D M S O G - T u n ik a m y c in - U G * k D a C ) L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in M 4 C -K M - G U G * U G B ) H C T C L H C T K M k D a C y s ta tin E /M G A P D H 3 7 M 4 C -K M - G U G * U G - G U G * U G Figur 4.3. Internalisering av cystatin E/M. A) Serumfritt kondisjonert medium (KM) fra M4C-celler (5 x 10 6 celler/75 cm 2 flaske) ble høstet etter behandling med 1 µg/ml tunikamycin eller DMSO (kontroll; 0,1 %) i 48 timer. Immunoblottet viser uttrykk av fullstendig uglykosylert (UG*; tilstedeværelse av tunikamycin) og delvis glykosylert (G) cystatin E/M i KM. B) HCT116-celler (0,5 x 10 6 celler/brønn) i 6-brønnersbrett ble inkubert i 24 timer ved 37 C med enten serumfritt medium alene (kontroll) eller med 50 % (v/v) M4C-kondisjonert medium (KM) fra A før cellelysat (CL) og kondisjonert medium (KM) ble høstet. Tunikamycin ble fjernet fra UG*-mediet ved hjelp av PD10 Desalting columns (UG). Immunoblott av cystatin E/M-uttrykk i HCT116-cellelysat (CL) og kondisjonert medium etter inkubering, analysert ved gelelektroforese, immunoblotting og fremkalling ved ChemiDoc. GAPDH ble anvendt som housekeeping -kontroll, og det ble påsatt 15 µg totalprotein/brønn av CL etter acetonfelling eller 15 µl av KM. C) Legumainaktivitet (df/sec) i cellelysat fra B ble analysert ved bruk av et spesifikt fluoriserende peptidsubstrat (Z-Ala-Ala-Asn-AMC) og normalisert mot µg totalprotein (df/sec/totalprotein) (n= 1). For å undersøke om internalisert cystatin E/M inhiberte legumainaktiviteten i HCT116-celler, ble aktiviteten målt i cellelysatene. HCT116-kontrollceller hadde en endogen legumainaktivitet på 25 df/sek/µg totalprotein (Figur 4.3C). Inkubering med normalglykosylert (G) cystatin E/M medførte ingen endring i enzymaktivitet, selv om cellene viste opptak (Fig. 4.3B). Når cellene ble inkubert med uglykosylert cystatin E/M 38
55 inneholdende tunikamycin (UG*), ble det observert en 50 % reduksjon i enzymaktivitet. Mens uglykosylert cystatin E/M uten tunikamycin (UG) viste tendens til økning i enzymaktivitet. Dette kan tyde på en egen effekt av tunikamycin. Samlet indikerte dette eksperimentet at begge molekylvektsformer av cystatin E/M blir internalisert i HCT116- celler, men effekten på legumainaktiviteten er uklar og trenger ytterligere studier. 4.2 Opptak og binding av legumainprober (-inhibitorer) til legumain i levende celler Poreba et al. (2016) har nylig beskrevet utvikling og opptak av nye selektive biotinylerte legumainprober (inhibitorer), som kan detekteres etter internalisering og binding til legumain i levende celler [60]. I denne oppgaven ble proben MP-L03 brukt i kap , og i kapittel og er proben MP-L01 brukt. Ulikheten mellom MP-L01 og MP-L03 brukt i denne oppgaven, er at MP-L01 har umetylert, mens MP-L03 har en metylert Asp i P1-posisjon. I tillegg har MP-L03 en større og lipofil aminosyre i P4-posisjon enn MP-L01. Probene er ikke tidligere brukt i vårt laboratorium, og deteksjonen ved immunoblotting ble etablert ved hjelp av et nytt instrument for infrarød laserdeteksjon (Odyssey CLx Near-Infrared Imaging System (Li-Cor)) Proben MP-L03 tas opp og bindes til aktivt legumain i M38L-celler For å etablere metoden for opptak, binding og deteksjon av biotinylerte prober for legumain i levende celler ble proben MP-L03 inkubert med M38L celler i 24 timer. Immunoblotting av cellelysat fra DMSO-behandlede M38L-kontrollceller viste ett svakt proteinbånd for prolegumain (56 kda) og ett intens proteinbånd for den modne formen av legumain (36 kda) (Figur 4.4A; rødt øverste panel og sort/hvitt andre panel). Inkubering med økende konsentrasjoner av MP-L03 viste ett proteinbånd på 36 kda ved inkubering med 10 µm (tredje panel). MP-L03 viste å samlokalisere med legumain og ble farget oransje/gul når blottet ble avlest ved både 700 og 800 nm (øverste panel). Cellene ble høstet direkte i 3X SDS-loading buffer, og det ble påført lik mengde (20 µl) cellelysat ved gelelektroforesen. Immunoblottet viste et omtrentlig jevnt uttrykk av kontrollen GAPDH (36 kda; nederste panel). Resultatet fra immunoblottet viste at MP-L03 ble tatt opp i cellene og bundet til aktivt legumain intracellulært slik tidligere observert, samt at deteksjonsmetoden var etablert i laboratoriet [60]. 39
56 L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in A ) L e g u m a in + M P -L 0 3 k D a 5 0 B ) L e g u m a in M P -L G A P D H 3 7 D M S O M P -L 0 3 ( M ) M P -L 0 3 (µ M ) Figur 4.4. Opptak og binding av legumainproben MP-L03 i M38L-celler. M38L-celler (0,05 x 10 6 celler/brønn) i 24-brønnersbrett ble inkubert i 24 timer med serumfritt medium med legumain-assaybuffer (20 %) og DMSO (0,5 %) alene eller med MP-L03 (1, 10, 25 eller 50 µm) før høsting av cellelysat. A) Immunoblott av cellelysat med uttrykk av legumain og MP-L03, analysert ved hjelp av gelelektroforese, immunoblotting og fremkalling ved Odyssey CLx Near-Infrared Imaging System (Li-Cor). Øverst er legumain detektert rødt (700 nm), streptavidin som detekterer biotinylert MP-L03 farget grønn (800 nm), og samlokalisering vises som gult. GAPDH ble benyttet som housekeeping -kontroll, og det ble påsatt 20 µl cellelysat i 3X SDS-loading buffer. B) Legumainaktivitetsmåling (df/sek) i cellelysat fra A ble analysert ved bruk av et spesifikt fluoriserende peptidsubstrat (Z-Ala-Ala-Asn-AMC) og normalisert mot µg totalprotein (df/sek/totalprotein) (n = 1). For å bekrefte opptak og binding av MP-L03 til aktivt legumain, ble legumainaktiviteten målt i cellelysatene. Ubehandlede M38L-kontrollceller viste endogen legumainaktivitet på omtrent 550 df/sek/µg totalprotein (Figur 4.4B). Konsentrasjoner av MP-L03 opp til 10 µm viste ingen hemming av legumainaktivitet i cellene. Når cellene derimot var behandlet med 25 µm MP-L03, ble det sett en drastisk nedgang på 90 %, og inkubering med 50 µm MP-L03 ga fullstendig hemming av legumainaktiviteten Legumain alene og i kompleks med proben MP-L01 internaliseres i HEK293-celler Etter etablering av deteksjonsmetoden, funn av internalisering av MP-L03 og binding til intracellulært legumain i M38L-celler, var det interessant å undersøke om et kompleks bestående av legumain prebundet til probe kan internaliseres i HEK293-celler. I dette forsøket ble den mest potente proben MP-L01 valgt [60]. 40
57 M38L-cellelysat med mye aktiv legumain ble inkubert, uten og med MP-L01 i 30 minutter. Immunoblotting av inkubatene som ble gitt til HEK293-cellene (Figur 4.5A; Inkubat), viste at M38L-lysatet hadde lite prolegumain (56 kda), men både intermediær (47-46 kda) og moden form av legumain (36 kda). Inkubatet av M38L-MP-L01-komplekset viste lignende observasjoner for legumain som i M38L-lysatet, men viste også samlokalisering med legumain og proben, der den intermediære formen ble farget oransje og den modne formen av legumain ble farget gul. Proben ble også uventet detektert i M38L-cellelysat uten tilsetning (brønn 2), som kan tyde på at fri probe har diffundert under påsetting av gelen og bundet seg til legumain i M38L-cellelysat før gelkjøringen startet. Immunoblotting av HEK293-cellelysat etter inkubering med inkubatene nevnt over (Figur 4.5A; HEK293-CL) viste at HEK293-kontrollceller (DMSO) uttrykte lite prolegumain, men mer moden legumain. Etter inkubering med M38L-lysat alene ble det overraskende ikke observert legumainbånd for den modne formen. Når cellene ble inkubert med MP-L01 alene, ble det observert ett svakt proteinbånd for modent legumain. Etter inkubering med legumain- MP-L01-komplekset ble det med streptavidin detektert ett sterkt proteinbånd på størrelse med modent legumain, selv om ikke legumainantistoffet detekterte noe i denne prøven. Dette resultatet viste for første gang opptak av kompleks med legumain bundet til en inhibitor i levende celler. Legumainaktivitetsmålinger av inkubatene før de ble gitt til HEK293-cellene viste at M38Llysatet hadde enzymaktivitet på df/sek/µg totalprotein, mens aktiviteten var fullstendig inhibert i inkubatet med legumain-mp-l01-komplekset (Figur 4.5B). Etter inkubering med de nevnte inkubatene ble det vist at HEK293-kontrollceller hadde endogen legumainaktivitet på df/sek/µg totalprotein (Figur 4.5C). Inkubering med M38L-lysat alene viste en overraskende signifikant nedgang i enzymaktivitet på 75 %, mens inkubering med MP-L01 alene ikke ga endring i legumainaktivitet. Når cellene derimot ble inkubert med legumain-mp-l01-komplekset, ble det også observert en signifikant reduksjon i aktivitet på 70 %. Resultatene fra denne studien viste overraskende at opptak av både moden legumain (36 kda) fra M38L-cellelysat alene eller i kompleks med probe ga nedsatt legumainaktiviteten i HEK293-cellene. 41
58 A ) In k u b a t H E K C L k D a L e g u m a in + M P -L L e g u m a in M P -L D M S O M 3 8 L -C L M P -L 0 1 (1 M ) B ) C ) L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in D M S O M 3 8 L -C L M P -L 0 1 (1 M ) * * L e g u m a in a k tiv ite t (d F /s e k )/ µ g to ta lp r o te in D M S O M 3 8 L -C L M P -L 0 1 (1 M ) * * Figur 4.5. Cellulært opptak av kompleks av legumain og proben MP-L01. Inkubater med legumain alene (i M38L-lysat), MP-L01 alene, kompleks av legumain (i M38L-lysat) og MP-L01 eller DMSO ble dannet. Alle inneholdt legumain-assaybuffer (15 %) og ble preinkubert i 30 minutter ved 30 C før fortynning i serumfritt medium og tilsetning til cellene. HEK293-celler (0,1 x 10 6 celler/brønn) i 24-brønnersbrett ble inkubert i 24 timer ved 37 C med enten serumfritt medium og DMSO (0,8 %; kontroll), eller med legumain (i M38L-lysat, 0,92 µg/ml), MP-L01 (1 µm), eller kompleks av legumain (i M38L-lysat) og MP-L01 (1 µm) før høsting av cellelysat. A) Et representativt immunoblott av legumain og MP-L01 i inkubatene som ble gitt til cellene (inkubat) og cellelysat (HEK293-CL) etter inkubering og analysert ved hjelp av gelelektroforese, immunoblotting og fremkalling ved Odyssey CLx Near-Infrared Imaging System (Li-Cor), hvor legumain er farget rødt, MP-L01 farget grønn og samlokalisering farget gult/orange (øverste panel). B) Legumainaktivitetsmåling (df/sek) i inkubatene før tilsetning til HEK293-celler og C) legumainaktivitetsmåling (df/sek) i HEK293-cellelysat etter inkubering, målt ved bruk av et spesifikt fluoriserende peptidsubstrat for legumain (Z-Ala-Ala-Asn-AMC) som ble justert mot µg totalprotein (df/sek/totalprotein) og presentert som gjennomsnitt ± SEM (n = 4, * p 0,05 mot kontroll, uparet t-test). 42
59 På grunn av uforventede lave legumainaktivitetsmålinger og visuell observasjon av færre celler i brønner med tilsatt M38L-cellelysat, ble det sett nærmere på totalprotein- og legumainaktivitetsmålinger enkeltvis. Målingene viste at i prøvene der cellene ble inkubert med M38L-cellelysat (M38L-cellelysat og kompleks), var proteinmålingene 60 % redusert, og legumainaktiviteten var omtrent 80 % redusert i de samme prøvene (vedlegg B), noe som tyder på færre levende celler/brønn Internalisering av renset bovint legumain, MP-L01 og legumain-mp- L01-kompleks Det var videre ønskelig å binde proben MP-L01 til renset aktivt legumain, og undersøke om dette komplekset også kunne internaliseres i HEK293-celler. Til dette ble bovint legumain brukt, som tidligere var renset fra kalvenyrer i laboratoriet etter protokoll fra Yamane et al. [61]. Immunoblott av legumain-mp-l01-kompleks viste å samlokalisere med legumain. Både MP- L01- og legumainbånd for moden form (36 kda) viste et grønt/gult kraftig proteinbånd (Figur 4.6A; første panel). Det vistes også et overraskende legumainbånd med 25 kda, men proteinbåndet på 25 kda var svakere ved legumainuttrykket (farget grått, andre panel). Immunoblotting av ubehandlede HEK293-celler viste som tidligere (Figur 4.5A) både proformen (56 kda) og moden form av legumain (36 kda) (Figur 4.6B; kontroll; brønn 1, farget rød i øverste panel). Celleinkubering med renset bovint legumain (36 kda) alene førte til sterkere båndintensitet for moden form (brønn 2), og viste opptak av legumain i cellene. Inkubering med 0,5 µm og 2,5 µm MP-L01 alene ga ikke synlig opptak i cellene (brønn 3 og 4, tredje panel). Inkubering med 50 µm MP-L01 alene viste derimot et svakt proteinbånd for MP-L01 (brønn 5), og viste at proben var tatt opp og bundet til endogent legumain i HEK293- celler (samlokalisering farget gult i øverste panel, brønn 5). 43
60 A ) k D a B ) k D a 5 0 L e g u m a in + M P -L L e g u m a in + M P -L L e g u m a in 3 7 L e g u m a in M P -L G A P D H 3 7 D M S O M P -L L e g u m a in (µ M ) M P -L 0 1 (µ M ) - - 0,5 2, K o m p le k s (µ M ) ,5 2, Figur 4.6. Både renset bovint legumain, MP-L01 og kompleks internaliseres. Inkubater av legumain (renset bovint legumain), MP-L01, kompleks med legumain og MP-L01 og DMSO ble dannet. Alle inneholdt legumainassaybuffer og ble preinkubert i 30 minutter ved 30 C før fortynning i serumfritt medium og tilsetning til cellene. HEK293-celler (0,05 x 10 6 celler/brønn) i 48-brønnersbrett ble inkubert med serumfritt medium med legumain assaybuffer ( 15 %) og DMSO (0,5 %) alene (kontroll), eller med enten legumain alene (renset bovint legumain; 10 µm), MP-L01 alene (0.5-2,5 eller 50 µm), eller kompleks av legumain bundet til MP-L01 (0,5-2, µm) i 24 timer ved 37 C før høsting av cellelysat. A) Immunoblott av legumain-mp-l01 kompleks og B) immunoblott av cellelysat viser uttrykk av legumain (rød; øverste panel), MP-L01 (grønn), samt samlokalisering av legumain og MP-L01 (gult). Blottet ble analysert ved bruk av gelelektroforese, immunoblotting og fremkalling ved Odyssey CLx Near-Infrared Imaging System (Li-Cor). GAPDH ble brukt som housekeeping -kontroll, og det ble påsatt 20 µl cellelysat/brønn (n=1). Etter celleinkubering med preformet kompleks av renset legumain bundet til MP-L01 viste immunoblotting av cellelysatene at komplekset ble internalisert ved alle konsentrasjoner av proben (0,5-2,5-5 og 10 µm; Figur 4.6). Dette ble observert som økende intensitet i proteinbånd for både legumain (brønn 6-9; andre panel), MP-L01 (tredje panel) og samlokalisering (gult, øverste panel). Ved tilsetning av kompleks med probekonsentrasjonene 5 µm og 10 µm ble cellemediet visuelt endret fra rødt til gult. I lysatene etter inkubering med komplekset ble det i tillegg observert ett bånd med molekylvekt 25 kda og detektert hovedsakelig for MP-L01, men svakere for legumain (brønn 6-9). For å få bekreftet at lik mengde totalprotein ble påsatt i gelelektroforesen, ble GAPDH (36 kda) benyttet (nederste panel). Funn fra immunoblotting viste at aktivt renset bovint legumain ble internalisert både alene og i komplekset med MP-L01. 44
61 4.2.4 Dyngo-4a reduserer opptaket av MP-L01, men påvirker ikke internalisering av legumain Det er tidligere beskrevet i litteraturen at endocytosehemmeren Dyngo-4a inhiberer klatrinmediert endocytose [33, 66], men det ble i denne oppgaven sett at Dyngo-4a ikke påvirket opptaket av prolegumain (kapittel 4.1.1). Det var derfor interessant å undersøke om opptaket av aktivt modent renset legumain alene eller bundet i kompleks med proben MP- L01, ble påvirket av tilstedeværelsen av Dyngo-4a. HEK293-celler ble inkubert uten og med renset legumain alene, MP-L01 alene og kompleks. Immunoblotting av cellelysatene etter inkubering viste ingen forskjell mellom ubehandlede og Dyngo-4a-behandlede kontrollceller (Figur 4.7; brønn 1 og 2). Når HEK293-cellene ble inkubert med renset bovint legumain (36 kda) alene, ble det sett ett kraftig bånd for den modne formen av legumain (brønn 3), som bekreftet internalisering (figur 4.6). I tillegg ble det også her observert ett legumainbånd på 25 kda (brønn 3). Tilsvarende legumainbånd ble sett etter celleinkubering med renset bovint legumain etter forbehandling med Dyngo-4a (brønn 4). Når HEK293-cellene ble inkubert med 50 µm MP-L01 alene, ble det igjen sett opptak og samlokalisering med den modne formen av legumain (brønn 5). Ved forbehandling med Dyngo-4a før tilsetning av MP-L01 ble det observert mindre intracellulært, både modent legumain og MP-L01 (brønn 6). Etter inkubering av HEK293-cellene med kompleksbundet legumain og MP-L01 ble det overraskende sett mindre prolegumain i lysatet, men mer moden legumain (36 kda) enn i kontrollen (brønn 7, andre panel). Ved deteksjon av både legumain og probe (brønn 7, øverste panel) ble 36 kda-båndet farget kraftig gult/grønt, samt ett proteinbånd med molekylvekt 25 kda. Det ble også her som i figur 4.6 observert at begge proteinbåndene (36 og 25 kda) ble kraftigere etter samtidig behandling med Dyngo-4a (brønn 8). Det ble påført likt volum (20 µl) av cellelysat i alle brønnene etter direkte høsting av cellelysat i 3X SDS-loading buffer, og kontrollen GAPDH (36 kda) viste en jevn påføring (Figur 4.7A, nederste panel). Resultater viste at Dyngo-4a reduserte opptaket av MP-L01 og økte opptaket av komplekset, mens internalisering av renset legumain alene ikke ble påvirket. Funnene kan tyde på at probe internaliseres via klatrinmediert endocytose, mens opptak av modent legumain eller komplekset ikke gjør det. 45
62 A ) k D a 5 0 L e g u m a in + M P -L L e g u m a in M P -L G A P D H 3 7 D y n g o -4 a (5 0 µ M ) L e g u m a in (1 0 µ M ) M P -L 0 1 (5 0 µ M ) K o m p le k s (2,5 µ M ) D M S O B) Legumainaktivitet (df/sek)/ µg totalprotein DMSO Dyngo-4a (50 µm) Legumain (10 µm) MP-L01 (50 µm) Kompleks (2,5 µm) Figur 4.7. Internalisering av renset bovint legumain, proben MP-L01 og komplekset uten og med tilstedeværende endocytosehemmeren Dyngo-4a. Inkubater med MP-L01 og legumain assaybuffer (15 %) ble dannet og inkubert i 30 minutter ved 30 C før fortynning i serumfritt medium og eksponering av cellene. HEK293-celler (0,05 x 10 6 celler/brønn) i 48-brønnersbrett ble inkubert med serumfritt medium med enten DMSO (0,5 %) eller endocytosehemmeren Dyngo-4a (50 µm) i én time ved 37 C. Deretter ble cellene eksponert og inkubert med enten serumfritt medium, renset bovint legumain (10 µm) alene, MP-L01 (50 µm) alene eller et kompleks av legumain (2,5 µm) og MP-L01 (2,5 µm) i 24 timer før høsting. A) Et representativt immunoblott av 46
63 legumain (rød; øverst), MP-L01 (grønn; øverst) og kompleks (gul; øverst) i cellelysat ble analysert ved bruk av gelelektroforese, immunoblotting og fremkalling ved Odyssey CLx Near-Infrared Imaging System (Li-Cor). GAPDH ble anvendt som housekeeping -kontroll, og det ble påsatt 20 µl cellelysat/brønn. B) Legumainaktivitet (df/sek) ble målt i cellelysat etter bruk av et spesifikt fluoriserende peptidsubstrat (Z-Ala- Ala-Asn-AMC) og normalisert mot µg totalprotein (df/sek/protein) (n = 3). Ubehandlede HEK293-kontrollceller hadde en endogen legumainaktivitet på df/sek/µg totalprotein (Figur 4.7B). Dyngo-4a alene viste å hemme legumainaktivitet i cellelysatet med 60 % sammenliknet med kontroll. Celler som ble tilsatt renset bovint legumain medførte en overraskende 25 % nedgang i legumainaktivitet, til tross for omfattende opptak av moden form sett ved immunoblotting (figur 4.7A). Inkubering med renset bovint legumain sammen med Dyngo-4a resulterte i en ytterligere reduksjon (totalt 60 %) mot kontrollen i enzymaktivitet. Inkubering med 50 µm MP-L01, både med og uten Dyngo-4a til stede, ga ingen detekterbar legumainaktivitet. Tilsetning av legumain-mp-l01-kompleks medførte også en 60 % reduksjon i legumainaktivitet sammenliknet med kontrollen. Inkubering med kompleks sammen med Dyngo-4a ga bare omtrent 10 % legumainaktivitet, det vil si 90 % hemming, men ingen av endringene i legumainaktivitet var signifikante. Aktivitetsdataene kan tyde overraskende på at MP-L01 ikke internaliseres via klatrinmediert endocytose siden det ble observert total hemming av legumainaktiviteten uavhengig av om Dyngo-4a var til stede eller ikke (figur 4.7B), til tross for motstridende funn ved immunoblotting (figur 4.7A). 47
64 48
65 5 Diskusjon Den lysosomale cysteinproteasen legumain er overuttrykt i flere humane maligne svulster, som blant annet tykktarm-, bryst- og prostatakreft, samt i assosierte endotelceller og tumorassosierte makrofager (TAMs) [18, 20, 57, 67]. Det er kjent at proformen av legumain sekreres av kreftceller og av TAMs til tumormikromiljøet [67, 68], men mye er fremdeles uklart rundt reguleringen av sekresjonen. Oppregulering av legumain i kreftsammenheng er assosiert med metastase, invasjon og dårlig prognose [20]. I dagens kreftbehandling er metastase en stor utfordring og en hovedårsak til kreftrelatert dødsfall [69]. Cysteinproteaser (eksempelvis legumain) er foreslått som lovende kandidater til utviklingen av spesifikke proteaseaktiverte prodrugs i kreftterapi [20]. To tidligere masterstudenter i farmasi, Ingrid Damgaard og Roya Kasem, har vist at N-bundet glykosylering spiller en viktig rolle både for transport og prosessering av legumain [35, 39]. Denne studien ble igangsatt for videre å undersøke viktigheten av glykosylering i lys av sekresjon og cellulært opptak av legumain. I tillegg ble mekanismen for internaliseringen studert, samt opptak og effekt av cystatin E/M, den mest potente endogene inhibitoren av legumain. Det ble også studert internalisering og aktivitet av modent legumain alene og bundet med syntetiske inhibitorer. I denne studien viser vi helt nye funn for betydningen av glykosylering og cellulært opptak av legumain og cystatin E/M. Glykosylering av prolegumain er nødvendig for autoaktivering til moden aktiv form etter internalisering. Det er for første gang demonstrert at en selektiv probe kan bindes i kompleks med legumain før celleeksponering og at komplekset tas opp og detekteres i levende celler, samt at det for første gang ble observert at modent legumain internaliseres. 5.1 Valg av cellemodeller I dagens samfunn øker forekomsten av tykktarmskreft [46], og det har blitt utført flere studier av legumainuttrykket i kolorektalkreftcellelinjer der det trekkes sammenhenger med økte invasive og metastatiske egenskaper [20]. To forskjellige kolorektalkreftcellelinjer ble brukt i denne studien, HCT116 og SW620. HCT116-celler er en cellelinje som hovedsakelig uttrykker aktivt modent legumain (36 kda) og sekrerer prolegumain (56 kda), samt har et lavt uttrykk av cystatin E/M (14/17 kda) [18]. 49
66 For SW620-celler er det motsatt tilfelle, der cellene uttrykker høye nivåer av prolegumain og lave nivåer av aktiv moden form [18]. HCT116- og SW620-celler ble anvendt som kreftcellemodeller. Det ble også brukt HEK293-celler, som er en transformert adherent embryonal nyreepitelcellelinje med et lavt uttrykk og sekresjon av legumain. HEK293-celler er en attraktiv cellelinje i forbindelse med forskning, da de er lette å dyrke og vokser raskt. Det ble i tillegg brukt to monoklonale transfekterte HEK293-cellelinjer tidligere laget i laboratoriet, én som overuttrykker legumain (M38L) og én som overuttrykker cystatin E/M (M4C) [23]. HEK293-celler og transfekterte HEK293-celler ble både brukt som modellceller og som kilder for henholdsvis legumain (M38L) og cystatin E/M (M4C). 5.2 Valg av tunikamycinkonsentrasjon og effekter I denne studien var det behov for å produsere uglykosylerte proteiner for å kunne sammenlikne internalisering og funksjon med normalt glykosylerte proteiner. For at N- glykosylering skal finne sted på aminosyren asparagin, kreves det en bestemt sekvens, Asn-X- S/T. I legumain og cystatin E/M sees denne sekvensen respektivt fire og én ganger [8, 22]. Fordeler ved bruk av tunikamycin er at stoffet spesifikt hemmer N-bundet glykosylering som begge målproteinene (legumain og cystatin E/M) har. På bakgrunn av funn fra tidligere masterstudenter i farmasi [35, 39] ble konsentrasjonen 1 µg/ml av tunikamycin valgt for å produsere uglykosylerte proteiner. Masterstudent Ingrid Damgaard viste at tunikamycinbehandling resulterte i intracellulær akkumulering av proformen, men ingen detekterbar moden form og at inhibering av glykosyleringen har effekt på modningsprosessen til legumain. Mulige årsaker til opphopning av proformen er endret legumaintransport der uglykosylert prolegumain etter syntese i ER ikke blir transportert til lysosomene, eller at legumain blir transportert til lysosomene, men ikke prosessert til moden form når proteasen ikke er glykosylert. Etter celleinkubering av SW620- og HCT116-celler med 1 µg/ml tunikamycin ble det observert to proteinbånd for legumain, men for M38L-celler bare ett intenst legumainbånd med molekylvekt 47 kda, sannsynligvis helt eller delvis uglykosylert prolegumain. Det ble også observert ett kraftig proteinbånd for uglykosylert cystatin E/M med molekylvekt på 14 kda i M4C-celler. Noen viktige faktorer å legge merke til er tiden det tar for at det skal 50
67 produseres uglykosylerte proteiner som erstatter de endogene glykoproteinene, samt effektivitet og stabilitet av tunikamycin. En ulempe var at det ble observert at bruksløsning av tunikamycin ble mindre effektiv over tid etter lagring. Eksempelvis ble effekten dårligere en måned etter oppløsning. Disse faktorene kan medføre at det bare delvis dannes uglykosylerte proteiner. Generelt ble det observert færre adherente celler etter inkubering med tunikamycin. Morfologisk endret cellene seg ved at de klumpet seg sammen og ble rundere, samt at en del celler løsnet og døde sammenliknet med kontrollcellene. Dette var trolig fordi at cellene opplever ER-stress med tunikamycin, slik at ER kan svare med en forsvarsmekanisme som igangsetter apoptose [45]. 5.3 Glykosylering av legumain Det er tidligere vist at N-bundet glykosylering spiller en viktig rolle, både for transport til lysosomene og aktivitet av legumain [35, 39]. Denne studien ble igangsatt for videre å undersøke betydningen av glykosylering av prolegumain i forhold til prosesser som sekresjon og cellulært opptak, samt mekanismen for internalisering og intracellulær prosessering til moden form etter opptak Internalisering og transport av glykosylert prolegumain Det kan antas at det hele tiden foregår produksjon, sekresjon og internalisering av legumain i celler og at denne prosessen foreligger i en likevekt. Prolegumain er kjent å være en svært stabil legumainform ved nøytral ph (ph 7) [26]. Tidligere studier som vår forskningsgruppe har publisert, har vist at HEK293-celler kan internalisere og aktivere normalt glykosylert prolegumain som er sekrert fra legumainoveruttrykte HEK293-celler (M38L) [23]. Dette ble bekreftet i denne studien, og i tillegg ble det vist at HEK293-celler også kan internalisere glykosylert prolegumain (56 kda) sekrert fra andre cellelinjer, slik som kolorektalcellelinjene HCT116 og SW620. Prolegumain ble tatt opp, i tillegg til at det ble sett mer av den aktive modne formen av legumain sammenliknet med endogent legumain i HEK293-celler. Dette kan forklares ved økt internalisering av prolegumain som var rikelig tilgjengelig i mediet gitt til cellene, samt at proformen er stabil i mediet og ikke degraderes. Økt mengde moden form av legumain kan forklares med økt internalisering av prolegumain. Internalisering av 51
68 prolegumain vil føre til at mer prolegumain transporteres til lysosomer som er en forutsetnings for at det dannes moden aktiv form, og at det derfor finner sted en økt prosessering til moden form intracellulært. Figur 5.1. Illustrert oversikt av mannose-6-fosfatveien. Forløpere til lysosomale enzymer (rosa) transporteres fra rer til cis-golgi-nettverket der mannosestrukturen i enzymene fosforyleres. I trans-golgi-nettverket bindes fosforylerte enzymer til mannose-6-fosfat-reseptor (M6FR). Fosforylert enzym bundet til M6FR transporteres i klatrinmedierte vesikler til endosomene. I endosomene dissosierer enzymet fra M6FR og fosforyleringen fjernes før enzymet translokeres til lysosomene. I trans-golgi-nettverket sorteres sekretoriske proteiner (blå) og sekreres ved eksocytose. M6FR er også funnet på plasmamembranen, og reseptoren binder sekrerte fosforylerte lysosomale enzymer. Enzymer bundet til M6FR på celleoverflaten internaliseres via klatrinmediert endocytose til lysosomene. Figuren er hentet fra Lodish et al., (figur 17-40, 2000) [70]. Økt internalisering av prolegumain resulterte ikke i alle tilfellene til økt aktivitet. Internalisering av glykosylert prolegumain fra HCT116- og SW620-KM i HEK293-celler ga ingen signifikant økning i legumainaktivitet. Dette kan skyldes at HCT116- og SW620-52
69 cellene har omtrentlig tilsvarende nivåer med sekrert prolegumain i kondisjonert medium som HEK293-celler. Internalisering av glykosylert prolegumain fra M38L-KM resulterte derimot i økt prosessering av moden legumain sett ved immunoblotting, og dette gjenspeilte seg i økt legumainaktivitet. Det ble sett en 60 % økning i legumainaktivitet, men endringen var ikke signifikant. En viktig faktor å legge merke til i dette tilfellet er at de sekrerte nivåene av prolegumain i M38L-KM er betydelig høyere (2000 %, data ikke vist) sammenliknet med KM fra SW620- og HCT116-celler. Hovedhypotesen for legumaintransport er at normalprodusert glykosylert prolegumain sendes til lysosomene via mannose-6-fosfatveien (figur 5.1) [71]. Legumain har fire kjente N- glykosyleringsseter som kan målrette enzymet via mannose-6-fosfat-reseptoren (M6FR) [8]. Det er likevel sett at prolegumain sekreres fra celler og finnes i kondisjonert mediet [23, 72]. Hvordan lysosomale proteiner kan sekreres, er ikke fullstendig klarlagt. Det kan spekuleres i om celler som sekrerer prolegumain mangler eller har lav kapasitet av M6FR, slik at prolegumain ikke sendes til lysosomene og derfor sekreres ut av cellen. Eller det kan skyldes at prolegumain mangler mannose-6-fosfat-motiv (M6F) og at det derfor ikke finner sted noen M6FR-M6F interaksjon. I denne studien ble det vist at sekrert glykosylert prolegumain internaliseres i levende celler, og det kan dermed forklare at prolegumain mest sannsynlig har et fungerende M6F som antakeligvis trigger mannose-6-fosfatmediert endocytose Internalisering og transport av uglykosylert prolegumain I tidligere studier i vårt laboratorium ble det sett at når prolegumain og moden legumain ikke er glykosylert, så påvirker dette prosessering, aktivitet og stabilitet av legumain [35, 39]. I denne studien ble det observert at delvis uglykosylert prolegumain ( 47 kda) sekrert fra HCT116-, SW620- og M38L ble internalisert i HEK293-celler, men det ble ikke sett opptak av fullstendig uglykosylert prolegumain (47 kda). Opptak av delvis uglykosylert prolegumain skyldes trolig at cellenes opptaksmekanismer kan ta opp prolegumain som har noen intakte sukkermolekyler og at det er sukkermolekylene som kan fremme internaliseringen. Som nevnt over så kan en mulig opptaksmekanisme for glykosylerte proteiner være at de binder M6FR på celleoverflaten og at denne reseptorbindingen trigger klatrinmediert endocytose som sender vesikkelen til lysosomene (figur 5.1) [71]. For at klatrinmediert endocytose skal finne sted, kreves det at opptakscellen har mannose-6-fosfat-reseptor på celleoverflaten, i tillegg til at målproteinet krever et mannose-6-fosfatmotiv for å kunne bindes til reseptoren. I denne 53
70 studien ble det ikke observert opptak av fullstendig uglykosylert prolegumain (47 kda). Dette kan trolig skyldes at uglykosylert prolegumain mangler M6F og derfor ikke internaliseres via mannose-6-fosfatveien. Fullstendig mekanisme for å forstå hvordan legumain som primært er et lysosomalt protein sekreres og deretter internaliseres trenger ytterligere studier. Til forskjell fra det som ble observert etter internalisering av glykosylert prolegumain, ble det ikke observert at uglykosylert prolegumain ble prosessert til moden aktiv uglykosylert form. Det er antatt at glykosylering er viktig for transport til lysosomene, som er et viktig modningssted for prolegumain [73]. Antakeligvis vil manglende N-bundet glykosylering endre transporten av uglykosylert prolegumain, slik at uglykosylert prolegumain hindres i å nå det lysosomale systemet for aktivering og modning. Det kan også tenkes at uglykosylert prolegumain blir transportert til lysosomene, men at den ikke prosesseres til moden form hvis uglykosylert form ikke gjenkjennes av proteaser som er ansvarlige siste trinn i prosesseringen. Lokaliseringen av aktiv legumain er ikke bare observert å være lysosomal, for enzymet er også observert både ekstracellulært og i cellekjernen [18, 20]. Om glykosylering av legumain eller binding til integriner på celleoverflaten spiller noen rolle for transport av legumain til andre celleområder, er fremdeles ikke klarlagt. Det kan spekuleres i om cellene ikke er i stand til å glykosylere internalisert uglykosylert prolegumain fordi uglykosylert prolegumain trolig ikke når ER og Golgi-apparatet, og derfor ikke blir sendt via mannose-6-fosfatveien til lysosomene. Internalisert uglykosylert prolegumain kunne tenkes å hope seg opp i cytosol, selv om den uglykosylerte formen ikke ble observert i denne studien. En forklaring på dette kan være fordi proteasen ikke transporteres til noe bestemt mål og at uglykosylert prolegumain derfor raskt degraderes og dermed ikke detektertes. Inkubering med uglykosylert prolegumain i HEK293-celler medførte en signifikant reduksjon i intracellulær legumainaktivitet, og dette funnet samsvarer med at nivåene av modent legumain ble redusert. Dersom hypotesen er riktig om at uglykosylert prolegumain tas opp og raskt degraderes, så kan det tenkes at det oppstår konkurranse om opptaket av endogent glykosylert prolegumain. Hvilken opptaksmekanisme som finner sted for opptak av uglykosylert prolegumain hvis det ikke er binding til M6FR trenger ytterligere undersøkelser. Som nevnt over ble det ikke sett opptak av fullstendig uglykosylert prolegumain. N- glykosylert legumain er derfor nødvendig for internalisering og prosessering til moden form i 54
71 cellene, da det ikke ble observert moden eller aktiv uglykosylert legumain i cellene etter inkubering med uglykosylerte proteiner. 5.4 Internalisering av cystatin E/M og effekt av glykosylering Tidligere studier har vist at den mest potente endogene legumaininhibitoren cystatin E/M sekreres både som en glykosylert form (17 kda) og en uglykosylert form (14 kda), der begge former internaliseres i celler og er i stand til å inhibere legumain [22, 23]. Cystatin E/M har kun ett kjent glykosyleringssete og tilsvarende som for legumain er glykosyleringen N-bundet [22, 23]. I denne undersøkelsen ble det observert at begge former av cystatin E/M internaliseres i HCT116-celler, men 17 kda-formen noe mindre. Det ser derfor ut til at glykosylering av cystatin E/M ikke har betydning for internaliseringen av inhibitoren. En mulig årsak til dette kan være at cystatin E/M ikke internaliseres via mannose-6-fosfat-veien. Uventet ble ikke legumainaktiviteten påvirket etter opptak av hverken normalt glykosylert (17/14 kda) eller uglykosylert (14 kda) cystatin E/M slik tidligere studie har vist [23]. Årsaker til at legumainaktiviteten ikke var påvirket, kan skyldes at cystatin E/M også er vist å kunne være et substrat for legumain [26]. Det kan derfor tenkes at konsentrasjonen av cystatin E/M ikke er tilstrekkelig for å inhibere legumainaktiviteten. Det kan også skyldes at cystatin E/M har bundet seg til andre enzymer intracellulært, slik som cathepsiner [74]. Eksempelvis er cathepsin S og L (begge har Ki i nm-området) [74]. I dette tilfellet trengs det ytterligere studier av hvorfor internalisert cystatin E/M ikke påvirker legumainaktivitet. 5.5 Legumain og endocytose Smith et al. (2012) har tidligere vist at prolegumain utskilt fra M38L-celler tas opp og aktiveres i celler som uttrykker lite legumain [23], dette ble også sett i denne studien, men opptaksmekanismen for prolegumain er ikke kjent. Mekanismen for internalisering av legumain ble videre undersøkt. 55
72 5.5.1 Valg av endocytoseinhibitor Dyngo-4a er beskrevet som en hemmer av dynamin som er viktig for dannelsen av klatrinmediert endocytostisk vesikkel [32]. Etter beskrivelse i litteraturen [32, 75] og på bakgrunn av erfaringer ved bruk i vår forskningsgruppe, ble dynamininhibitoren Dyngo-4a valgt. Dyngo-4a har høy potens i dynamininhibering, med brukskonsentrasjon 50 µm [76] Effekter av endocytoseinhibitoren Dyngo-4a Resultatene fra internaliseringsstudien viste at glykosylering er nødvendig for prolegumain, men ikke for internalisering av cystatin E/M. Det var ønskelig å studere mekanismene for internalisering til legumain og cystatin E/M. Det ble observert en uventende kraftig opphopning av proform og mindre prosessering av modent legumain etter inkubering med Dyngo-4a. Opptak, men mindre prosessering, tyder på at prolegumain internaliseres via en annen mekanisme enn klatrinmediert endocytose, og at Dyngo-4a i tillegg har andre effekter enn å hemme endocytose. Det er beskrevet i litteraturen at Dyngo-4a i tillegg til å være en dynamininhibitor også er en inhibitor av vakuolær H + -ATP-ase (V-ATP-ase) [77]. Ved å hemme V-ATP-aser vil strømmen av protoner over membranen inn til vesiklene stoppe opp og medføre økning i ph. Når ph økes, vil dette kunne inhibere prosessering av prolegumain til moden legumain, samt gi en opphopning av prolegumain. Dette kan være en mulig forklaring på hvorfor det ble sett økt mengde prolegumain og redusert aktivt modent legumain etter internalisering av prolegumain når Dyngo-4a var til stede. I tidligere studier som forskningsgruppen vår har utført med fokus på transport over vesikkelmembranen, ble bafilomycin A1 brukt for å øke sekresjonen i celler. Det ble sett at bafilomycin A1 påvirket lysosomene, og det ble observert økt sekresjon av prolegumain [23]. Bafilomycin A1 er en V-ATP-ase-inhibitor som resulterer i økt ph i lysosomene. Det er også sett at Dynasore påvirker dynaminuavhengige prosesser, som å redusere plasmamembrankolesterol, inhiberer membran ruffling som er dannelse av aktinnettverk i vesikler, samt mobilitet av cellemembranen [78]. Det kan antas at Dyngo-4a har tilsvarende egenskaper som Dynasore. Internaliseringen av prolegumain skyldes trolig mekanismer som er uavhengige av dynamin og aktin. 56
73 I stedet ble det ved immunoblotting sett at Dyngo-4a reduserte opptaket av den legumainselektive proben MP-L01 (50 µm), og det ble antatt at proben internaliseres via klatrinmediert endocytose. MP-L01 er et lite molekyl sammenliknet med prolegumain. Inkubering av MP-L01 (50 µm) både med og uten Dyngo-4a viste hemmet legumainaktivitet. Dette kan bety at MP-L01 internaliseres i celler selv med Dyngo-4a til stede, og at probe ikke internaliseres via klatrinmediert endocytose. Om hemming av legumainaktivitet skyldes internalisering av fri MP-L01 eller er en effekt av Dyngo-4a, trenger ytterligere studier. I denne studien ble noen av cellelysatene fra de Dyngo-4a-eksponerte cellene farget lysebrune ved høsting med lysisbuffer og cellene satt godt fast i cellebrettet. Den lysebrune fargen kan komme av at Dyngo-4a løsningen opprinnelig er gul, slik at cellene kan internalisere gulfargen. Men hvorfor cellene satt bedre fast, er ikke kjent. 5.6 Bruk av legumainprobe Det er flere forskningsgrupper som har utviklet aktivitetsbaserte prober der målet er å selektivt binde legumain for å kunne detektere komplekset etter binding. Deteksjonen av probe med målprotein skyldes ofte at proben er merket med fluorescerbare substanser. Etter etablering av et samarbeid med forskningsgrupper i Wroclaw (Polen) og San Diego (USA), så fikk laboratoriet tilgjengelig nye syntetiske legumainselektiv prober [60], og i denne studien ble probene MP-L01 og L03 anvendt. Det er vist at probene binder selektivt til legumain og ikke til caspaser [60]. Fordeler ved bruk av probene er at de er legumainselektive, bindes irreversibelt, inhiberer aktivitet og kan detekteres. MP-L01 og L03 er biotinmerket (Nterminalt) som muliggjør deteksjon med streptavidin. Ved bruk av streptavidin ved immunoblotting og fremkalling med Odyssey CLx Near-Infrared Imaging System, kan probene detekteres fordi streptavidin er merket med infrarød fluorescence (800 nm; grønt). Både sekundærantistoffet som detekterer legumain (700 nm; rødt) og samlokalisering (gult signal) kan derfor detekteres i samme immunoblott. For å studere opptak av fri probe i levende celler ble konsentrasjonene 50 µm fri probe anvendt på bakgrunn av tidligere observasjoner [60]. Det ble etter en titrering sett at 10 µm fri probe var nok for å detektere opptak. Basert på titrering av kompleks med probe bundet til legumain, ble 2,5 µm kompleks (1:1) benyttet i videre forsøk. 57
74 En ulempe ved bruk av biotinylerte prober er at det med streptavidin detekteres uspesifikke biotinylerte proteiner ( 80 kda) [60]. En fordel er dog at målproteinene som studeres ved immunoblotting har molekylvekter som er godt separert fra de endogene biotinylerte proteinene. Det kan stilles spørsmål ved anvendbarheten av MP-probene. Eksempelvis for deteksjon av biotinylert probe med streptavidin i hele celler eller vev, vil det ikke kunne skilles mellom probe bundet til målprotein eller endogene biotinylerte proteiner. Edgington et al. (2012) har utviklet en aktivitetsbasert probe, LE28, som kun fluorescerer ved kovalent binding til aktivt legumain, grunnet et skifte i fluorescens [59]. Fordeler ved bruk av LE28 er at den er legumainselektiv og kan detekteres i hele celler og vev [59]. Ulempe ved bruk av LE28 er at proben viste å binde til caspaser i cellelysat [59]. I denne studien ble det sett opptak av 10 µm fri MP-L03 probe i M38L-celler, og proben ble observert sammen med legumain (36 kda), grunnet selektiv binding til aktiv legumainform. Internalisert probe inhiberte ikke legumainaktiviteten før en tilsatt konsentrasjon på nærmere 25 µm. Det at 10 µm tas opp i cellene, men ikke påvirker legumainaktiviteten, kan skyldes at M38L-celler har så høyt intracellulært legumainnivå at inhiberingen ikke utgjør målbare endringer i legumainaktivitet. Det kan spekuleres i om proben bare er bundet til legumain intracellulært, eller om probe kan være bundet på celleoverflaten eller til dyrkningsplasten. Siden prolegumain sekreres, kan det tenkes at prolegumain også aktiveres ekstracellulært og at fri probe dermed bindes til aktivt legumain. Dette er likevel ikke sannsynlig siden ph i mediet ikke er optimalt for at prolegumain skal kunne prosesseres til moden form. Det er vist at legumain kan bindes til integrin α5β3 på celleoverflaten, samt at denne bindingen stabiliserer legumain og kan medføre aktivering til moden form under mindre sure betingelser (ph > 4) [79]. I litteraturen er det beskrevet at HEK293L-celler (overuttrykker legumain) har et lavt uttrykk av integrin α5β3 på celleoverflaten [79], og det kan derfor antas at det er det samme tilfellet med HEK293-cellene anvendt i denne studien. En mulig internaliseringsmekanisme for fri probe kan være via klatrinmediert endocytose, fordi det ble observert redusert internalisering av fri probe ved samtidig inkubering med Dyngo-4a. Det er mulighet for at proben kan være bundet til celleoverflaten eller til plasten i cellebrettet før cellelysering. Ved lysering kan proben så bindes til intracellulær legumain. I denne studien ble cellene høstet direkte i 3X SDS-loading buffer (med DTT), og denne høstebufferen fryser cellene i status quo, og denaturerer legumain slik at det ikke kan finne 58
75 sted binding av probe etter lysering. Dermed må detektert probe ha bundet legumain før lysering. Denne studien viste at renset bovint aktiv legumain (36 kda) alene eller i et kompleks med proben MP-L01 internaliseres i HEK293-celler. Det ble i tillegg vist at en legumainform på 25 kda både alene og bundet til probe eksisterer og internaliseres. Det er viktig å legge merke til at komplekset internaliseres ved alle konsentrasjoner (0,5 10 µm) i forhold til fri probe alene (10 µm). Dette funnet tyder på at proben lettere internaliseres etter binding til legumain og ved en annen mekanisme enn fri probe. Internalisering av legumain-probe-kompleks ble ikke hemmet av Dyngo-4a, og dette tyder på at komplekset ikke internaliseres via klatrinmediert endocytose, og det kan antas at mekanismen for internaliseringen av kompleks og prolegumain er den samme. Det ble observert at legumainaktiviteten i cellelysat etter inkubering med kompleks (2,5 µm) ble redusert. Redusert legumainaktivitet forklares ved at proben bindes irreversibelt til legumain og hemmer enzymaktiviteten. Det kan tenkes at legumain-probe-komplekset tas opp via samme mekanisme og i konkurranse med normalsekrert prolegumain. Siden konsentrasjonen av kompleks er høyere enn prolegumain i mediet, så kan opptak av komplekset favoriseres. Derfor vil det kunne bli lavere intracellulære nivåer med aktivt legumain på grunn av mindre prosessering av prolegumain. En viktig faktor å legge merke til er at forholdet mellom probe og bovint legumain i komplekset mest sannsynlig ikke foreligger i et 1:1 forhold (2,5 µm), slik at det i tillegg kan skje opptak av enten mer aktivt bovint legumain eller fri probe alene. Det at aktiviteten likevel ikke økte hvis det er tilsatt mer renset bovint legumain, kan skyldes at ph i mediet (ph 7) denaturer det aktive enzymet. Modent aktivt legumain er ustabilt i kondisjonert medium og vil raskt kunne degraderes ved ph 6.0 [26]. Dermed kan renset aktivt bovint legumain som ikke er bundet med probe bli degradert eller inaktivt og derfor ikke endre legumainaktiviteten etter internalisering. Årsakene til at komplekset mest sannsynlig ikke foreligger i et ekvimolart forhold, kan skyldes at konsentrasjonen av renset bovint legumain ikke nødvendigvis er nøyaktig 275 µm. Konsentrasjonen av renset bovint legumain ble antatt å være 275 µm basert på én titreringskurve (data ikke vist). Eventuell fri probe vil i dette tilfellet være for lav til å bli internalisert, i tillegg til at det tidligere kun er sett opptak av fri probe ved konsentrasjoner 10 µm. 59
76 På bakgrunn av funn i denne studien der kompleks av legumainselektiv probe bundet til aktivt legumain ble internalisert, kan spekuleres i at den endogene inhibitoren cystatin E/M også kan danne kompleks med legumain ekstracellulært ved sur nok ph til å favorisere aktivering av prolegumain og at dette komplekset kan internaliseres. Cystatin E/M er et sekretorisk protein, men proteinet er observert intracellulært i endosomer og i cellekjernen [29]. I motsetning til probene brukt i denne oppgaven, så bindes ikke cystatiner irreversibelt til substratet [22]. 5.7 Legumainform på 25 kda I denne studien ble det sett at probe var bundet til en legumainform på 25 kda, samt at denne legumainformen ble observert i HEK293-celler etter inkubering både med renset bovint legumain alene og kompleks. Komplekset av legumainformen på 25 kda var svakere detektert med sekundærantistoff for legumain enn med streptavidin (probedeteksjon), trolig grunnet at deteksjonen av fluorescensen med streptavidin (800 nm; grønn) gir sterkere signaler enn fluorescensen ved 700 nm (rød). Det er ukjent om legumain 25 kda er aktiv, men siden legumainprobene bindes til det aktive setet på legumain [60], så tyder dette på at 25- legumainformen er aktiv og at formen mest sannsynlig er et degraderingsprodukt av moden aktiv form på 36 kda. Nøyaktig hvor den aktive formen er spaltet for å danne 25- legumainformen er ukjent. Om denne formen har en funksjon i cellen er også ukjent, men formen detekteres normalt ikke i cellelysater. Om formen dannes normalt, så er det grunn til å tro at den nedbrytes raskt i cellene slik at den ikke detekteres. Det er tidligere observert og beskrevet funn av en legumainform på 24 kda i interleukin (IL)- 4/-10 stimulerte primære makrofager inkubert med en aktivitetsbasert probe (LE28) som fluorescerer ved binding til legumain [59]. I vårt laboratorium har masterstudent i farmasi, Nuriddin M. Abdukadir (upublisert data), nylig vist at en legumainform på 25 kda finnes i M2-makrofager (differensierte THP-1-celler) etter inkubering med MP-L01 proben, samt for renset bovint legumain som bekrefter funnet i denne oppgaven. Det kan antas at det observerte 24/25-kDa-formen sett i makrofager er den samme legumainformen som ble observert i denne studien. 60
77 6 Konklusjon 1) Glykosylering av prolegumain (56 kda) er nødvendig for opptak og autoaktivering til moden aktiv form etter internalisering i levende celler. 2) Fullstendig uglykosylerte prolegumain (47 kda) blir ikke internalisert. 3) Cystatin E/M internaliseres uavhengig av glykosylering og trolig ikke via klatrinmediert endocytose. 4) Odyssey CLx Near-Infrared Imaging System ble etablert som metode for deteksjon ved immunoblotting. 5) Fri legumainselektiv probe internaliseres og detekteres bundet til modent legumain (36 kda). 6) Både modent legumain og kompleks av legumain bundet til probe internaliseres i levende celler. 7) Endocytoseinhibitoren Dyngo-4a inhiberer ikke internalisering av prolegumain, men hindrer prosessering av prolegumain til moden aktiv form. 8) Legumainselektiv probe danner kompleks med en legumainform på 25 kda fra renset bovint legumain og internaliseres. 61
78 62
79 Litteraturliste 1. Turk, B., Targeting proteases: successes, failures and future prospects. Nat Rev Drug Discov, (9): p Turk, B., D.a. Turk, and V. Turk, Protease signalling: the cutting edge. The EMBO Journal, (7): p Puente, X.S., et al., Human and mouse proteases: a comparative genomic approach. Nat Rev Genet, (7): p Rawlings, N.D., et al., MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Research, (D1): p. D503-D Rawlings, N.D., A.J. Barrett, and A. Bateman, MEROPS: the database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Research, (Database issue): p. D343- D Rawlings, N.D. and A.J. Barrett, Evolutionary families of peptidases. Biochemical Journal, (Pt 1): p Rawlings, N.D., A.J. Barrett, and R. Finn, Twenty years of the MEROPS database of proteolytic enzymes, their substrates and inhibitors. Nucleic Acids Research, (D1): p. D343-D Chen, J.-M., et al., Cloning, Isolation, and Characterization of Mammalian Legumain, an Asparaginyl Endopeptidase. Journal of Biological Chemistry, (12): p Li, D.N., et al., Multistep Autoactivation of Asparaginyl Endopeptidase in Vitro and in Vivo. Journal of Biological Chemistry, (40): p Chen, J.-M., et al., Identification of the active site of legumain links it to caspases, clostripain and gingipains in a new clan of cysteine endopeptidases. FEBS Letters, (3): p Hara-Nishimura, I., K. Inoue, and M. Nishimura, A unique vacuolar processing enzyme responsible for conversion of several proprotein precursors into the mature forms. FEBS Letters, (1-2): p Kembhavi, A.A., et al., The Two Cysteine Endopeptidases of Legume Seeds: Purification and Characterization by Use of Specific Fluorometric Assays. Archives of Biochemistry and Biophysics, (2): p Hara-Nishimura, I., Y. Takeuchi, and M. Nishimura, Molecular Characterization of a Vacuolar Processing Enzyme Related to a Putative Cysteine Proteinase of Schistosoma mansoni. The Plant Cell, (11): p Dalton, J.P., L. Hola-Jamriska, and P.J. Brindley, Asparaginyl endopeptidase activity in adult Schistosoma mansoni. Parasitology, ( Pt 5): p Tanaka, T., J. Inazawa, and Y. Nakamura, Molecular cloning of a human cdna encoding putative cysteine protease (PRSC1) and its chromosome assignment to 14q32.1. Cytogenet Cell Genet, (1-2): p Dall, E. and H. Brandstetter, Activation of legumain involves proteolytic and conformational events, resulting in a context- and substrate-dependent activity profile. Acta Crystallographica Section F: Structural Biology and Crystallization Communications, (Pt 1): p Halfon, S., et al., Autocatalytic activation of human legumain at aspartic acid residues. FEBS Letters, (1-2): p Haugen, M.H., et al., Nuclear Legumain Activity in Colorectal Cancer. PLoS ONE, (1): p. e Dall, E. and H. Brandstetter, Mechanistic and structural studies on legumain explain its zymogenicity, distinct activation pathways, and regulation. Proceedings of the National Academy of Sciences, (27): p Liu, C., et al., Overexpression of Legumain in Tumors Is Significant for Invasion/Metastasis and a Candidate Enzymatic Target for Prodrug Therapy. Cancer Research, (11): p
80 21. Shirahama-Noda, K., et al., Biosynthetic Processing of Cathepsins and Lysosomal Degradation Are Abolished in Asparaginyl Endopeptidase-deficient Mice. Journal of Biological Chemistry, (35): p Sotiropoulou, G., A. Anisowicz, and R. Sager, Identification, Cloning, and Characterization of Cystatin M, a Novel Cysteine Proteinase Inhibitor, Down-regulated in Breast Cancer. Journal of Biological Chemistry, (2): p Smith, R., et al., Intra- and extracellular regulation of activity and processing of legumain by cystatin E/M. Biochimie, (12): p Alvarez-Fernandez, M., et al., Inhibition of Mammalian Legumain by Some Cystatins Is Due to a Novel Second Reactive Site. Journal of Biological Chemistry, (27): p Zhao, L., et al., Structural analysis of asparaginyl endopeptidase reveals the activation mechanism and a reversible intermediate maturation stage. Cell Research, (3): p Dall, E. and H. Brandstetter, Structure and function of legumain in health and disease. Biochimie, : p Berven, L., et al., Autoactivation of prolegumain is accelerated by glycosaminoglycans. Biochimie, (4): p Albert, B., et al., Intracellular vesicular traffic in Molecular biology of the cell, 5th. 2008: Garland Sience: New York. 29. Smith, R.L., Regulation of legumain in human cells Preta, G., J.G. Cronin, and I.M. Sheldon, Dynasore - not just a dynamin inhibitor. Cell Communication and Signaling, (1): p Macia, E., et al., Dynasore, a Cell-Permeable Inhibitor of Dynamin. Developmental Cell, (6): p McCluskey, A., et al., Building a Better Dynasore: The Dyngo Compounds Potently Inhibit Dynamin and Endocytosis. Traffic (Copenhagen, Denmark), (12): p Harper, C.B., et al., Dynamin Inhibition Blocks Botulinum Neurotoxin Type A Endocytosis in Neurons and Delays Botulism. Journal of Biological Chemistry, (41): p Blom, N., S. Gammeltoft, and S. Brunak, Sequence and structure-based prediction of eukaryotic protein phosphorylation sites1. Journal of Molecular Biology, (5): p Damgaard, I., N-linked glycosylation and phosphorylation; what determines legumain localization and activation? Zafar, S., A. Nasir, and H. Bokhari, Computational analysis reveals abundance of potential glycoproteins in Archaea, Bacteria and Eukarya. Bioinformation, (9): p Shandala, T., E.J. Parkinson-Lawrence, and D.A. Brooks, Protein: Cotranslational and Posttranslational Modification in Organelles, in els. 2001, John Wiley & Sons, Ltd. 38. R Kornfeld, a. and S. Kornfeld, Assembly of Asparagine-Linked Oligosaccharides. Annual Review of Biochemistry, (1): p Kasem, R., N-bundet glykosylering: Betydning for sekresjon og autoaktivering av legumain i humane celler Takatsuki, A., K. Arima, and G. Tamura, Tunicamycin, a new antibiotic. I. Isolation and characterization of tunicamycin. J Antibiot (Tokyo), (4): p Heifetz, A., R.W. Keenan, and A.D. Elbein, Mechanism of action of tunicamycin on the UDP- GlcNAc:dolichyl-phosphate GlcNAc-1-phosphate transferase. Biochemistry, (11): p Elbein, A.D., Inhibitors of the Biosynthesis and Processing of N-Linked Oligosaccharide Chains. Annual Review of Biochemistry, (1): p Powell, L.D., Inhibition of N-linked glycosylation. Curr Protoc Immunol, Chapter 8: p. Unit Pahl, H.L., Signal Transduction From the Endoplasmic Reticulum to the Cell Nucleus. Physiological Reviews, (3): p
81 45. Schönthal, A.H., Endoplasmic Reticulum Stress: Its Role in Disease and Novel Prospects for Therapy. Scientifica, : p Global Burden of Disease Cancer, C., The Global Burden of Cancer JAMA oncology, (4): p Hanahan, D. and Robert A. Weinberg, Hallmarks of Cancer: The Next Generation. Cell, (5): p Albert, B., et al., Cancer as a microevolutionary process in Molecular biology of the cell, 5th : Garland Sience: New York Mohamed, M.M. and B.F. Sloane, Cysteine cathepsins: multifunctional enzymes in cancer. Nat Rev Cancer, (10): p Thomssen, C., et al., Prognostic value of the cysteine proteases cathepsins B and cathepsin L in human breast cancer. Clinical Cancer Research, (7): p Chan, A.T., et al., Cathepsin B Expression and Survival in Colon Cancer: Implications for Molecular Detection of Neoplasia. Cancer Epidemiology Biomarkers & Prevention, (11): p Wang, L., et al., Legumain: A biomarker for diagnosis and prognosis of human ovarian cancer. Journal of Cellular Biochemistry, (8): p Kos, J. and T.T. Lah, Cysteine proteinases and their endogenous inhibitors: target proteins for prognosis, diagnosis and therapy in cancer (review). Oncol Rep, (6): p Zhang, J., et al., Cystatin M: A Novel Candidate Tumor Suppressor Gene for Breast Cancer. Cancer Research, (19): p Briggs, J.J., et al., Cystatin E/M suppresses legumain activity and invasion of human melanoma. BMC Cancer, (1): p Vigneswaran, N., et al., Silencing of cystatin M in metastatic oral cancer cell line MDA-686Ln by sirna increases cysteine proteinases and legumain activities, cell proliferation and in vitro invasion. Life Sciences, (8): p Haugen, M.H., et al., High expression of the cysteine proteinase legumain in colorectal cancer Implications for therapeutic targeting. European Journal of Cancer, (1): p Chen, J.M., et al., Activation of progelatinase A by mammalian legumain, a recently discovered cysteine proteinase. Biol Chem, (5): p Edgington, L.E., et al., Functional Imaging of Legumain in Cancer Using a New Quenched Activity-Based Probe. Journal of the American Chemical Society, (1): p Poreba, M., et al., Counter Selection Substrate Library (CoSeSuL): Development of Specific Protease Substrates and Probes to Image Cellular Legumain. Cell Chemical Biology Under revisjon. 61. Yamane, T., et al., Legumain from bovine kidney: its purification, molecular cloning, immunohistochemical localization and degradation of annexin II and vitamin D-binding protein1. Biochimica et Biophysica Acta (BBA) - Protein Structure and Molecular Enzymology, (1): p Solberg, S. and O.D. Laerum, [Cryobiology-- freeze preservation and storage of living cells and tissues]. Tidsskr Nor Laegeforen, (20): p Bradford, M.M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry, (1): p Johansen, H.T., C.G. Knight, and A.J. Barrett, Colorimetric and Fluorimetric Microplate Assays for Legumain and a Staining Reaction for Detection of the Enzyme after Electrophoresis. Analytical Biochemistry, (2): p Towbin, H., T. Staehelin, and J. Gordon, Electrophoretic Transfer of Proteins from Polyacrylamide Gels to Nitrocellulose Sheets: Procedure and Some Applications. Proceedings of the National Academy of Sciences of the United States of America, (9): p Harper, C.B., et al., Targeting membrane trafficking in infection prophylaxis: dynamin inhibitors. Trends in Cell Biology, (2): p
82 67. Luo, Y., et al., Targeting tumor-associated macrophages as a novel strategy against breast cancer. The Journal of Clinical Investigation, (8): p Wu, W., et al., Targeting Cell-Impermeable Prodrug Activation to Tumor Microenvironment Eradicates Multiple Drug-Resistant Neoplasms. Cancer Research, (2): p Talmadge, J.E. and I.J. Fidler, AACR Centennial Series: The Biology of Cancer Metastasis: Historical Perspective. Cancer Research, (14): p Lodish H., Berk A., and Z.S. L., Molecular Cell Biology. 4th edition.. Vol. Section 17.7, Protein Glycosylation in the ER and Golgi Complex. 2000, New York: W. H. Freeman and Company Brix, K., et al., Proteolysis mediated by cysteine cathepsins and legumain recent advances and cell biological challenges. Protoplasma, (3): p Solberg, R., et al., Legumain expression, activity and secretion are increased during monocyte-to-macrophage differentiation and inhibited by atorvastatin. Biol Chem, (1): p Chen, J.M., M. Fortunato, and A.J. Barrett, Activation of human prolegumain by cleavage at a C-terminal asparagine residue. Biochemical Journal, (Pt 2): p Turk, V., et al., Cysteine cathepsins: From structure, function and regulation to new frontiers. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics, (1): p Harper, C.B., et al., Dynamin Inhibition Blocks Botulinum Neurotoxin Type A Endocytosis in Neurons and Delays Botulism. The Journal of Biological Chemistry, (41): p Smith, R.L., et al., Synthesis of a novel legumain-cleavable colchicine prodrug with cellspecific toxicity. Bioorganic & Medicinal Chemistry, (13): p Sakai, H., et al., Phospholipase C-dependent Ca2+-sensing pathways leading to endocytosis and inhibition of the plasma membrane vacuolar H+-ATPase in osteoclasts. American Journal of Physiology - Cell Physiology, (3): p. C570-C Park, R.J., et al., Dynamin triple knockout cells reveal off target effects of commonly used dynamin inhibitors. Journal of Cell Science, (22): p Liu, Y., et al., Targeting Cell Surface Alpha(v)beta(3) Integrin Increases Therapeutic Efficacies of a Legumain Protease-Activated Auristatin Prodrug. Molecular Pharmaceutics, (1): p
83 Vedlegg A: Oppskrifter for løsninger 1. Behandling av celler Dyrkningsmedium for HEK293-, M38L-, M4C-, SW620- og HCT116-celler 1.1 Serumholdig DMEM-medium: 450 ml DMEM med 4 mm L-glutamin, 4500 mg/l glukose 50 ml Føtalt kalveserum (FBS) 5 ml Penicillin ( U/ml) Streptomycin (100 µg/ml) 5 ml Natriumpyrovat 100 mm 2,5 ml Fungizone 250 µg/ml 1.2 Serumfritt DMEM-medium: 500 ml DMEM med 4 mm L-glutamin, 4500 mg/l glukose 5 ml Penicillin ( U/ml) Streptomycin (100 µg/ml) 5 ml Natriumpyrovat 100 mm 2,5 ml Fungizone 250 µg/ml X PBS: 14,4 g Na2HPO4x2H2O 2,0 g KH2PO4 80 g NaCl 2 g KCl dh2o til 1,0 L og juster ph til 7,3 med HCl Løsningen filtreres med filter 0,45 µm, og fortynnes 1:10 med dh2o før bruk 1.4 Lysisbuffer (ph 5,8): 14,71 g Natriumcitrat (Na3C6H5O7x2H2O) 0,19 g Na2-EDTA (Na2C10H16N2 O8) 5 g N-oktyl-β-D-glukopyranosid HCl ph justert til 5,8 dh2o til 500 ml 67
84 1.5 3X SDS høstebuffer 50 ml 4X UGB 7 g SDS 20 ml Glyserol Bromofenolblå etter eget ønske Rett før bruk tilsettes 1 M ditiotreitol (DTT), sluttkonsentrasjon 50 mm 1.6 4X UGB: 3,51 g Ammediol (2-Amino-2-metyl-1,3-propandiol) 50 ml dh2o 2,06 ml HCl dh2o til 100 ml 2 Totalproteinmåling 2.1 Fortynning av Coomassiereagens 1:5 10 ml Bio-Rad Protein Assay Dye Reagent Concentrate dh2o til 50 ml 3 Legumainaktivitetsmåling 3.1 Legumain-assaybuffer (ph 5,8): 3,3005 g Sitronsyre (C6H8O7xH2O) 21,537 g Na2HPO4x2H2O 0,37224 g Na2-EDTA (Na2C10H16N2O8) 0,1 g CHAPS dh2o til 1,0 L 200 µl 200 mm DTT tilsettes 40 ml legumain-assaybuffer rett før bruk 3.2 Legumain-substratoppløsning (34 µm): 200 µl av stock -løsning med Ala-Ala-Asn-AMC (2,5 mm i DMSO) 14,5 ml Legumain-assaybuffer (ph 5,8) 68
85 4 Gelelektroforese og immunoblotting 4.1 Elektroforesebuffer Fortynnes 1:20 40 ml NuPAGE MOPS SDS Running Buffer (20X) dh2o til 0,8 L 500 µl NuPAGE Antioksidant tilsettes direkte i blottebuffer i elektroforesekaret 4.2 Blottebuffer: 400 ml 10X Tris/Glycine-buffer (Bio-Rad) 800 ml Metanol (MeOH) dh2o til 2,8 L X TTBS: 48,4 g Tris 220,2 g NaCl 20 ml Tween 20 HCl, ph justert til 7,5 dh2o til 2,0 L. Fortynnes 1:10 med dh2o før bruk 4.4 Elektroforeseprøver X µl prøve + X µl lysisbuffer/dh2o = 13 µl 5 µl 4X Sample Buffer 2 µl 0,5 M DTT (gir 20 µl totalvolum) Prøven varmes på varmeblokk i 10 minutter ved 70 o C 69
86 Vedlegg B: Resultater Vedlegg til figur 4.5 A ) B ) µ g /m l to ta lp ro te in L e g u m a in a k tiv ite t (d F /s e k ) * * D M S O D M S O M 3 8 L -C L M P -L 0 1 (1 M ) M 3 8 L -C L M P -L 0 1 (1 M ) Totalprotein og legumainaktivitet målt i cellelysat etter inkubering av HEK293-celler med legumain, MP-L01 og kompleks. Inkubater med legumain alene (i M38L-lysat), MP-L01 alene, kompleks av legumain (i M38L-lysat) og MP-L01 eller DMSO ble dannet. Alle inneholdt legumain-assaybuffer (15 %) og ble preinkubert i 30 minutter ved 30 C før fortynning i serumfritt medium og tilsetning til cellene. HEK293-celler (0,1 x 10 6 celler/brønn) i 24-brønnersbrett ble inkubert i 24 timer ved 37 C med enten serumfritt medium og DMSO (0,8 %; kontroll) eller med legumain (i M38L-lysat, 0,92 µg/ml), MP-L01 (1 µm) eller kompleks av legumain (i M38L-lysat) og MP-L01 (1 µm) før høsting av cellelysat. A) µg/ml totalprotein og B) legumainaktivitet (df/sek) i HEK293-cellelysat etter inkubering, målt ved bruk av et spesifikt fluoriserende peptidsubstrat for legumain (Z-Ala- Ala-Asn-AMC, presentert som gjennomsnitt ± SEM (n = 4, * p 0,05, uparet t-test). Vedlegg C: Poster Poster presentert på Norsk Selskap for Farmakologi og Toksikologi (NSFT) Vintermøte Betydning av glykosylering for internalisering og aktivering av prolegumain i humane tykktarmskreftceller (neste side) 70
87 71
N-bundet glykosylering: Betydning for sekresjon og autoaktivering av legumain i humane celler
 N-bundet glykosylering: Betydning for sekresjon og autoaktivering av legumain i humane celler Roya Kasem Mastergradsoppgave i farmasi Seksjon for farmasøytisk biovitenskap, Farmasøytisk institutt Det matematisk-naturvitenskapelige
N-bundet glykosylering: Betydning for sekresjon og autoaktivering av legumain i humane celler Roya Kasem Mastergradsoppgave i farmasi Seksjon for farmasøytisk biovitenskap, Farmasøytisk institutt Det matematisk-naturvitenskapelige
Legumain i samspillet mellom tykktarmkreftceller og makrofager
 Legumain i samspillet mellom tykktarmkreftceller og makrofager Kjersti Bergh Ånonsen Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt Det matematisk-naturvitenskapelige
Legumain i samspillet mellom tykktarmkreftceller og makrofager Kjersti Bergh Ånonsen Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt Det matematisk-naturvitenskapelige
Betydningen av legumain og cystatin E/M for aktivering av caspase-3
 Betydningen av legumain og cystatin E/M for aktivering av caspase-3 Masteroppgave av Dlvin Salem Hame Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt Det matematiske-naturvitenskaplige
Betydningen av legumain og cystatin E/M for aktivering av caspase-3 Masteroppgave av Dlvin Salem Hame Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt Det matematiske-naturvitenskaplige
Uttrykk, aktivitet og sekresjon av legumain er forskjellig i M1- og M2-differensierte makrofager
 Uttrykk, aktivitet og sekresjon av legumain er forskjellig i M1- og M2-differensierte makrofager Nuriddin Abdukadir Mastergradsoppgave i farmasi Seksjon for farmasøytisk biovitenskap Farmasøytisk institutt
Uttrykk, aktivitet og sekresjon av legumain er forskjellig i M1- og M2-differensierte makrofager Nuriddin Abdukadir Mastergradsoppgave i farmasi Seksjon for farmasøytisk biovitenskap Farmasøytisk institutt
Etablering av metode for måling av inhibitorisk aktivitet mot cysteinproteaser og studier av cystatiner i makrofager og kreftceller
 Masteroppgave for graden Master i Farmasi Etablering av metode for måling av inhibitorisk aktivitet mot cysteinproteaser og studier av cystatiner i makrofager og kreftceller Hilde Rakvaag Mai 2007 Institutt
Masteroppgave for graden Master i Farmasi Etablering av metode for måling av inhibitorisk aktivitet mot cysteinproteaser og studier av cystatiner i makrofager og kreftceller Hilde Rakvaag Mai 2007 Institutt
Cellulære effekter av et kolkisin-prodrug som spaltes av legumain
 Cellulære effekter av et kolkisin-prodrug som spaltes av legumain Tina Elvestrand Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap, Farmasøytisk institutt Det matematisk-naturvitenskapelige
Cellulære effekter av et kolkisin-prodrug som spaltes av legumain Tina Elvestrand Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap, Farmasøytisk institutt Det matematisk-naturvitenskapelige
BI 212- Protein Sorting - Kap. 17 Syntese og mål for mitokondrie- og kloroplast-proteiner (forts.)
 Syntese og mål for mitokondrie- og kloroplast-proteiner (forts.) Veiene for opptak fra cytosol av kloroplast-proteiner Opptak av proteiner fra cytosol til kloroplaster ligner mye på mitokondrie-importen
Syntese og mål for mitokondrie- og kloroplast-proteiner (forts.) Veiene for opptak fra cytosol av kloroplast-proteiner Opptak av proteiner fra cytosol til kloroplaster ligner mye på mitokondrie-importen
Protein Sorting- Kap. 17
 Forelesninger i BI 212 - Cellebiologi - Våren 2002 Protein Sorting- Kap. 17 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor- Henning.Iversen@chembio chembio.ntnu.no Tlf.
Forelesninger i BI 212 - Cellebiologi - Våren 2002 Protein Sorting- Kap. 17 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor- Henning.Iversen@chembio chembio.ntnu.no Tlf.
Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve
 Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve For rensing av genomisk DNA fra innsamlingssett i seriene Oragene og ORAcollect. Du finner flere språk og protokoller på vårt nettsted,
Laboratorieprotokoll for manuell rensing av DNA fra 0,5 ml prøve For rensing av genomisk DNA fra innsamlingssett i seriene Oragene og ORAcollect. Du finner flere språk og protokoller på vårt nettsted,
NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK EKSAMEN I EMNE TFY4260 CELLEBIOLOGI OG CELLULÆR BIOFYSIKK
 Side av 1 av5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK EKSAMEN I EMNE TFY4260 CELLEBIOLOGI OG CELLULÆR BIOFYSIKK Faglig kontakt under eksamen: Catharina Davies Tel 73593688 eller
Side av 1 av5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK EKSAMEN I EMNE TFY4260 CELLEBIOLOGI OG CELLULÆR BIOFYSIKK Faglig kontakt under eksamen: Catharina Davies Tel 73593688 eller
Hvordan holde styr på proteasene?? Harald; 31.01.08
 Hvordan holde styr på proteasene?? Harald; 31.01.08 Protease? Proteinase? Spalter proteiner Peptidase? Spalter peptider? Spalter peptidbindinger Exo-peptidaser Endo-peptidaser Endo Ekso- Proteaser er enzymer!
Hvordan holde styr på proteasene?? Harald; 31.01.08 Protease? Proteinase? Spalter proteiner Peptidase? Spalter peptider? Spalter peptidbindinger Exo-peptidaser Endo-peptidaser Endo Ekso- Proteaser er enzymer!
Grunnleggende cellebiologi
 Grunnleggende cellebiologi Ann Kristin Sjaastad Sert. yrkeshygieniker, Dr. Philos HMS-seksjonen, NTNU Tema Cellens oppbygning Transportmekanismer Arvestoff og proteinsyntese Mutasjoner og genotoksisitet
Grunnleggende cellebiologi Ann Kristin Sjaastad Sert. yrkeshygieniker, Dr. Philos HMS-seksjonen, NTNU Tema Cellens oppbygning Transportmekanismer Arvestoff og proteinsyntese Mutasjoner og genotoksisitet
Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre.
 DNA HALSKJEDE Hensikt Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre. Bakgrunn Det humane genomet består av omtrent 2.9 milliarder basepar.
DNA HALSKJEDE Hensikt Hensikten med forsøket er å isolere eget DNA fra kinnceller, se hvordan det ser ut og hva det kan brukes til videre. Bakgrunn Det humane genomet består av omtrent 2.9 milliarder basepar.
Forelesninger i BI Cellebiologi. Denaturering og renaturering. Figure 3-13
 Figure 3.9 Denaturering og renaturering Figure 3-13 Denaturering og renaturering Figure 3-14 Viser tre trinn i refolding av et protein som har vært denaturert. Molten globule -formen er en intermediær
Figure 3.9 Denaturering og renaturering Figure 3-13 Denaturering og renaturering Figure 3-14 Viser tre trinn i refolding av et protein som har vært denaturert. Molten globule -formen er en intermediær
Hypoglykemi reduserer legumainaktivitet i makrofager
 Hypoglykemi reduserer legumainaktivitet i makrofager Økt legumain i plasma fra pasienter med karotisplakk Inass Elyouncha Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
Hypoglykemi reduserer legumainaktivitet i makrofager Økt legumain i plasma fra pasienter med karotisplakk Inass Elyouncha Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
BIOS 2 Biologi
 . Figurer kapittel 2: Energi Figur s. 48 Solenergi Økosystem CO 2 + 2 O Fotosyntese i kloroplaster Organiske molekyler + O 2 Celleånding i mitokondrier Energi til arbeid Varme rodusentene i økosystemet
. Figurer kapittel 2: Energi Figur s. 48 Solenergi Økosystem CO 2 + 2 O Fotosyntese i kloroplaster Organiske molekyler + O 2 Celleånding i mitokondrier Energi til arbeid Varme rodusentene i økosystemet
Statiner hemmer aktivitet av den lysosomale cysteinproteasen legumain Spiller legumain en rolle i apoptose?
 Statiner hemmer aktivitet av den lysosomale cysteinproteasen legumain Spiller legumain en rolle i apoptose? Islam Mohammed Yaseen Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
Statiner hemmer aktivitet av den lysosomale cysteinproteasen legumain Spiller legumain en rolle i apoptose? Islam Mohammed Yaseen Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
Effekt av statiner på de lysosomale cysteinproteasene legumain, cathepsin B og L i monocytter/makrofager
 Effekt av statiner på de lysosomale cysteinproteasene legumain, cathepsin B og L i monocytter/makrofager Eyassu Tewolde Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
Effekt av statiner på de lysosomale cysteinproteasene legumain, cathepsin B og L i monocytter/makrofager Eyassu Tewolde Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk
Mikroalger til medisin; krefthemmere
 Mikroalger til medisin; krefthemmere Kari Skjånes og Hanne Skomedal Bioforsk Jord og Miljø og Plantehelse Agenda Hvorfor mikroalger som krefthemmere Kreftutvikling Potensiale Hva kan utvikles Hvordan utvikle
Mikroalger til medisin; krefthemmere Kari Skjånes og Hanne Skomedal Bioforsk Jord og Miljø og Plantehelse Agenda Hvorfor mikroalger som krefthemmere Kreftutvikling Potensiale Hva kan utvikles Hvordan utvikle
Forelesninger i BI Cellebiologi. Protein struktur og funksjon - Kap. 3
 Forelesninger i BI 212 - Cellebiologi Protein struktur og funksjon - Kap. 3 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor-Henning.Iversen@chembio.ntnu.no Tlf. 73 59
Forelesninger i BI 212 - Cellebiologi Protein struktur og funksjon - Kap. 3 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor-Henning.Iversen@chembio.ntnu.no Tlf. 73 59
NORGES TEKNISK-NATURVITENSKAPELIG UNIVERSITET Side 1 av 5 INSTITUTT FOR FYSIKK. EKSAMEN I FAG CELLEBIOLOGI 1 august 1997 Tid: kl
 NORGES TEKNISK-NATURVITENSKAPELIG UNIVERSITET Side 1 av 5 INSTITUTT FOR FYSIKK Faglig kontakt under eksamen: Navn: Professor Tore Lindmo Tlf.:93432 EKSAMEN I FAG 74618 CELLEBIOLOGI 1 august 1997 Tid: kl
NORGES TEKNISK-NATURVITENSKAPELIG UNIVERSITET Side 1 av 5 INSTITUTT FOR FYSIKK Faglig kontakt under eksamen: Navn: Professor Tore Lindmo Tlf.:93432 EKSAMEN I FAG 74618 CELLEBIOLOGI 1 august 1997 Tid: kl
BI 212- Protein Sorting - Kap. 17 Post-translasjonell modifisering og kvalitetskontroll i r-er (Del 17.6)
 Før de sekretoriske proteiner transporteres videre fra ER-lumen til sitt endelige bestemmelsessted, blir de modifisert ; Dannelse av disulfid-bindinger Foldinger av proteinet Påleiring og prosessering
Før de sekretoriske proteiner transporteres videre fra ER-lumen til sitt endelige bestemmelsessted, blir de modifisert ; Dannelse av disulfid-bindinger Foldinger av proteinet Påleiring og prosessering
Forelesninger i BI Cellebiologi. Enzymer : senker aktiveringsenergien. Figure 6.13
 Enzymer : senker aktiveringsenergien Figure 6.13 Aktive seter : camp-avhengig protein kinase *For å illustrere hvordan det aktive setet binder et spesifikt substrat er valgt som eksempel camp-avhengig
Enzymer : senker aktiveringsenergien Figure 6.13 Aktive seter : camp-avhengig protein kinase *For å illustrere hvordan det aktive setet binder et spesifikt substrat er valgt som eksempel camp-avhengig
Cysteinproteasene legumain og cathepsin B i monocytter/makrofager og i aterosklerotiske plakk
 Cysteinproteasene legumain og cathepsin B i monocytter/makrofager og i aterosklerotiske plakk Sakina Ben Omar Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt
Cysteinproteasene legumain og cathepsin B i monocytter/makrofager og i aterosklerotiske plakk Sakina Ben Omar Mastergradsoppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt
Cellesignalisering II: Reseptor tyrosin kinaser, cytosoliske kinaser
 Cellesignalisering II: Reseptor tyrosin kinaser, cytosoliske kinaser! Introduksjon! Definisjon og klassifisering! Kinasefamilier: Receptor/cytosol! Receptor Tyrosin kinase-mediert signalisering! MAP kinase
Cellesignalisering II: Reseptor tyrosin kinaser, cytosoliske kinaser! Introduksjon! Definisjon og klassifisering! Kinasefamilier: Receptor/cytosol! Receptor Tyrosin kinase-mediert signalisering! MAP kinase
Membran-proteiner (Del 3.4)
 Membran-proteiner (Del 3.4) Poriner adskiller seg dramatisk fra andre integral proteiner. Finnes bl.a. i ytre membranen hos E.coli (se Figure 1-7). Poriner er med å beskytte bakterien mot toksiske forbindelser
Membran-proteiner (Del 3.4) Poriner adskiller seg dramatisk fra andre integral proteiner. Finnes bl.a. i ytre membranen hos E.coli (se Figure 1-7). Poriner er med å beskytte bakterien mot toksiske forbindelser
Forelesninger i BI Cellebiologi Proteinrensing - Væskekromatografi. Figure 3-43 b
 Proteinrensing - Væskekromatografi Figure 3-43 b Proteinrensing - Væskekromatografi Ved affinitets-kromatografi brukes en søyle med kuler som er dekket med ligander (f.eks. et enzym-substrat eller et annet
Proteinrensing - Væskekromatografi Figure 3-43 b Proteinrensing - Væskekromatografi Ved affinitets-kromatografi brukes en søyle med kuler som er dekket med ligander (f.eks. et enzym-substrat eller et annet
Uønsket opptak av store molekyler i lever et problem som kan overkommes?
 Uønsket opptak av store molekyler i lever et problem som kan overkommes? Bård Smedsrød Founder and CSO Blood clearance function of the liver: Fate of i.v. administered macromolecule ( 125 I-FSA) Blood
Uønsket opptak av store molekyler i lever et problem som kan overkommes? Bård Smedsrød Founder and CSO Blood clearance function of the liver: Fate of i.v. administered macromolecule ( 125 I-FSA) Blood
ML-208, generell informasjon
 ML-208, generell informasjon Emnekode: ML-208 Emnenavn: Molekylærbiologi Dato:20.12.2017 Varighet:4 timer Tillatte hjelpemidler: Ingen Merknader:Lag gjerne tegninger og figurer for å illustrere og forklare
ML-208, generell informasjon Emnekode: ML-208 Emnenavn: Molekylærbiologi Dato:20.12.2017 Varighet:4 timer Tillatte hjelpemidler: Ingen Merknader:Lag gjerne tegninger og figurer for å illustrere og forklare
1 Bakgrunn Metode og gjennomføring Belegg Biofilmdannelse Resultater Biofilmdannelse Diskusjon...
 Innholdsfortegnelse Bakgrunn... 3 2 Metode og gjennomføring... 4 2. Belegg... 4 2.2 Biofilmdannelse... 4 3 Resultater... 5 3. Biofilmdannelse... 5 4 Diskusjon... 6 5 Foreløpige konklusjoner... 7 60205-2
Innholdsfortegnelse Bakgrunn... 3 2 Metode og gjennomføring... 4 2. Belegg... 4 2.2 Biofilmdannelse... 4 3 Resultater... 5 3. Biofilmdannelse... 5 4 Diskusjon... 6 5 Foreløpige konklusjoner... 7 60205-2
Flervalgsoppgaver: proteinsyntese
 Flervalgsoppgaver - proteinsyntese Hver oppgave har ett riktig svaralternativ. Proteinsyntese 1 Hva blir transkribert fra denne DNA sekvensen: 3'-C-C-G-A-A-T-G-T-C-5'? A) 3'-G-G-C-U-U-A-C-A-G-5' B) 3'-G-G-C-T-T-A-C-A-G-5'
Flervalgsoppgaver - proteinsyntese Hver oppgave har ett riktig svaralternativ. Proteinsyntese 1 Hva blir transkribert fra denne DNA sekvensen: 3'-C-C-G-A-A-T-G-T-C-5'? A) 3'-G-G-C-U-U-A-C-A-G-5' B) 3'-G-G-C-T-T-A-C-A-G-5'
ML-208, generell informasjon
 ML-208, generell informasjon Emnekode: ML-208 Emnenavn: Molekylærbiologi Dato:20.12.2017 Varighet:4 timer Tillatte hjelpemidler: Ingen Merknader:Lag gjerne tegninger og figurer for å illustrere og forklare
ML-208, generell informasjon Emnekode: ML-208 Emnenavn: Molekylærbiologi Dato:20.12.2017 Varighet:4 timer Tillatte hjelpemidler: Ingen Merknader:Lag gjerne tegninger og figurer for å illustrere og forklare
Oppgave: MED1100-3_OPPGAVE2_H16_KONT
 Side 10 av 35 Oppgave: MED1100-3_OPPGAVE2_H16_KONT Del 1: Ola har en arvelig betinget kombinert immundefekt med mangel på både T-celler og B-celler. Ola får derfor gjentatte Hvorfor er Ola beskyttet mot
Side 10 av 35 Oppgave: MED1100-3_OPPGAVE2_H16_KONT Del 1: Ola har en arvelig betinget kombinert immundefekt med mangel på både T-celler og B-celler. Ola får derfor gjentatte Hvorfor er Ola beskyttet mot
Enzymes make the world go around. Enzymer i dagliglivet
 Enzymes make the world go around Enzymer i dagliglivet Innledning Enzymer er i de fleste tilfellene proteiner som øker reaksjonshastigheten til biologiske prosesser. Derfor blir enzymer ofte kalt biologiske
Enzymes make the world go around Enzymer i dagliglivet Innledning Enzymer er i de fleste tilfellene proteiner som øker reaksjonshastigheten til biologiske prosesser. Derfor blir enzymer ofte kalt biologiske
Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen.
 Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen. Forelesning for IB, mai 2008 Terje Espevik, IKM "What the?... This is lemonade! Where's my culture of amoebic
Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen. Forelesning for IB, mai 2008 Terje Espevik, IKM "What the?... This is lemonade! Where's my culture of amoebic
MOLEKYLÆRBIOLOGISK DAG
 MOLEKYLÆRBIOLOGISK DAG Velkommen til Molekylærbiologisk institutt, Universitetet i Bergen 5. mars 2015 Forsidebilde (fotograf: Marc Niere) Dyrkede celler som vokser og deler seg i det uendelige er et nyttig
MOLEKYLÆRBIOLOGISK DAG Velkommen til Molekylærbiologisk institutt, Universitetet i Bergen 5. mars 2015 Forsidebilde (fotograf: Marc Niere) Dyrkede celler som vokser og deler seg i det uendelige er et nyttig
Cytoskjelettet. plasmamembran. Terje Espevik IKM. plasmamembran. Oversikt over Aktinfilamenter Mikrotubuli Intermediærfilamenter
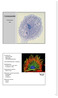 plasmamembran Cytoskjelettet Terje Espevik IKM plasmamembran Oversikt over Aktinfilamenter Mikrotubuli Intermediærfilamenter Intermediærfilamenter; inndeling Aktinfilamenter Struktur av G- og F-aktin Funksjoner
plasmamembran Cytoskjelettet Terje Espevik IKM plasmamembran Oversikt over Aktinfilamenter Mikrotubuli Intermediærfilamenter Intermediærfilamenter; inndeling Aktinfilamenter Struktur av G- og F-aktin Funksjoner
EKSAMEN I EMNE SIF4070 CELLEBIOLOGI Mandag 7. mai 2001 Tid: kl Ingen trykte eller håndskrevne hjelpemidler tillatt.
 Side av 5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglig kontakt under eksamen: Navn: Bjørn Torger Stokke Tlf: 93434 BOKMÅL EKSAMEN I EMNE SIF4070 CELLEBIOLOGI Mandag 7. mai
Side av 5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglig kontakt under eksamen: Navn: Bjørn Torger Stokke Tlf: 93434 BOKMÅL EKSAMEN I EMNE SIF4070 CELLEBIOLOGI Mandag 7. mai
FYS 3710 Biofysikk og Medisinsk Fysikk, Aminosyrer, Polypeptider, Proteiner
 FYS 3710 Biofysikk og Medisinsk Fysikk, 2016 5 Aminosyrer, Polypeptider, Proteiner Einar Sagstuen, Fysisk institutt, UiO 06.09.2016 1 sp n -hybridisering: for hovedkvantetall N=2 er de fire valensorbitalene
FYS 3710 Biofysikk og Medisinsk Fysikk, 2016 5 Aminosyrer, Polypeptider, Proteiner Einar Sagstuen, Fysisk institutt, UiO 06.09.2016 1 sp n -hybridisering: for hovedkvantetall N=2 er de fire valensorbitalene
... Proteiner og enzymer. kofaktor. polypeptid
 30 Proteiner og enzymer Proteiner er bygd opp av rekker av aminosyrer som er kveilet sammen ved hjelp av bindinger på kryss og tvers, såkalte peptidbindinger. Slike oppkveilete rekker av aminosyrer kaller
30 Proteiner og enzymer Proteiner er bygd opp av rekker av aminosyrer som er kveilet sammen ved hjelp av bindinger på kryss og tvers, såkalte peptidbindinger. Slike oppkveilete rekker av aminosyrer kaller
MOLEKYLÆRBIOLOGISK FAGDAG
 MOLEKYLÆRBIOLOGISK FAGDAG Velkommen til Molekylærbiologisk institutt, Universitetet i Bergen 8. mars 2017 Forsidebilde (fotograf: Marc Niere) Dyrkede celler som vokser og deler seg i det uendelige er et
MOLEKYLÆRBIOLOGISK FAGDAG Velkommen til Molekylærbiologisk institutt, Universitetet i Bergen 8. mars 2017 Forsidebilde (fotograf: Marc Niere) Dyrkede celler som vokser og deler seg i det uendelige er et
Genfeil i kreftsvulster nøkkelen til en mer persontilpasset behandling?
 Genfeil i kreftsvulster nøkkelen til en mer persontilpasset behandling? Hege G. Russnes Forsker ved Avd. For Genetikk, Institutt for Kreftforskning og overlege ved Avd. For Patologi Oslo Universitetssykehus
Genfeil i kreftsvulster nøkkelen til en mer persontilpasset behandling? Hege G. Russnes Forsker ved Avd. For Genetikk, Institutt for Kreftforskning og overlege ved Avd. For Patologi Oslo Universitetssykehus
Kreftforskning.no/myklebost. Eva Wessel Pedersen. Cancer Stem Cell Innovation Centre
 Stam Celler og Kreft Eva Wessel Pedersen Avdeling for Tumorbiologi,, Radium Hospitalet Cancer Stem Cell Innovation Centre Oversikt Stamceller generelt Hvorfor vi forsker på stamceller Kreft-stamceller
Stam Celler og Kreft Eva Wessel Pedersen Avdeling for Tumorbiologi,, Radium Hospitalet Cancer Stem Cell Innovation Centre Oversikt Stamceller generelt Hvorfor vi forsker på stamceller Kreft-stamceller
EKSAMENSOPPGAVE I BI2014 MOLEKYLÆRBIOLOGI
 Norges teknisk-naturvitenskapelige universitet Institutt for biologi EKSAMENSOPPGAVE I BI014 MOLEKYLÆRBIOLOGI Faglig kontakt under eksamen: Ralph Kissen Tlf.: 41344134 (mobil) - Eksamensdato: 11. desember
Norges teknisk-naturvitenskapelige universitet Institutt for biologi EKSAMENSOPPGAVE I BI014 MOLEKYLÆRBIOLOGI Faglig kontakt under eksamen: Ralph Kissen Tlf.: 41344134 (mobil) - Eksamensdato: 11. desember
Forløp av ikke-adaptiv og adaptiv immunrespons. Mononukleære celler, metylfiolett farging
 Forløp av ikke-adaptiv og adaptiv immunrespons Mononukleære celler, metylfiolett farging 1 Nøytrofile granulocytter Gjenkjennelsesprinsipper medfødt vs. adaptiv immunitet Toll Like Receptors Mikroorganismer
Forløp av ikke-adaptiv og adaptiv immunrespons Mononukleære celler, metylfiolett farging 1 Nøytrofile granulocytter Gjenkjennelsesprinsipper medfødt vs. adaptiv immunitet Toll Like Receptors Mikroorganismer
Molekylære metoder i medisinsk mikrobiologi.
 - 1 - Molekylære metoder i medisinsk mikrobiologi. Laboratorieøvelser onsdag 18.mars 2014. Øvelser: 5. Gelelektroforese på PCR produkt fra meca og nuc PCR fra dag 1 6. Mycobakterium genus FRET realtime
- 1 - Molekylære metoder i medisinsk mikrobiologi. Laboratorieøvelser onsdag 18.mars 2014. Øvelser: 5. Gelelektroforese på PCR produkt fra meca og nuc PCR fra dag 1 6. Mycobakterium genus FRET realtime
Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen.
 Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen. Forelesning for IB, mai 2012 Terje Espevik, IKM "What the?... This is lemonade! Where's my culture of amoebic
Intracellulær proteinsortering, endocytose, eksocytose.. riktig protein på riktig sted i cellen. Forelesning for IB, mai 2012 Terje Espevik, IKM "What the?... This is lemonade! Where's my culture of amoebic
4260 Mikrobiologi. Midtprøveoppgaver. 02. oktober 2013
 1 Høgskolen i Telemark Fakultet for allmennvitenskapelige fag 4260 Mikrobiologi Midtprøveoppgaver 02. oktober 2013 Tid: 2 timer Sidetall: 7 (40 spørsmål) Hjelpemidler: Ingen Velg kun ett svaralternativ
1 Høgskolen i Telemark Fakultet for allmennvitenskapelige fag 4260 Mikrobiologi Midtprøveoppgaver 02. oktober 2013 Tid: 2 timer Sidetall: 7 (40 spørsmål) Hjelpemidler: Ingen Velg kun ett svaralternativ
T celle aktivering og HLA Trond S. S. Halstensen
 T celle aktivering og HLA Trond S. S. Halstensen T-celler og Thymus T cellens identifisering av antigener Human Leukocyt Antigen (HLA) restriksjon, CD4 og CD8 Antigen prosessering: cytosol- og endocytisk
T celle aktivering og HLA Trond S. S. Halstensen T-celler og Thymus T cellens identifisering av antigener Human Leukocyt Antigen (HLA) restriksjon, CD4 og CD8 Antigen prosessering: cytosol- og endocytisk
Nr. 9/60 EØS-tillegget til Den europeiske unions tidende KOMMISJONSVEDTAK. av 21. februar 2002
 Nr. 9/60 EØS-tillegget til Den europeiske unions tidende 24.2.2005 KOMMISJONSVEDTAK 2005/EØS/9/09 av 21. februar 2002 om endring av vedlegg D til rådsdirektiv 90/426/EØF med hensyn til diagnostiske prøver
Nr. 9/60 EØS-tillegget til Den europeiske unions tidende 24.2.2005 KOMMISJONSVEDTAK 2005/EØS/9/09 av 21. februar 2002 om endring av vedlegg D til rådsdirektiv 90/426/EØF med hensyn til diagnostiske prøver
Kapittel 20, introduksjon
 Kapittel 20, introduksjon Ekstracellulær signalisering Syntese Frigjøring Transport Forandring av cellulær metabolisme, funksjon, utvikling (trigga av reseptor-signal komplekset) Fjerning av signalet Signalisering
Kapittel 20, introduksjon Ekstracellulær signalisering Syntese Frigjøring Transport Forandring av cellulær metabolisme, funksjon, utvikling (trigga av reseptor-signal komplekset) Fjerning av signalet Signalisering
EP Patentkrav. 1. En sammensetning som omfatter:
 1 Patentkrav EP2129 1 2 3 1. En sammensetning som omfatter: et fusjonsprotein som omfatter første og andre peptid-deler, karakterisert ved at nevnte første peptid-del består av en aminosyresekvens valgt
1 Patentkrav EP2129 1 2 3 1. En sammensetning som omfatter: et fusjonsprotein som omfatter første og andre peptid-deler, karakterisert ved at nevnte første peptid-del består av en aminosyresekvens valgt
Flervalgsoppgaver: Enzymer
 Flervalgsoppgaver - Enzymer Hver oppgave har ett riktig svaralternativ Enzym 1 Et enzym ekstraheres fra Sulfolobus acidocaldarius (en bakterie som finnes i sure, varme kilder med temperaturer opp til 90
Flervalgsoppgaver - Enzymer Hver oppgave har ett riktig svaralternativ Enzym 1 Et enzym ekstraheres fra Sulfolobus acidocaldarius (en bakterie som finnes i sure, varme kilder med temperaturer opp til 90
«Immunterapi» Kreftutvikling. Myelomatose. Immunterapi. Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU
 «Immunterapi» Kreftutvikling Myelomatose Immunterapi Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU 1 Kreft er genetiske sykdommer i den forstand at det alltid
«Immunterapi» Kreftutvikling Myelomatose Immunterapi Anders'Sundan Senter'for'myelomforskning Institutt'for'klinisk'og'molekylær'medisin,'NTNU 1 Kreft er genetiske sykdommer i den forstand at det alltid
FLERVALGSOPPGAVER - CELLEBIOLOGI
 FLERVALGSOPPGAVER - CELLEBIOLOGI Hvert spørsmål har ett riktig svaralternativ. Cellebiologi 1 Hvilken celleorganell er vanlig i både plante- og dyreceller? A) kloroplast B) cellevegg av cellulose C) mitokondrium
FLERVALGSOPPGAVER - CELLEBIOLOGI Hvert spørsmål har ett riktig svaralternativ. Cellebiologi 1 Hvilken celleorganell er vanlig i både plante- og dyreceller? A) kloroplast B) cellevegg av cellulose C) mitokondrium
Oncogenic Mutations Affecting Cell Proliferation
 Oncogenic Mutations Affecting Cell Proliferation Fra RTK til Nucleus (Boka s.1070-74) Normalt kreves et vekst stimulerende signal ( growth factor eks. PDGF, EGF, NGF) for at celler skal gå inn i celledeling,
Oncogenic Mutations Affecting Cell Proliferation Fra RTK til Nucleus (Boka s.1070-74) Normalt kreves et vekst stimulerende signal ( growth factor eks. PDGF, EGF, NGF) for at celler skal gå inn i celledeling,
Bruksanvisning IVD Matrix HCCA-portioned
 8290200 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til matriksassistert laserdesorpsjons-ionisasjon flytid for massespektrometri (MALDI-TOF-MS). CARE- produkter er utformet for å støtte
8290200 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til matriksassistert laserdesorpsjons-ionisasjon flytid for massespektrometri (MALDI-TOF-MS). CARE- produkter er utformet for å støtte
Fosfolipaser, identifikasjon av intracellulære signaliseringsdomener og integrering av multiple signal
 Fosfolipaser, identifikasjon av intracellulære signaliseringsdomener og integrering av multiple signal! Introduksjon! Intra/inter-cellulære lipid sek. budbringere! Fosfolipase A2! Fosfolipase C og D! Sfingomyelinase!
Fosfolipaser, identifikasjon av intracellulære signaliseringsdomener og integrering av multiple signal! Introduksjon! Intra/inter-cellulære lipid sek. budbringere! Fosfolipase A2! Fosfolipase C og D! Sfingomyelinase!
In vitro cytotoksisk effekt av venom fra vestlig honningbie (Apis mellifera) hos glioblastoma cellelinjer av typen U251 og C6.
 In vitro cytotoksisk effekt av venom fra vestlig honningbie (Apis mellifera) hos glioblastoma cellelinjer av typen U251 og C6. av Sivert Andreas Bruvoll Knutsen Masteroppgave i farmasi Juni 2008 Senter
In vitro cytotoksisk effekt av venom fra vestlig honningbie (Apis mellifera) hos glioblastoma cellelinjer av typen U251 og C6. av Sivert Andreas Bruvoll Knutsen Masteroppgave i farmasi Juni 2008 Senter
Antitrombin i laboratoriet
 Antitrombin i laboratoriet Carola Henriksson, Seksjonsoverlege, hematologiseksjonen, avdeling for medisinsk biokjemi, Oslo Universitetssykehus, Ullevål Hurdalsjøen, 8. juni Oslo Universitetssykehus (OUS)
Antitrombin i laboratoriet Carola Henriksson, Seksjonsoverlege, hematologiseksjonen, avdeling for medisinsk biokjemi, Oslo Universitetssykehus, Ullevål Hurdalsjøen, 8. juni Oslo Universitetssykehus (OUS)
Immunstimulanter for potensiering av torskens naturlige immunsystem
 Store programmer HAVBRUK - En næring i vekst Faktaark www.forskningsradet.no/havbruk Immunstimulanter for potensiering av torskens naturlige immunsystem Prosjekt: Immunostimulation of Atlantic cod (Gadus
Store programmer HAVBRUK - En næring i vekst Faktaark www.forskningsradet.no/havbruk Immunstimulanter for potensiering av torskens naturlige immunsystem Prosjekt: Immunostimulation of Atlantic cod (Gadus
'1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ
 '1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ $XGXQÃ1HUODQGÃ 'HWÃHUÃLQJHQÃWYLOÃRPÃDWÃYDNVLQHULQJÃHUÃHQÃDYÃKRYHGJUXQQHQHÃWLOÃDWÃILVNHRSSGUHWWÃ KDUÃYRNVWÃWLOÃHQÃDYÃ1RUJHVÃVW UVWHÃQ ULQJHUÃLÃO SHWÃDYÃGHÃVLVWHÃÃnUHQHÃ7UDVVÃLÃ
'1$YDNVLQHUÃHQÃQ\ÃYDNVLQDVMRQVVWUDWHJLÃ $XGXQÃ1HUODQGÃ 'HWÃHUÃLQJHQÃWYLOÃRPÃDWÃYDNVLQHULQJÃHUÃHQÃDYÃKRYHGJUXQQHQHÃWLOÃDWÃILVNHRSSGUHWWÃ KDUÃYRNVWÃWLOÃHQÃDYÃ1RUJHVÃVW UVWHÃQ ULQJHUÃLÃO SHWÃDYÃGHÃVLVWHÃÃnUHQHÃ7UDVVÃLÃ
PATENTKRAV. 2. Analog av glukagon (SEQ ID nr. 1) som har GIP-agonistaktivitet, med de. følgende modifiseringene:
 1 PATENTKRAV 1 2 1. Analog av glukagon (SEQ ID nr. 1) som har GIP-agonistaktivitet, med de følgende modifiseringene: (a) en aminosyremodifisering på posisjon 1 som overfører GIPagonistaktivitet, eventuelt
1 PATENTKRAV 1 2 1. Analog av glukagon (SEQ ID nr. 1) som har GIP-agonistaktivitet, med de følgende modifiseringene: (a) en aminosyremodifisering på posisjon 1 som overfører GIPagonistaktivitet, eventuelt
Nytte av prokalsitonin og nøytrofil CD64 som markør for postoperativ infeksjon
 Nytte av prokalsitonin og nøytrofil CD64 som markør for postoperativ infeksjon Kurs i hematologi 18. 19. mai 2015 KS møtesenter, Oslo Kristin Husby, Spesialbioingeniør Prosjektet er utført ved Tverrfaglig
Nytte av prokalsitonin og nøytrofil CD64 som markør for postoperativ infeksjon Kurs i hematologi 18. 19. mai 2015 KS møtesenter, Oslo Kristin Husby, Spesialbioingeniør Prosjektet er utført ved Tverrfaglig
Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU
 Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU 1 3 typer immunterapi; Antistoffer som aktiverer immunforsvaret mot kreftcellene. (Anti-CTLA4, -PD1/PD1L) Antistoffer som binder kreftceller
Hva er Immunterapi? Anders Sundan Senter for myelomforskning, NTNU 1 3 typer immunterapi; Antistoffer som aktiverer immunforsvaret mot kreftcellene. (Anti-CTLA4, -PD1/PD1L) Antistoffer som binder kreftceller
Medisin stadium 1A Geir Slupphaug, IKM. Den eukaryote cellen II
 Medisin stadium 1A Geir Slupphaug, IKM Den eukaryote cellen II Cellens hovedstrukturer og -funksjoner Plasma membran Cellekjernen Lipider proteiner Kjernemembran Nukleoplasma Omslutter cellen Regulerer
Medisin stadium 1A Geir Slupphaug, IKM Den eukaryote cellen II Cellens hovedstrukturer og -funksjoner Plasma membran Cellekjernen Lipider proteiner Kjernemembran Nukleoplasma Omslutter cellen Regulerer
Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu
 Forelesninger i BI 212 - Cellebiologi Biomembraner og subcellular organisering av eukaryote celler - Kap. 5 - vår 2002 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor-
Forelesninger i BI 212 - Cellebiologi Biomembraner og subcellular organisering av eukaryote celler - Kap. 5 - vår 2002 Tor-Henning Iversen, Plantebiosenteret (PBS),Botanisk institutt,ntnu e-mail : Tor-
Proteiner og proteinstrukturer
 Medisin stadium 1A Geir Slupphaug, IKM Proteiner og proteinstrukturer Alle proteiner er bygd opp av aminosyrer. Dette er en gruppe organiske molekyler som inneholder både en karboksylsyregruppe (-COOH)
Medisin stadium 1A Geir Slupphaug, IKM Proteiner og proteinstrukturer Alle proteiner er bygd opp av aminosyrer. Dette er en gruppe organiske molekyler som inneholder både en karboksylsyregruppe (-COOH)
Reproduksjon av dyrevirus. Adsorpsjon Penetrasjon og avkledning Replikasjon og transkripsjon Syntese og samling (assembly) av viruskapsid Frigjøring
 Reproduksjon av dyrevirus Adsorpsjon Penetrasjon og avkledning Replikasjon og transkripsjon Syntese og samling (assembly) av viruskapsid Frigjøring ATTACHMENT Click after each step to view process PENETRATION
Reproduksjon av dyrevirus Adsorpsjon Penetrasjon og avkledning Replikasjon og transkripsjon Syntese og samling (assembly) av viruskapsid Frigjøring ATTACHMENT Click after each step to view process PENETRATION
Den eukaryote cellen II Animalsk celle. Endoplasmatisk retikulum
 Medisin stadium 1A Geir Slupphaug, IKM Cellens hovedstrukturer og -funksjoner Den eukaryote cellen II Animalsk celle Plasma membran Cellekjernen Organeller Lipider proteiner Kjernemembran Nukleoplasma
Medisin stadium 1A Geir Slupphaug, IKM Cellens hovedstrukturer og -funksjoner Den eukaryote cellen II Animalsk celle Plasma membran Cellekjernen Organeller Lipider proteiner Kjernemembran Nukleoplasma
Silika nanopartikler endrer morfologi og øker glutamat cystein ligase - promotoraktiviteten i PC12-celler
 Silika nanopartikler endrer morfologi og øker glutamat cystein ligase - promotoraktiviteten i PC12-celler Taqwa Farajalla Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt
Silika nanopartikler endrer morfologi og øker glutamat cystein ligase - promotoraktiviteten i PC12-celler Taqwa Farajalla Masteroppgave i farmasi Avdeling for farmasøytisk biovitenskap Farmasøytisk institutt
Klinisk molekylærmedisin (5): Eksempler på funksjonelle analyser
 Pediatrisk Endokrinologi 2003;17: 64-69 Klinisk molekylærmedisin (5): Eksempler på funksjonelle analyser Pål Rasmus Njølstad 1,2,3, Lise Bjørkhaug 1 1 Seksjon for pediatri, Institutt for klinisk medisin
Pediatrisk Endokrinologi 2003;17: 64-69 Klinisk molekylærmedisin (5): Eksempler på funksjonelle analyser Pål Rasmus Njølstad 1,2,3, Lise Bjørkhaug 1 1 Seksjon for pediatri, Institutt for klinisk medisin
Drug design på data n
 22 Drug design på data n Aina Westrheim Ravna og Ingebrigt Sylte Hva skjer i hjernen når vi føler oss glade og optimistiske? Hvorfor virker penicillin mot bakterieinfeksjoner, mens paracet virker mot hodepine?
22 Drug design på data n Aina Westrheim Ravna og Ingebrigt Sylte Hva skjer i hjernen når vi føler oss glade og optimistiske? Hvorfor virker penicillin mot bakterieinfeksjoner, mens paracet virker mot hodepine?
FYS3710 Molekylærbiologi
 1 2 I en eukaryot celle er kromosomene festet i en indre membran som omgir en kjerne. Proteinene produseres i cellens cytoplasma. 3 I en prokaryot celle (for eksempel en bakteriecelle) er det ett kromosom.
1 2 I en eukaryot celle er kromosomene festet i en indre membran som omgir en kjerne. Proteinene produseres i cellens cytoplasma. 3 I en prokaryot celle (for eksempel en bakteriecelle) er det ett kromosom.
Syrer og sure løsninger
 Syrer og sure løsninger I denne aktiviteten skal du prøve ut noen egenskaper til syrer og sure løsninger Innhold 1 BTB (bromtymolblått) i dråpeteller (blå) 1 saltsyre i dråpeteller med tynn stilk 1 eddik
Syrer og sure løsninger I denne aktiviteten skal du prøve ut noen egenskaper til syrer og sure løsninger Innhold 1 BTB (bromtymolblått) i dråpeteller (blå) 1 saltsyre i dråpeteller med tynn stilk 1 eddik
Amplifikasjonsteknikker - andre metoder
 Amplifikasjonsteknikker - andre metoder Svein Arne Nordbø TH-28973 17.03.15 Alternative amplifikasjonsmetoder Templat-amplifikasjons metoder Signal-amplifikasjonsmetoder Templat-amplifikasjons metoder
Amplifikasjonsteknikker - andre metoder Svein Arne Nordbø TH-28973 17.03.15 Alternative amplifikasjonsmetoder Templat-amplifikasjons metoder Signal-amplifikasjonsmetoder Templat-amplifikasjons metoder
Sammenligningen mellom Arabidopsis thaliana genomet og de kjente genomene fra cyanobakterier, gjær, bananflue og nematode, viser bl. a.
 Sammenligningen mellom Arabidopsis thaliana genomet og de kjente genomene fra cyanobakterier, gjær, bananflue og nematode, viser bl. a. Antall gener som er involvert i cellulær kommunikasjon og signaloverføring
Sammenligningen mellom Arabidopsis thaliana genomet og de kjente genomene fra cyanobakterier, gjær, bananflue og nematode, viser bl. a. Antall gener som er involvert i cellulær kommunikasjon og signaloverføring
Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett)
 August 2015 QIAsymphony SP-protokollark Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett) Dette dokumentet er Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP
August 2015 QIAsymphony SP-protokollark Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP (brukervalidert for QIAsymphony DSP DNA Mini-sett) Dette dokumentet er Tissue_LC_200_V7_DSP og Tissue_HC_200_V7_DSP
Identifisering av PAX- og MMP-uttrykk i tre prostatakreft-cellelinjer
 HOVEDOPPGAVE I FARMAKOLOGI FOR MASTERGRADEN I FARMASI Identifisering av PAX- og MMP-uttrykk i tre prostatakreft-cellelinjer Av Elisabeth Weibust 2009 Utført ved Avdeling for farmakologi, Institutt for
HOVEDOPPGAVE I FARMAKOLOGI FOR MASTERGRADEN I FARMASI Identifisering av PAX- og MMP-uttrykk i tre prostatakreft-cellelinjer Av Elisabeth Weibust 2009 Utført ved Avdeling for farmakologi, Institutt for
Definisjoner Brønsted, 1923. En syre er et stoff som kan spalte av protoner En base er et stoff som kan ta opp protoner
 Syrer og baser Definisjoner Brønsted, 1923 En syre er et stoff som kan spalte av protoner En base er et stoff som kan ta opp protoner Syrer Genrelt uttrykk HB H + + B - syre H + + korresponderende base
Syrer og baser Definisjoner Brønsted, 1923 En syre er et stoff som kan spalte av protoner En base er et stoff som kan ta opp protoner Syrer Genrelt uttrykk HB H + + B - syre H + + korresponderende base
Hva er myelomatose? Hva er immunterapi?
 Hva er myelomatose? Hva er immunterapi? Anders Sundan Senter for myelomforskning KREFTFORENINGEN 1 Kreft er genetiske sykdommer i den forstand at det alltid er genetiske forandringer (mutasjoner) i kreftcellene
Hva er myelomatose? Hva er immunterapi? Anders Sundan Senter for myelomforskning KREFTFORENINGEN 1 Kreft er genetiske sykdommer i den forstand at det alltid er genetiske forandringer (mutasjoner) i kreftcellene
Hvordan standardisere en metode for isolering av plasmid til syntese av diabetes antigener?
 Hvordan standardisere en metode for isolering av plasmid til syntese av diabetes antigener? Ranveig Østrem, Bioingeniør Hormonlaboratoriet, Aker Oslo Universitetssykehus Bakgrunn for analysen Pasienter
Hvordan standardisere en metode for isolering av plasmid til syntese av diabetes antigener? Ranveig Østrem, Bioingeniør Hormonlaboratoriet, Aker Oslo Universitetssykehus Bakgrunn for analysen Pasienter
Oppgave 16.2 fortsetter
 Oppgave 16.2 fortsetter Vask av presipiteringsgeler for å fjerne ikke-presipitert protein (bakgrunn): Vask 3 x 15 min + 10 min press i fysiologisk saltvann /evt. over natt + 10 min. press. eretter 1 x
Oppgave 16.2 fortsetter Vask av presipiteringsgeler for å fjerne ikke-presipitert protein (bakgrunn): Vask 3 x 15 min + 10 min press i fysiologisk saltvann /evt. over natt + 10 min. press. eretter 1 x
Trombotisk Trombocytopenisk Purpura og ADAMTS13
 Trombotisk Trombocytopenisk Purpura og ADAMTS13 Bergen 14. september 2017 Bioingeniør Siri Lie Størkersen Seksjon spesiell biokjemi Avdeling for medisinsk biokjemi St Olavs hospital Analysering av ADAMTS13-aktivitet
Trombotisk Trombocytopenisk Purpura og ADAMTS13 Bergen 14. september 2017 Bioingeniør Siri Lie Størkersen Seksjon spesiell biokjemi Avdeling for medisinsk biokjemi St Olavs hospital Analysering av ADAMTS13-aktivitet
Den foreliggende oppfinnelsen vedrører et kompleks av agomelatin og fremstilling derav.
 1 Beskrivelse Teknisk område Den foreliggende oppfinnelsen vedrører et kompleks av agomelatin og fremstilling derav. Teknisk bakgrunn Strukturen av agomelatin (1), med det kjemiske navnet N-[2-(7-metoksy-1-
1 Beskrivelse Teknisk område Den foreliggende oppfinnelsen vedrører et kompleks av agomelatin og fremstilling derav. Teknisk bakgrunn Strukturen av agomelatin (1), med det kjemiske navnet N-[2-(7-metoksy-1-
Bruksanvisning IVD Matrix HCCA-portioned
 Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
Bruksanvisning IVD Matrix HCCA-portioned Renset matriksstoff til massespektrometri med matriksassistert laserdesorpsjonsionisasjonflytid (MALDI-TOF-MS). CARE- produkter er beregnet på å forsyne våre internasjonale
Proteiner og aminosyrer
 Proteiner og aminosyrer Presentasjonsplan 1/2 Cellen Grunnleggende komponenter DNA til mrna til proteiner Den genetiske koden: Hva er et codon? Presentasjonsplan 2/2 Aminosyrer del 1 Hvilke molekyler er
Proteiner og aminosyrer Presentasjonsplan 1/2 Cellen Grunnleggende komponenter DNA til mrna til proteiner Den genetiske koden: Hva er et codon? Presentasjonsplan 2/2 Aminosyrer del 1 Hvilke molekyler er
Cellebiologiske prosesser som respons på virusinfeksjon
 Cellebiologiske prosesser som respons på virusinfeksjon PBM 336 2005 Siri Mjaaland Infeksjoner - immunresponser 1 Figure 2-49 Interferoner Uspesifikk immunitet viral infeksjon stimulerer direkte produksjon
Cellebiologiske prosesser som respons på virusinfeksjon PBM 336 2005 Siri Mjaaland Infeksjoner - immunresponser 1 Figure 2-49 Interferoner Uspesifikk immunitet viral infeksjon stimulerer direkte produksjon
Cellemembraner, en kompleks mosaikk
 Cellemembraner, en kompleks mosaikk Espen Stang Institutt for patologi Rikshospitalet HF The role of microdomains in epidermal growth factor receptor activation and trafficking Hva menes med et mikrodomene
Cellemembraner, en kompleks mosaikk Espen Stang Institutt for patologi Rikshospitalet HF The role of microdomains in epidermal growth factor receptor activation and trafficking Hva menes med et mikrodomene
QIAsymphony SP protokollark
 QIAsymphony SP protokollark DNA_Blood_400_V6_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra friskt eller
QIAsymphony SP protokollark DNA_Blood_400_V6_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra friskt eller
Tuberkulose.
 Tuberkulose behov for mer effektiv behandling og nye vaksiner behov for å forstå vert-mikrobe forholdet bedre Persontilpasset behandling: immunterapi + antibiotika www.ntnu.edu/cemir Forskning på tuberkulose
Tuberkulose behov for mer effektiv behandling og nye vaksiner behov for å forstå vert-mikrobe forholdet bedre Persontilpasset behandling: immunterapi + antibiotika www.ntnu.edu/cemir Forskning på tuberkulose
Påvisning av anti dsdna men forskjellige metoder og teknikker. Innhold. Årsaksmekanismer. Metoder. Forekomst 13.02.2015
 Påvisning av anti dsdna men forskjellige metoder og teknikker Randi Karlsen Fagbioingeniør Seksjon for medisinsk immunologi Oslo Universitetssykehus Ullevål sykehus Februar 2015 Innhold Årsaksmekanismer?
Påvisning av anti dsdna men forskjellige metoder og teknikker Randi Karlsen Fagbioingeniør Seksjon for medisinsk immunologi Oslo Universitetssykehus Ullevål sykehus Februar 2015 Innhold Årsaksmekanismer?
Preanalyse. Kurs i Molekylærpatologi Oslo, juni 2017
 Preanalyse Kurs i Molekylærpatologi Oslo, 07.-08. juni 2017 Heidemarie Svendsen Bioingeniør Enhet for molekylærpatologi Avdeling for Patologi Oslo Universitetssykehus Innhold Prøvemateriale Preparering
Preanalyse Kurs i Molekylærpatologi Oslo, 07.-08. juni 2017 Heidemarie Svendsen Bioingeniør Enhet for molekylærpatologi Avdeling for Patologi Oslo Universitetssykehus Innhold Prøvemateriale Preparering
En rolle for MK5 i cellesyklus-progresjon?
 FACULTY OF HEALTH SCIENCES INSTITUTE OF PHARMACY DEPARTMENT OF PHARMACOLOGY En rolle for MK5 i cellesyklus-progresjon? Mohammad Reza F. Aghdam FAR-3901 Masteroppgave i Farmasi Master's Thesis in Pharmacy
FACULTY OF HEALTH SCIENCES INSTITUTE OF PHARMACY DEPARTMENT OF PHARMACOLOGY En rolle for MK5 i cellesyklus-progresjon? Mohammad Reza F. Aghdam FAR-3901 Masteroppgave i Farmasi Master's Thesis in Pharmacy
Selv. Trygg Ignorere. Farlig. Fremmed. Immunsystemet: Generelt, og om allergi spesielt. Immunsystemets utfordring. Medfødte og ervervete immunsystemet
 U N I V E R S I T E T E T I B E R G E N Immunsystemet: Generelt, og om allergi spesielt Silke Appel Broegelmanns Forskningslaboratorium Klinisk Institutt 2 Universitetet i Bergen silke.appel@ Immunsystemets
U N I V E R S I T E T E T I B E R G E N Immunsystemet: Generelt, og om allergi spesielt Silke Appel Broegelmanns Forskningslaboratorium Klinisk Institutt 2 Universitetet i Bergen silke.appel@ Immunsystemets
Idrett og energiomsetning
 1 Medisin stadium IA, Tonje S. Steigedal 2 ATP er den eneste forbindelsen som kan drive kontraksjon av musklene. ATPnivået i muskelcellene er imidlertid begrenset, og må etterfylles kontinuerlig. Ved ulike
1 Medisin stadium IA, Tonje S. Steigedal 2 ATP er den eneste forbindelsen som kan drive kontraksjon av musklene. ATPnivået i muskelcellene er imidlertid begrenset, og må etterfylles kontinuerlig. Ved ulike
Medikamentell Behandling
 www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
TEKNOMAT ER DET SÅ ENKELT?
 TEKNOMAT ER DET SÅ ENKELT? Tor Lea Gruppe for molekylær cellebiologi Institutt for kjemi, bioteknologi og matvitenskap 2111 2005 Innhold Dagens situasjon Alternativ kjøttproduksjon In vitro- kjøtt/laboratoriekjøtt
TEKNOMAT ER DET SÅ ENKELT? Tor Lea Gruppe for molekylær cellebiologi Institutt for kjemi, bioteknologi og matvitenskap 2111 2005 Innhold Dagens situasjon Alternativ kjøttproduksjon In vitro- kjøtt/laboratoriekjøtt
AMPK SOM REGULATOR AV MITOKONDRIELL BIOGENESE I EN NY REPORTER- CELLEMODELL
 AMPK SOM REGULATOR AV MITOKONDRIELL BIOGENESE I EN NY REPORTER- CELLEMODELL Bina Qassem Ahmed Senter for farmasi September 2011 Forord Forord Master oppgaven ble utført ved Seksjon for biomedisin, Universitet
AMPK SOM REGULATOR AV MITOKONDRIELL BIOGENESE I EN NY REPORTER- CELLEMODELL Bina Qassem Ahmed Senter for farmasi September 2011 Forord Forord Master oppgaven ble utført ved Seksjon for biomedisin, Universitet
QIAsymphony SP protokollark
 QIAsymphony SP protokollark DNA_Buffy_Coat_200_V7_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra frisk
QIAsymphony SP protokollark DNA_Buffy_Coat_200_V7_DSP-protokoll Generell informasjon Til in vitro-diagnostisk bruk. Denne protokollen brukes til rensing av totalt genomisk og mitokondrielt DNA fra frisk
