Hurtig metodevurdering
|
|
|
- Emil Hanssen
- 8 år siden
- Visninger:
Transkript
1 Hurtig metodevurdering Cosentyx (sekukinumab) behandling av plakkpsoriasis kost- nyttevurdering Vurdering av innsendt dokumentasjon Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst oppgi vår referanse. Statens legemiddelverk Tlf.: Kto Postboks 63, Kalbakken, 0901 Oslo Fax: Org.nr Besøksadresse: Sven Oftedals vei 8, 0950 Oslo
2 / Seksjon for legemiddelrefusjon/ David Mwaura side 2 av 24 FORORD Implementering av Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten skal bidra til at nye metoder som er aktuelle å innføre i spesialisthelsetjenesten blir vurdert på en systematisk måte i forhold til effekt og sikkerhet, samt konsekvenser for helsetjenesten og samfunnet før disse tas i rutinebruk. Hovedlinjene i det nye systemet er beskrevet i Nasjonal helse- og omsorgsplan og Stortingsmelding 10 ( ), God kvalitet trygge tjenester. De regionale helseforetak, Nasjonalt kunnskapssenter for helsetjenesten, Statens legemiddelverk og Helsedirektoratet samarbeider om oppgavene knyttet til etablering og implementering av det nye systemet. Samlet skal nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten bidra til rasjonell bruk av ressursene i helsetjenestene. Statens legemiddelverk har fått tildelt ansvar for utarbeidelse av hurtige metodevurderinger av enkeltstående legemidler. En hurtig metodevurdering er en systematisk kunnskapsoppsummering basert på forskning om effekt og sikkerhet samt vurdering av konsekvenser. For legemidler vil det som oftest dreie seg om budsjettkonsekvenser eller ressursallokering. Bevisbyrden knyttet til dokumentasjon for effekt, sikkerhet og kostnadseffektivitet ligger alltid hos MT-innehaver for aktuelt legemiddel. Legemiddelverket kan, ved behov, gi veiledning til legemiddelfirmaene. Legemiddelverket vurderer det innsendte datagrunnlaget for alle viktige kliniske utfall, angitt ressursbruk samt gitte forutsetninger for analysen utarbeidet av MT-innehaver, og de presenterte resultater. Legemiddelverket utfører ikke egne helseøkonomiske analyser. Legemiddelverket kan ved behov innhente tilleggsopplysninger og foreta egne beregninger av kostnader og kostnadseffektivitet ved bruk av innsendt modell. Metodevurderingene av legemidler skal understøtte kvalifiserte beslutninger om eventuell innføring, og prioriteringer som gjøres på Helseforetaksnivå. Legemiddelverket har ingen beslutningsmyndighet i dette systemet. Alle våre vurderinger publiseres og rapportene er tilgjengelig for allmennheten (
3 / Seksjon for legemiddelrefusjon/ David Mwaura side 3 av 24 OPPSUMMERING Bakgrunn Cosentyx (sekukinumab) er et nytt legemiddel til behandling av moderat til alvorlig plakkpsoriasis hos voksne som er aktuelle for systemisk behandling. Om lag 2400 pasienter er aktuelle for behandling med et av de biologiske legemidlene for plakkpsoriasis hvert år i Norge. Legemiddelverket har vurdert dokumentasjon som er innsendt av legemiddelprodusenten. Alvorlighet En nasjonal faglig retningslinje stiller krav til sykdomsaktivitet, varighet av sykdommen og tidligere behandling for bruk av biologiske legemidler ved plakkpsoriasis. Behandling med sekukinumab vil derfor være avgrenset til pasienter med moderat til alvorlig sykdom. Effekt og sikkerhet Sekukinumab er et monoklonalt antistoff som hemmer interleukin 17A (IL-17A). Dette er et nytt prinsipp i behandling av psoriasis. Sekukinumab er sammenlignet direkte med ustekinumab (Stelara) og etanercept (Enbrel) i kliniske studier. Sekukinumab viste bedre hudtilheling og tilsvarende bivirkninger sammenlignet med ustekinumab og etanercept. Over 70 % av pasientene fikk tilhelet eller nesten tilhelet hud etter 16 uker behandling med sekukinumab, sammenlignet med ca. 30 % for etanercept og 60 % for ustekinumab. Kostnadseffektivitet Legemiddelverket har vurdert om kostnadene ved bruk av sekukinumab står i et rimelig forhold til den nytten behandlingen gir, når vi sammenligner med kostnader og nytte av den behandlingen som gis i dag. Sekukinumab har vist bedre effekt og har tilsvarende legemiddelkostnad som ustekinumab og etanercept. Legemiddelverket mener derfor at sekukinumab er et kostnadseffektivt alternativ. Sekukinumab kan pga. mereffekten ha noe høyere pris enn ustekinumab og etanercept og fortsatt være kostnadseffektiv. Men hvor stor merkostnaden kan være, gir denne vurderingen ikke svar på. Dette fordi Novartis har valgt å kun sammenligne legemiddelkostnader.
4 / Seksjon for legemiddelrefusjon/ David Mwaura side 4 av 24 INNHOLDFORTEGNELSE FORORD... 2 OPPSUMMERING... 3 INNHOLDFORTEGNELSE... 4 LOGG... 5 ORDLISTE BAKGRUNN PSORIASIS ALVORLIGHETSGRAD BEHANDLING Behandling med sekukinumab (Cosentyx) Behandlingsretningslinjer Behandlingsalternativer Pasientgrunnlag INNSENDT KLINISK DOKUMENTASJON OVERSIKT OVER RELEVANTE, INNSENDTE STUDIER Utfallsmål Beskrivelse av studier HELSERELATERT LIVSKVALITET VURDERING AV INNSENDT KLINISK DOKUMENTASJON RELEVANS FOR NORSKE FORHOLD (PICO) KVALITET AV DOKUMENTASJONEN INNSENDT ØKONOMISK ANALYSE KRITISK VURDERING AV INNSENDT ØKONOMISK ANALYSE OPPSUMMERING DISKUSJON BUDSJETTKONSEKVENSER REFERANSER... 24
5 / Seksjon for legemiddelrefusjon/ David Mwaura side 5 av 24 LOGG Bestilling: Forslagstiller: Legemiddelfirma: Preparat: Virkestoff: Indikasjon: ATC-nr: ID-nr 2015_004: Cosentyx (sekukinumab) behandling av plakkpsoriasis kost- nyttevurdering Helsedirektoratet Novartis Norge AS Cosentyx sekukinumab Cosentyx er indisert til behandling av moderat til alvorlig plakkpsoriasis hos voksne som er aktuelle for systemisk behandling L04AC10 Prosess Saksbehandlingstid: 163 dager Rapport ferdigstilt: Utredere: Kirsti Hjelme og David Mwaura Kliniske eksperter: Nils-Jørgen Mørk Clara Gram Gjesdal Ragnhild Telnes Kliniske eksperter har bidratt med avklaringer av sentrale forutsetninger i analysen (bl.a. sammenlignende behandling, pasientgrunnlag og overførbarhet av studiedata til norsk klinisk praksis). Legemiddelverket er ansvarlig for rapportens innhold. Kliniske eksperter har ikke vært involvert i noen konsensusprosess eller hatt noen «peer-review» funksjon ved utarbeidelse av rapporten.
6 / Seksjon for legemiddelrefusjon/ David Mwaura side 6 av 24 ORDLISTE BSA DLQI IGA ITT NOK PASI PICO RCT Body Surface Area, refererer til utbredelse av psoriasis i prosent av hele kroppsoverflaten The Dermatology Life Quality Index, indeks som brukes for å vurdere helserelatert livskvalitet ved hudsykdommer. Investigator s Global Assessment, instrument for undersøkers vurdering av pasientens alvorlighetsgrad Intention to treat Norske kroner Psoriasis Area and Severity Index, klinisk skåringssystem som blir brukt for å fastslå utbredelse og alvorlighetsgrad av psoriasis Pasientpopulasjon Intervensjon Komparator - Utfallsmål Randomisert kontrollert studie
7 / Seksjon for legemiddelrefusjon/ David Mwaura side 7 av 24 1 BAKGRUNN 1.1 Psoriasis Psoriasis er en kronisk inflammatorisk hudsykdom med spontane bedringer og forverringer. Karakteristisk er rødt utslett med skjellende skorper. Mest typisk angripes ryggen og strekksidene på albuer og knær. Men utslettet kan finnes overalt på huden, inkludert hodebunn, negler, ører og kjønnsorganer. Utslettet kan forekomme i store, sammenhengende områder, som mindre flekker eller som små, spredte "knopper". De fleste har også kløe. Kronisk plakkpsoriasis er den vanligste formen, og utgjør ca. 90 % av alle tilfellene. Årsaken til psoriasis er ukjent. Genetiske faktorer predisponerer, men ytre faktorer som halsinfeksjon med betahemolytiske streptokokker eller legemidler (betareseptorantagonister, litium og klorokin) kan utløse sykdommen. Psoriasis forverres ofte i perioder med store psykiske påkjenninger og stress. 1.2 Alvorlighetsgrad Psoriasis kan oppleves som veldig stigmatiserende, men de færreste blir så hardt angrepet at det går ut over arbeidsevne eller muligheter til å fungere i det daglige. Leddsymptomer og alvorlig hånd- og fotpsoriasis kan påvirke arbeidsevnen. Det er en Nasjonal faglig retningslinje for bruk av TNF-α hemmere og andre biologiske betennelsesdempende legemidler innen dermatologi (1). I retningslinjen stilles det krav til sykdomsaktivitet, varighet av sykdommen og tidligere behandling for bruk av biologiske legemidler ved plakkpsoriasis Krav til sykdomsaktivitet: PASI (Psoriasis Area and Severity Index) 1 >10 BSA (Body Surface Area) 2 >10 % DLQI (The Dermatology Life Quality Index) 3 >10 aktiv psoriasis i minst 6 måneder. Krav til tidligere gjennomført behandling: Lysbehandling (UV-B, UV-B-TL 01 eller PUVA) i minst 3 måneder acitretin i adekvat dose i minst 3 måneder metotreksat i adekvat dose i minst 3 måneder. Behandling med sekukinumab vil derfor være avgrenset til pasienter med moderat til alvorlig plakkpsoriasis. 1 PASI - klinisk skåringssystem som blir brukt for å fastslå utbredelse og alvorlighetsgrad av psoriasis 2 BSA - utbredelse av psoriasis i prosent av hele kroppsoverflaten 3 DLQI - indeks som brukes for å vurdere helserelatert livskvalitet ved hudsykdommer
8 / Seksjon for legemiddelrefusjon/ David Mwaura side 8 av Behandling Lokalbehandling er tilstrekkelig for de fleste. Egenbehandling med oppbløtende fuktighetskrem og skjellfjerning med salisylsyre er viktig. For å dempe inflammasjon brukes topikale kortikosteroider gruppe III-IV og vitamin D-analoger. Lysbehandling er vanligvis neste steg. Systemisk behandling med metotreksat, acitretin eller ciklosporin vurderes ved dårlig effekt av lokalbehandling og ved kraftig, utbredt psoriasis. Biologiske betennelsesdempende legemidler (etanercept, adalimumab, infliksimab, ustekinumab og sekukinumab) er godkjent til behandling av voksne med moderat til alvorlig psoriasis som ikke har respondert på annen systemisk behandling, se kapittel Behandling med sekukinumab (Cosentyx) Indikasjon Godkjent indikasjon i preparatomtalen for sekukinumab er behandling av moderat til alvorlig plakkpsoriasis hos voksne som er aktuelle for systemisk behandling. De nasjonale faglige retningslinjene setter imidlertid strengere krav til sykdomsaktivitet og tidligere behandling for bruk av biologiske legemidler ved psoriasis, se kapittel Virkningsmekanisme Sekukinumab er et monoklonalt antistoff som hemmer interleukin 17A (IL-17A). IL-17A er et naturlig forekommende cytokin som er involvert i vanlige betennelses- og immunresponser. IL-17A er oppregulert i affisert hud hos pasienter med plakkpsoriasis. Ved å binde seg til og blokkere IL-17A, vil sekukinumab redusere immunaktiviteten og dermed symptomer som rødhet, hudfortykkelse og flassing ved plakkpsoriasis. Hemming av IL-17A er et nytt prinsipp i behandling av psoriasis. Dosering Anbefalt dose er 300 mg. Behandlingen innledes med ukentlige doseringer i ukene 0, 1, 2 og 3, og etterfølges av månedlig vedlikeholdsdoseringer fra uke 4. Hver dose på 300 mg gis som to subkutane injeksjoner på 150 mg. Pasienter som har fått opplæring i subkutan injeksjonsteknikk, kan injisere sekukinumab selv. Sekukinumab finnes i ferdigfylt sprøyte og ferdigfylt penn.
9 / Seksjon for legemiddelrefusjon/ David Mwaura side 9 av 24 Bivirkninger Sekukinumab kan øke risikoen for infeksjoner. De hyppigste rapporterte bivirkningene er øvre luftveisinfeksjoner (hyppigst nasofaryngitt, rhinitt). Andre vanlige bivirkninger er munnherpes, rennende nese, diaré og urticaria. Sekukinumab har vist en økning av candidainfeksjoner, noe som er forventet pga. virkningsmekanismen. Det vises til preparatomtalen for utfyllende informasjon (2) Behandlingsretningslinjer Nasjonal faglig retningslinje for bruk av TNF-α hemmere og andre biologiske betennelsesdempende legemidler innen revmatologi, gastroenterologi og dermatologi gir anbefalinger om forskrivning, kriterier for bruk av biologiske legemidler, aktuelle kontraindikasjoner mot behandling, oppfølging av pasienter under behandling og avslutning av behandling (1). Biologiske legemidler kan forskrives av spesialister i dermatologi. Forskrivingen skal godkjennes av fagmiljøet ved et offentlig eller ikke-kommersielt privat sykehus med minst to spesialister i dermatologi. Vedtak om forskrivning skal baseres på skriftlig dokumentasjon av pasientens sykehistorie, tidligere gjennomgått behandling og aktuell tilstand. Krav til sykdomsaktivitet ved plakkpsoriasis er PASI >10, BSA >10 %, DLQI >10 og aktiv psoriasis i minst 6 måneder. Krav til tidligere gjennomført behandling ved plakkpsoriasis er minst 3 måneders behandling med UV-B, UV-B-TL 01 eller PUVA, minst 3 måneders behandling med acitretin i adekvat dose og minst 3 måneders behandling med metotreksat i adekvat dose. Pasienten må være uten klare kontraindikasjoner, og skal kontrolleres regelmessig under pågående behandling med tanke på forekomst av behandlingsrelaterte komplikasjoner. De vesentligste kontraindikasjoner som det skal tas hensyn til er: infeksjoner, malignitet, multippel sklerose, hjertesvikt og tidligere alvorlig reaksjon på samme biologiske legemiddel. Alle pasienter skal under behandling med biologiske legemidler kontrolleres regelmessig av spesialist. Pasienter med plakkpsoriasis som etter 3 måneder behandling ikke har oppnådd en forbedring i PASI på minst 50 % fra baseline (eller i % BSA hvis PASI ikke er tilgjengelig) og en forbedring i DLQI på minst 5 poeng, bør som hovedregel skifte til annen behandling. Hvis en observerer et tydelig effekttap under langtidsbehandling (lenger enn 3 måneder) bør en vurdere å seponere biologisk legemiddel. Retningslinjen er under revisjon og denne forventes ferdig i 2016.
10 / Seksjon for legemiddelrefusjon/ David Mwaura side 10 av Behandlingsalternativer Biologiske legemidler med godkjent indikasjon for plakkpsoriasis er vist i tabellen under. Tabell 1 Biologiske legemidler til behandling av plakkpsoriasis. Virkningsmekanisme Virkestoff Handelsnavn Administrasjon TNF hemmer infliksimab Remsima, Remicade, Inflectra Infusjon TNF hemmer etanercept Enbrel Injeksjon, pasientadministrert TNF hemmer adalimumab Humira Injeksjon, pasientadministrert IL-12/IL-23 hemmer ustekinumab Stelara Injeksjon, pasientadministrert IL-17A-hemmer sekukinumab Cosentyx Injeksjon, pasientadministrert Valg av legemiddel styres av det årlige LIS-anbudet, der det billigste preparatet i utgangspunktet har blitt satt som førstevalg (3). Ved utgangen av 2014 var ustekinumab det mest brukte biologiske legemidlet for psoriasis med en estimert pasientandel på 38 %, mens etanercept, adalimumab og infliksimab hadde estimerte pasientandeler på henholdsvis 32 %, 22 % og 8 % 4. Ustekinumab er det legemidlet som øker mest i denne gruppen. Ifølge kliniske eksperter antas sekukinumab i hovedsak å være et alternativ til de andre pasientadministrerte biologiske legemidlene. Av disse er ustekinumab (Stelara) og etanercept (Enbrel) de mest brukte. Det forventes ikke at sekukinumab vil erstatte legemidlene til infusjon (infliksimab) i særlig grad. Legemiddelverket mener derfor at ustekinumab og etanercept er relevante sammenligninger i vurderingen av om sekukinumab er kostnadseffektiv behandling. Ustekinumab (Stelara) er et monoklonalt antistoff som hemmer IL-12 og IL-23. Ustekinumab er indisert til behandling av moderat til alvorlig plakkpsoriasis hos voksne som ikke responderer på, har en kontraindikasjon mot eller ikke tåler annen systemisk behandling inkludert ciklosporin, metotreksat eller PUVA. Etanercept (Enbrel) er en tumornekrosefaktor alfa (TNF-a)-hemmer. Etanercept er indisert til behandling av moderat til alvorlig plakkpsoriasis, som ikke har respondert på eller er 4 Beregnet av Novartis. Basert på tall fra Norsk pasientregister og Reseptregisteret.
11 / Seksjon for legemiddelrefusjon/ David Mwaura side 11 av 24 intolerante overfor annen systemisk behandling, inkludert ciklosporin, metotreksat eller PUVA, eller hvor slik behandling er kontraindisert. Etanercept er også indisert til behandling av barn og ungdom fra 6 års alder. Ustekinumab (Stelara) har vist bedre effekt enn etanercept (Enbrel) i en direkte sammenlignende studie (4) Pasientgrunnlag Novartis har estimert at 1450 pasienter fikk behandling med biologiske legemidler for plakkpsoriasis ved utgangen av Estimatet er basert på tall fra Norsk pasientregister og Reseptregisteret. Videre anslår Novartis at potensialet for behandling med biologiske legemidler er ca pasienter. Dette estimatet støttes av kliniske eksperter. 2 INNSENDT KLINISK DOKUMENTASJON 2.1 Oversikt over relevante, innsendte studier Tabell 2 Oversikt over kliniske studier for sekukinumab Studie Referanse Populasjon Intervensjon Sammenlikning Moderat til alvorlig plakkpsoriasis 1) ERASURE (A2302) (5, 6) FIXTURE (A2303) (5, 6) SCULPTURE (A2304) (6) STATURE (A2307) (6) N = 738 Moderat til alvorlig plakkpsoriasis 1) N = 1306 Moderat til alvorlig plakkpsoriasis 1) N = 966 Moderat til alvorlig plakkpsoriasis 1) partial responder fra studie A2304 sekukinumab 150 mg sekukinumab 300 mg sekukinumab 150 mg sekukinumab 300 mg Fast dosering sekukinumab 150 mg sekukinumab 300 mg sekukinumab 300 mg s.c. placebo etanercept 50 mg placebo Behandling ved behov sekukinumab 150 mg sekukinumab 300 mg sekukinumab 10 mg/kg i.v. FEATURE (A2308) (6, 7) JUNCTURE (A2309) (6, 8) N = 43 Moderat til alvorlig plakkpsoriasis 1) N = 171 Moderat til alvorlig plakkpsoriasis 1) Ferdigfylt sprøyte sekukinumab 150 mg sekukinumab 300 mg Ferdigfylt penn sekukinumab 150 mg placebo placebo
12 / Seksjon for legemiddelrefusjon/ David Mwaura side 12 av 24 CLEAR (A2317) N = 182 (9) Moderat til alvorlig plakkpsoriasis 1) sekukinumab 300 mg sekukinumab 300 mg ustekinumab 45 mg ustekinumab 90 mg N = 676 1) Moderat til alvorlig plakkpsoriasis diagnostisert minst 6 måneder tidligere og definert som PASI-skår 12, BSA 10 % og miga 3. Inkluderte pasienter var ikke tilstrekkelig kontrollert med topikal-, lys- og/eller systemisk behandling Utfallsmål Følgende utfallsmål for effekt av behandlingen er brukt i studiene: PASI (Psoriasis Area and Severity) er et skåringsverktøy for å beskrive utbredelse og alvorlighetsgrad (rødhet, tykkelse, skjelling) av psoriasis. PASI kan variere fra 0 til 72. De kliniske studiene rapporterer hvor stor prosentreduksjon av PASI-skår som er oppnådd i løpet av behandlingstiden. PASI 75 betyr at pasienten har oppnådd en 75 % reduksjon av PASI-skåren etter behandling. PASI 50, PASI 90 og PASI 100 blir også brukt. IGA (Investigator s Global Assessment) mod 2011 er et instrument for undersøkers vurdering av pasientens alvorlighetsgrad av psoriasis ved vurderingstidspunktet. Dette er en 5-poengsskala fra 0 (tilhelet) til 4 (alvorlig sykdom). Respons ved bruk av denne skalaen var i studiene definert som en IGA (mod 2011)-skår på 0 (tilhelet) eller 1 (nesten tilhelet) og i tillegg en reduksjon fra baseline på minst 2 poeng Beskrivelse av studier Legemiddelverket mener at studiene FIXTURE og CLEAR er mest relevante for denne metodevurderingen. I disse studiene blir sekukinumab sammenlignet direkte med legemidler som er mye brukt i norsk klinisk praksis i dag, hhv. etanercept og ustekinumab. Det er også disse studiene som ligger til grunn for kostnadseffektivitetsvurderingen av sekukinumab. FIXTURE: sekukinumab vs. etanercept Tabell 3 Metode FIXTURE FIXTURE (5, 6) Design Pasientpopulasjon Randomisert, dobbeltblindet, dobbel dummy, parallelle grupper, multisenter Fase 3 52 uker 18 år Moderat til alvorlig plakkpsoriasis diagnostisert minst 6 mnd. tidligere
13 / Seksjon for legemiddelrefusjon/ David Mwaura side 13 av 24 Intervensjon Komparatorer Primære utfallsmål Sekundære utfallsmål PASI-skår 12, BSA 10 %, IGA (mod 2011) 3 Ikke tilstrekkelig kontrollert med topikal-, lys- og/eller systemisk behandling N = 1306 sekukinumab 150 mg (n=327) sekukinumab 300 mg (n=327) etanercept 50 mg (n=326) placebo (n=326) PASI 75 uke 12, superiority vs. placebo IGA (mod 2011) 0/1 uke 12, superiority vs. placebo Ved uke 12: PASI 90, superiority vs. placebo PASI 75, superiority vs. etanercept PASI 75, non-inferiority vs. etanercept IGA (mod 2011) 0/1, superiority vs. etanercept Resultater effekt Vedvarende respons uke 52, superiority vs. etanercept DLQI 0/1 uke 12 og uke 52 Bivirkninger I FIXTURE ble det vist at sekukinumab hadde bedre effekt enn både etanercept og placebo for primære og sekundære utfallsmål. Median tid til PASI 50 var signifikant kortere for sekukinumab enn for etanercept, hhv. 3 uker og 7 uker, p<0,001. Tabell 4 Effektresultater fra FIXTURE sekukinumab 300 mg N = 323 etanercept N = 323 placebo N = 324 PASI 100 uke (24 %) 14 (4 %) 0 (0 %) uke (37 %) 24 (7 %) - uke (36 %) 32 (10 %) - PASI 90 uke (54 %) 67 (21 %) 5 (1,5 %) uke (72 %) 101 (31 %) - uke (65 %) 108 (33 %) - PASI 75 uke 12 (primært endepunkt) 249 (77 %)* 142 (44 %) 16 (5 %) uke (87 %) 189 (59 %) - uke (79 %) 179 (55 %) - IGA (mod 2011) 0/1 uke 12 (primært endepunkt) 202 (63 %)* 88 (27 %) 9 (3 %) uke (76 %) 127 (39 %) - uke (68 %) 120 (37 %) - *P < 0,001 for sammenligningen med etanercept.
14 / Seksjon for legemiddelrefusjon/ David Mwaura side 14 av 24 Respons ved uke 12 ble opprettholdt hos de fleste pasientene til uke 52, og var høyere for sekukinumab enn for etanercept. Tabell 5 Respons over tid i FIXTURE sekukinumab 300 mg etanercept Opprettholdt PASI 75 uke /249 (84,3 %) 103/142 (72,5 %) Opprettholdt IGA (mod 2011) 0/1 uke /202 (79,7 %) 50/88 (56,8 %) Figur 1 Effekt over tid i FIXTURE. Andel pasienter (%) som oppnådde PASI 75 fra 0 til 52 uker med behandling. Novartis har i løpet av vurderingen supplert med 2-årsdata for sekukinumab. De 995 pasientene som oppnådde PASI 75 i FIXTURE og ERASURE har blitt randomisert 2:1 til å fortsette med samme dose sekukinumab eller placebo. Av pasientene som fikk sekukinumab 300 mg var det 87,1 % av pasientene som ikke hadde fått tilbakefall etter 104 uker. Resultater bivirkninger FIXTURE viste tilsvarende forekomst av bivirkninger for sekukinumab og etanercept. Andelen pasienter som opplevde minst en bivirkning var 80,5 % for sekukinumab og 78,3 % for etanercept i løpet av hele studieperioden. De vanligste bivirkningene i sekukinumabgruppen var nasofaryngitt, hodepine og diaré. Candidainfeksjoner var mer vanlig med sekukinumab enn med etanercept, 22 pasienter (4,7 %) som fikk sekukinumab 300 mg rapporterte mild eller moderat candidainfeksjon.
15 / Seksjon for legemiddelrefusjon/ David Mwaura side 15 av 24 CLEAR: sekukinumab vs. ustekinumab Tabell 6 Metode CLEAR CLEAR (9) Design Pasientpopulasjon Intervensjon Komparator Primært utfallsmål Sekundære utfallsmål Randomisert, dobbeltblindet, dobbel dummy, parallelle grupper, multisenter Fase 3b 52 uker 18 år Moderat til alvorlig plakkpsoriasis diagnostisert minst 6 mnd. tidligere PASI-skår 12, BSA 10 %, IGA (mod 2011) 3 Ikke tilstrekkelig kontrollert med topikal-, lys- og/eller systemisk behandling N = 676 Sekukinumab 300 mg Pasienter 100 kg: ustekinumab 45mg Pasienter > 100 kg: ustekinumab 90 mg PASI 90 uke 16, superiority vs. ustekinumab PASI 75 uke 4, superiority vs. ustekinumab PASI 90 uke52, superiority vs. ustekinumab PASI 75/90/100 IGA (mod 2011) 0/1 DLQI Bivirkninger Resultater effekt CLEAR-studien viste at sekukinumab hadde bedre effekt enn ustekinumab for det primære endepunktet PASI 90 etter 16 uker behandling. PASI 90 ble oppnådd av 79,0 % av pasientene som fikk sekukinumab og 57,6 % av pasientene som fikk ustekinumab etter 16 uker. Klinisk respons kom tidligere og var større med sekukinumab enn med ustekinumab. Tabell 7 Effektresultater fra CLEAR sekukinumab N = 334 ustekinumab N = 335 p-verdi PASI 100 uke (44 %) 95 (28 %) <0,0001 uke 4 14 (4 %) 3 (1 %) 0,0139 PASI 90 uke 16 (primært endepunkt) 264 (79 %) 193 (58 %) <0,0001 uke 4 70 (21 %) 18 (5 %) <0,0001 PASI 75 uke (93 %) 277 (83 %) 0,0001 uke (50 %) 69 (21 %) <0,0001 IGA (mod 2011) 0/1 uke (83 %) 226 (68 %) <0,0001 Studien er pågående. Resultater ved uke 52 vil komme senere.
16 / Seksjon for legemiddelrefusjon/ David Mwaura side 16 av 24 Resultater bivirkninger Sikkerhetsprofilen for sekukinumab var tilsvarende som for ustekinumab og i samsvar med pivotale fase 3-studier med sekukinumab. Andelen pasienter som opplevde minst en bivirkning var 64,2 % for sekukinumab og 58,3 % for ustekinumab. De vanligste bivirkningene var hodepine og nasofaryngitt. Insidensen av alvorlige bivirkninger var 3 % i begge grupper. 2.2 Helserelatert livskvalitet I de kliniske studiene er helserelatert livskvalitet målt bl.a. ved bruk av DLQI (the Dermatology Life Quality Index). Sekukinumab ga en større forbedring i helserelatert livskvalitet enn ustekinumab, etanercept og placebo i de kliniske studiene. I CLEAR var andel pasienter som oppnådde en DLQI-skår på 0/1 ved uke 16 statistisk signifikant høyere med sekukinumab (71,9 %) enn med ustekinumab (57,4 %). I FIXTURE var det var det 56,7 % i sekukinumab-gruppen (300 mg) og 34,5 % i etanercept-gruppen som oppnådde DLQI-skår 0/1 ved uke 12. Ved uke 52 var andelene 69,7 % for sekukinumab og 46,9 % for etanercept. 3 VURDERING AV INNSENDT KLINISK DOKUMENTASJON 3.1 Relevans for norske forhold (PICO) 5 Studiepopulasjon i forhold til klinisk praksis (P) Krav til sykdomsaktivitet for pasienter som ble inkludert i sekukinumab-studiene samsvarer langt på vei med de kravene som stilles i den nasjonale faglige retningslinjen for biologisk behandling ved plakkpsoriasis. I retningslinjen er kravene PASI-skår >10, BSA >10 % og DLQI >10, mens inklusjonskriterier i studiene var PASI-skår 12, BSA 10 %, IGA (mod 2011) 3. Ved baseline i FIXTURE hadde pasientene i gjennomsnitt PASI-skår 23,7, BSA 34,4 % og DLQI-skår 13,3 13,4. I CLEAR var gjennomsnittlig PASI-skår 21,7 og BSA 32,6 % ved baseline i sekukinumab-armen. I både retningslinjene og studiene er det i tillegg krav til at pasientene har hatt aktiv psoriasis i minst 6 måneder. Det stilles imidlertid strengere krav til tidligere gjennomført behandling i retningslinjen enn i studiene. Retningslinjen krever at både lysbehandling, acitretin og metotrexat er prøvd i minst 3 måneder hver. Studiene inkluderte pasienter som ikke var tilstrekkelig kontrollert med topikal-, lys- og/eller systemisk behandling. I CLEAR og FIXTURE var det om lag 1/3 av pasientene som ikke hadde fått systemisk psoriasisbehandling tidligere. Det er usikkert hvordan dette eventuelt kan påvirke overførbarheten av studiedata til norsk klinisk praksis. Kliniske eksperter sier at det kan vise seg å bli færre respondere i klinisk praksis enn vist i studiene, men at dette i så tilfelle vil gjelde både sekukinumab og ustekinumab/etanercept. 5 Patients, Intervention, Comparator, Outcome
17 / Seksjon for legemiddelrefusjon/ David Mwaura side 17 av 24 Intervensjon i forhold til klinisk praksis (I) Anbefalt dose sekukinumab i godkjent preparatomtale er 300 mg. Denne dosen er også brukt i studiene. FIXTURE og andre fase 3-studier hadde også en behandlingsarm med sekukinumab 150 mg. Dosen på 300 mg har imidlertid vist bedre hudtilheling i alle studiene, og er derfor anbefalt dose. Komparator i forhold til klinisk praksis (C) Ustekinumab og etanercept vurderes å være relevante komparatorer for norsk klinisk praksis. Sekukinumab antas å delvis ville erstatte andre pasientadministrerte biologiske legemidler i klinisk praksis, herunder ustekinumab og etanercept som er de mest brukte i dag. Det er derfor en styrke ved dokumentasjonen at det er gjort studier der sekukinumab er sammenlignet direkte med hhv. ustekinumab og etanercept. Dosering av ustekinumab og etanercept i studiene er i tråd med godkjente preparatomtaler, Utfallsmål (O) Det er brukt relevante og anerkjente utfallsmål for effekt i studiene. Både utfallsmål vurdert av utprøver og av pasient har blitt brukt. I retningslinje for klinisk utprøving av legemidler for psoriasis anbefaler Europeiske legemiddelmyndigheter å bruke to endepunkter for å vurdere effekt: en validert, standardisert global score (eks. PGA Physician s Global Assesment) samtidig med PASI (10). Novartis har brukt en modifisert 5-punkts IGA-skala (IGA mod 2011) i stedet for 6-punkts skalaen PGA. IGA (mod 2011) har en strengere definisjon av «almost clear» enn PGA. Utfallsmålene PASI 75/PASI 90 og IGA (mod 2011) 0/1 vurderes å samsvare med klinisk relevant effekt. DLQI er en indeks som er godt etablert for å vurdere helserelatert livskvalitet ved hudsykdommer. Skjemaet er oversatt til norsk og validert på norske pasienter. 3.2 Kvalitet av dokumentasjonen Det ble brukt sentral, skjult randomiseringsprosedyre. Behandlingsarmene i studiene var godt balansert mht. demografiske og prognostiske faktorer, eks. utbredelse og alvorlighetsgrad av psoriasis og tidligere behandling. I CLEAR var det en liten forskjell i forekomst av psoriasisartritt mellom behandlingsarmene, hhv. 20,5 % sekukinumab-armen og 15,9 % i ustekinumab-armen. Det var heller ikke noen uventet ubalanse i andelen pasienter som stoppet behandling med studiemedisin i de ulike behandlingsarmene. Blinding er ivaretatt ved dobbel dummy design i både CLEAR og FIXTURE siden sekukinumab og komparatorene har ulike doseringsregimer.
18 / Seksjon for legemiddelrefusjon/ David Mwaura side 18 av 24 Det er brukt relevante og anerkjente utfallsmål. Lengste oppfølgingstid i de publiserte studiene er 52 uker. Toårsdata har nylig blitt offentliggjort og treårsdata vil komme i Det er derfor foreløpig lite kunnskap om i hvilken grad det vil være avtagende respons av sekukinumab hos noen pasienter slik det er for andre biologiske legemidler, pga. nøytraliserende antistoffer eller andre mekanismer. Oppsummering: Sekukinumab har i CLEAR og FIXTURE vist bedre hudtilheling ved psoriasis enn hhv. ustekinumab og etanercept. Studiene er gjennomført med god metodologi og liten risiko for bias. Studiene inkluderte en andel pasienter som ikke hadde fått systemisk behandling tidligere. Foreløpig er det også sparsomt med langtidsdata som kan si noe om evt. avtagende effekt. Dette er forhold som kan bidra til at effekten i norsk klinisk praksis kan bli lavere enn det som ble vist i de kliniske studiene. 4 INNSENDT ØKONOMISK ANALYSE Søker har levert en kostnadsminimeringsanalyse der sekukinumab sammenlignes med ustekinumab. I tillegg er legemiddelkostnadene for sekukinumab sammenlignet med øvrige pasientadministrerte biologiske legemidler til behandling av plakkpsoriasis. CLEAR-studien viste at sekukinumab har bedre effekt og tilsvarende bivirkninger sammenlignet med ustekinumab. Søker har sammenlignet legemiddelkostnadene mellom sekukinumab og ustekinumab. Andre kostnader vurderes å være tilsvarende for de to behandlingene, og er ikke tatt med i analysen. Prissammenligningen er basert på LIS-avtaler for 2015 og «Regneark-TNF-BIO-2015-LM- Kostnader» er brukt i beregningene (3). Novartis har levert LIS-tilbud på sekukinumab for For sekukinumab innledes behandlingen med ukentlige doseringer i ukene 0, 1, 2 og 3, og etterfølges av månedlig vedlikeholdsdoseringer fra uke 4. Ustekinumab gis i uke 0 og 4 ved oppstart, og deretter hver 12. uke. Begge legemidlene injiseres subkutant, og pasienter som har fått opplæring, kan injisere selv. Tabell 8 Antall årlige doseringer for sekukinumab og ustekinumab. Kilde: Novartis Antall doseringer år 1 Antall doseringer påfølgende år sekukinumab 15,08 12,00 ustekinumab 5,01 4,35 Hver dose sekukinumab er på 300 mg, og gis som to subkutane injeksjoner på 150 mg. For ustekinumab er anbefalt startdose 45 mg til pasienter med kroppsvekt 100 kg, og 90 mg for pasienter med kroppsvekt > 100 kg. Novartis viser til at salget av de to styrkene fordelte
19 / Seksjon for legemiddelrefusjon/ David Mwaura side 19 av 24 seg 76 % av 45 mg og 24 % av 90 mg i 2014 (Kilde: Farmastat). I beregning av kostnaden for ustekinumab, har Novartis brukt et vektet gjennomsnitt av pris på 45 mg og 90 mg basert på denne salgsfordelingen. Tabell 9 Sammenligning av årskostnader for sekukinumab og ustekinumab. Kilde: Novartis Legemiddel Kostnad 1. år Kostnad 2. år Gjennomsnittlig årskostnad etter 2 år Gjennomsnittlig årskostnad etter 3 år sekukinumab 300 mg ustekinumab 45 mg/90 mg Denne sammenligningen viser at legemiddelkostnaden for sekukinumab er noe høyere enn for ustekinumab det første året, og deretter lavere i påfølgende behandlingsår. Novartis har også sammenlignet årskostnader for sekukinumab og alle de pasientadministrerte biologiske legemidlene for plakkpsoriasis. Legemiddelkostnadene er basert på LIS-priser for Figur 2 Sammenligning av årskostnader for pasientadministrerte biologiske legemidler til behandling av plasspsoriasis. Kilde: Novartis Denne sammenligningen viser at gjennomsnittlig legemiddelkostnad for sekukinumab er enten lavere eller på nivå med gjennomsnittlig legemiddelkostnad for andre pasientadministrerte biologiske legemidler til behandling av plakkpsoriasis. Ifølge Novartis er dette et konservativt anslag da de har brukt billigste årskostnad for etanercept. Novartis argumenterer med at den reelle årskostnaden for etanercept er høyere
20 / Seksjon for legemiddelrefusjon/ David Mwaura side 20 av 24 siden en stor andel av pasientene må ha dobbel dosering de første 12 ukene og/eller høyere vedlikeholdsdosering enn standard doseringsanbefaling i preparatomtalen. 4.1 Kritisk vurdering av innsendt økonomisk analyse Analysemetode Det er vist i direkte sammenlignende studier (CLEAR, FIXTURE) at sekukinumab har bedre effekt og tilsvarende bivirkningsprofil som ustekinumab og etanercept. I tillegg er gjennomsnittlig legemiddelkostnad for sekukinumab ikke høyere enn for ustekinumab og etanercept. På dette grunnlaget mener Legemiddelverket at en kostnadsminimeringsanalyse er tilstrekkelig for å vurdere at sekukinumab er kostnadseffektiv behandling. Denne analysemetoden kan imidlertid ha begrenset nytteverdi i påfølgende LIS-anbud. Sekukinumab kan pga. mereffekten ha noe høyere pris enn ustekinumab og etanercept og fortsatt være kostnadseffektiv. Men hvor stor merkostnaden kan være, gir denne vurderingen ikke svar på. Dette ville kreve en kostnad-per-qaly analyse (CUA). Med dette har Novartis derfor dokumentert at sekukinumab er et kostnadseffektivt alternativ kun hvis prisen på sekukinumab er på samme nivå eller lavere enn for hhv. ustekinumab og etanercept. Administrasjonskostnader Sekukinumab doseres hyppigere enn ustekinumab, både ved oppstart og vedlikeholdsbehandling (se Tabell 8). Dette er en ulempe ved sekukinumab som ikke er tatt med i beregningene. Ifølge kliniske eksperter kan de fleste pasientene administrere disse legemidlene selv. Et fåtall pasienter kan trenge hjelp av helsepersonell (fastlege, hjemmesykepleie) til å sette sprøytene. Administrasjon av legemidlene kan derfor være forbundet med kostnader for helsepersonell, tidsbruk for pasienten (reisetid, behandlingstid) og eventuelt ubehag for pasienten ved sprøytestikk. Selv om slike kostnader vil være høyere for sekukinumab enn for ustekinumab, vurderer Legemiddelverket at dette ikke vil påvirke kostnadseffektiviteten av sekukinumab i vesentlig grad. Administrasjonskostnadene vil være små sammenlignet med legemiddelkostnadene. Pasientvekt Sekukinumab gis i samme dose (300 mg) til alle pasienter, uavhengig av pasientvekt. For ustekinumab er anbefalt dose 45 mg til pasienter med kroppsvekt 100 kg, og 90 mg for pasienter med kroppsvekt > 100 kg. Legemiddelkostnaden er lavere for 45 mg enn for 90 mg. For pasienter 100kg vil ustekinumab derfor være et billigere alternativ enn sekukinumab. Men om ustekinumab vil være et kostnadseffektivt alternativ til denne pasientgruppen er likevel ikke kjent da effekten også er dårligere enn for sekukinumab. Legemiddelverket har imidlertid ikke bedt Novartis om å analysere dette. Legemiddelverket er enig med Novartis i at kostnadseffektivitetsvurderingen av sekukinumab gjøres for en «gjennomsnittspasient». I beregning av legemiddelkostnaden for ustekinumab, har Novartis brukt et vektet gjennomsnitt av pris på 45 mg og 90 mg basert på salgsfordelingen mellom
21 / Seksjon for legemiddelrefusjon/ David Mwaura side 21 av 24 styrkene i Legemiddelverket ser at salgstall per juli 2015 viser omtrent samme fordeling. 4.2 Oppsummering Sekukinumab har vist bedre effekt og har tilsvarende legemiddelkostnad som ustekinumab og etanercept. Legemiddelverket mener derfor at sekukinumab er et kostnadseffektivt alternativ. 5 DISKUSJON Behandling av plakkpsoriasis med biologiske legemidler er avgrenset til pasienter med moderat til alvorlig sykdom. I den nasjonale faglige retningslinjen stilles det krav til sykdomsaktivitet, varighet av sykdommen og tidligere behandling. Sekukinumab har vist en klinisk relevant hudtilheling for pasienter med moderat til alvorlig psoriasis. I de direkte sammenlignende studiene CLEAR og FIXTURE har sekukinumab vist bedre effekt og tilsvarende bivirkninger som hhv. ustekinumab og etanercept. Dokumentasjon for effekt bygger på kliniske data fra randomiserte kontrollerte studier med god metodologisk kvalitet. Novartis har valgt å bruke en kostnadsminimeringsanalyse for å dokumentere kostnadseffektiviteten av sekukinumab i behandling av moderat til alvorlig plakkpsoriasis. Novartis har dermed kun dokumentert at sekukinumab er et kostnadseffektivt alternativ hvis prisen på sekukinumab er på samme nivå eller lavere enn for hhv. ustekinumab og etanercept. Denne analysen kan derfor ha begrenset nytteverdi i påfølgende LIS-anbud. 6 BUDSJETTKONSEKVENSER Budsjettvirkningen for år 1-5 etter innføring er basert på antagelsen om at metoden vil bli anbefalt for bruk av de regionale helseforetakene og evt. implementert i retningslinjene til Helsedirektoratet. En ser derfor på to scenarier: A) Metoden blir anbefalt for bruk av de regionale helseforetakene for indikasjonen denne rapporten dreier seg om B) Metoden blir ikke anbefalt for bruk. Budsjettvirkningen blir differansen mellom budsjettvirkningene i de to scenariene Under presenteres budsjettestimat fra Novartis. Legemiddelverket mener det er rimelig å anta at sekukinumab kommer til å fortrenge ustekinumab og TNF-hemmere i større grad enn det som er estimert av Novartis.
22 / Seksjon for legemiddelrefusjon/ David Mwaura side 22 av 24 Estimat av antall pasienter som er aktuelle for behandling Antall pasienter som er forventet å bli behandlet med sekukinumab i de første fem årene er presentert i tabellene under. Tabell 10 Antall pasienter som er forventet å bli behandlet med sekukinumab den neste femårs-perioden dersom legemidlet anbefales brukt År 1 År 2 År 3 År 4 År 5 sekukinumab ustekinumab 45mg/90mg TNF-hemmere Total populasjon Tabell 11 Antall pasienter som er forventet å bli behandlet med sekukinumab den neste femårs-perioden dersom legemidlet IKKE anbefales brukt År 1 År 2 År 3 År 4 År 5 sekukinumab ustekinumab 45mg/90mg TNF-hemmere Total populasjon Søker har benyttet en gjennomsnittlig årskostnad for 3 år i beregningen av utgifter. De estimerte budsjettvirkninger av behandling med sekukinumab ifølge disse forutsetningene er presentert i tabellen under. Tabell 12 Totale forventet budsjettvirkning for alle alternative tiltak og sekukinumab ved plakkpsoriasis Totale utgifter for spesialisthelsetjenesten for alle alternative tiltak om sekukinumab vedtas innført Totale utgifter for spesialisthelsetjenesten for alle alternative tiltak om sekukinumab ikke innføres Budsjettvirkning av anbefaling
23 / Seksjon for legemiddelrefusjon/ David Mwaura side 23 av 24 Konklusjon budsjettkonsekvenser: Basert på data og antagelser over har Novartis estimert at å behandle aktuelle pasienter med sekukinumab vil ha en total årlig budsjettbesparelse på 1,8 mill NOK inkl mva i det femte budsjettåret. Legemiddelverket mener dette er et konservativt anslag. Hvis sekukinumab i større grad fortrenger alternativene, vil besparelsen bli større. Budsjettberegningene er usikre og forenklede spesielt gitt at utviklingen i denne sykdomsgruppen forventes å endre seg årlig på grunn av LIS anbudspriser og anbefalinger samt kommende nye legemidler. Statens legemiddelverk, Elisabeth Bryn (e.f.) avdelingsdirektør Kristin Helene Svanqvist seksjonssjef
24 / Seksjon for legemiddelrefusjon/ David Mwaura side 24 av 24 REFERANSER 1. Nasjonale faglige retningslinjer for bruk av TNF-α hemmere og andre biologiske betennelsesdempende legemidler innen revmatologi, gastroenterologi og dermatologi.. Helsedirektoratet; Revidert utgave februar 2010; Available from: 2. Preparatomtale Cosentyx. Available from: _Product_Information/human/003729/WC pdf. 3. LIS-anbud for TNF-hemmere og biologiske legemidler. 2015; Available from: 4. Griffiths CE, Strober BE, van de Kerkhof P, Ho V, Fidelus-Gort R, Yeilding N, et al. Comparison of ustekinumab and etanercept for moderate-to-severe psoriasis. New England Journal of Medicine. 2010;362(2): Langley RG, Elewski BE, Lebwohl M, Reich K, Griffiths CE, Papp K, et al. Secukinumab in plaque psoriasis--results of two phase 3 trials. The New England journal of medicine. 2014;371(4): Epub 2014/07/ Cosentyx: EPAR - Public assessment report. 2014; Available from: _Public_assessment_report/human/003729/WC pdf. 7. Blauvelt A, Prinz JC, Gottlieb AB, Kingo K, Sofen H, Ruer-Mulard M, et al. Secukinumab administration by pre-filled syringe: efficacy, safety and usability results from a randomized controlled trial in psoriasis (FEATURE). The British journal of dermatology. 2015;172(2): Epub 2014/08/ Paul C, Lacour JP, Tedremets L, Kreutzer K, Jazayeri S, Adams S, et al. Efficacy, safety and usability of secukinumab administration by autoinjector/pen in psoriasis: a randomized, controlled trial (JUNCTURE). Journal of the European Academy of Dermatology and Venereology : JEADV. 2015;29(6): Epub 2014/09/ Thaci D, Blauvelt A, Reich K, Tsai TF, Vanaclocha F, Kingo K, et al. Secukinumab is superior to ustekinumab in clearing skin of subjects with moderate to severe plaque psoriasis: CLEAR, a randomized controlled trial. Journal of the American Academy of Dermatology Epub 2015/06/ GUIDELINE ON CLINICAL INVESTIGATION OF MEDICINAL PRODUCTS INDICATED FOR THE TREATMENT OF PSORIASIS. EMA; Available from: pdf.
Kort vurdering. Vurdering av innsendt dokumentasjon Statens legemiddelverk
 Kort vurdering ID-nr 2015_019: Bruk av bevacizumab (Avastin) ved avansert livmorhalskreft og ved tilbakefall av livmorhalskreft». Vurdering av innsendt dokumentasjon 29-08-2016 Statens legemiddelverk Brev
Kort vurdering ID-nr 2015_019: Bruk av bevacizumab (Avastin) ved avansert livmorhalskreft og ved tilbakefall av livmorhalskreft». Vurdering av innsendt dokumentasjon 29-08-2016 Statens legemiddelverk Brev
Oppdatering av hurtig metodevurdering
 Oppdatering av hurtig metodevurdering Bestilling ID2017_012 Nivolumab (Opdivo) til andrelinjebehandling av avansert nyrecellekarsinom Vurdering av oppdatert dokumentasjon av overlevelsesdata og helseøkonomiske
Oppdatering av hurtig metodevurdering Bestilling ID2017_012 Nivolumab (Opdivo) til andrelinjebehandling av avansert nyrecellekarsinom Vurdering av oppdatert dokumentasjon av overlevelsesdata og helseøkonomiske
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2017_102 Tildrakizumab (Ilumetri) til behandling av moderat til alvorlig psoriasis Vurdering av innsendt dokumentasjon 28-02-2019
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2017_102 Tildrakizumab (Ilumetri) til behandling av moderat til alvorlig psoriasis Vurdering av innsendt dokumentasjon 28-02-2019
Budsjettkonsekvensanalyse
 Budsjettkonsekvensanalyse Methoxyflurane (Penthrox) ved 2.- eller 3.-linjebehandling av akutt (moderat til alvorlig) smerte Vurdering av innsendt dokumentasjon 06-06-2018 Statens legemiddelverk 17/17245
Budsjettkonsekvensanalyse Methoxyflurane (Penthrox) ved 2.- eller 3.-linjebehandling av akutt (moderat til alvorlig) smerte Vurdering av innsendt dokumentasjon 06-06-2018 Statens legemiddelverk 17/17245
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Introduksjon av nye legemidler i spesialisthelsetjenesten
 Introduksjon av nye legemidler i spesialisthelsetjenesten Gardermoen 10.mars 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Statens legemiddelverk Innhold i presentasjonen Tilgang til
Introduksjon av nye legemidler i spesialisthelsetjenesten Gardermoen 10.mars 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Statens legemiddelverk Innhold i presentasjonen Tilgang til
Nytt behandlingsalternativ til pasienter med inflammatorisk psoriasisartritt (PsA)
 Side 1 Nytt behandlingsalternativ til pasienter med inflammatorisk psoriasisartritt (PsA) Norske pasienter med den sammensatte sykdommen psoriasisartritt (PsA) har fått et nytt behandlingsalternativ. STELARA
Side 1 Nytt behandlingsalternativ til pasienter med inflammatorisk psoriasisartritt (PsA) Norske pasienter med den sammensatte sykdommen psoriasisartritt (PsA) har fått et nytt behandlingsalternativ. STELARA
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser
NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser
ID_nr: ID2017_057 «avelumab (Bavencio) til behandling av metastatisk merkelcellekarsinom.»
 NOTAT 5. juli 2018 Til: Bestillerforum RHF/Beslutningsforum ID_nr: ID2017_057 «avelumab () til behandling av metastatisk merkelcellekarsinom.» 3-siders sammendrag Metode Hurtig metodevurdering av legemiddelet
NOTAT 5. juli 2018 Til: Bestillerforum RHF/Beslutningsforum ID_nr: ID2017_057 «avelumab () til behandling av metastatisk merkelcellekarsinom.» 3-siders sammendrag Metode Hurtig metodevurdering av legemiddelet
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: / Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 21.10.2013 13/15074-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 21.10.2013 13/15074-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar Andreassen
 Alcon Nordic A/S Edvard Thomsens Vej 14 2300 København S Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar REFUSJONSVEDTAK
Alcon Nordic A/S Edvard Thomsens Vej 14 2300 København S Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar REFUSJONSVEDTAK
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Denosumab (Xgeva) til forebygging av skjelettrelaterte. voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse
 Denosumab () til forebygging av skjelettrelaterte hendelser hos voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse 01-10-2014 Statens legemiddelverk 1 Innhold
Denosumab () til forebygging av skjelettrelaterte hendelser hos voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse 01-10-2014 Statens legemiddelverk 1 Innhold
Hurtig metodevurdering
 Hurtig metodevurdering Ustekinumab (Stelara) til behandling av voksne pasienter med moderat til alvorlig Crohns sykdom (CD) Vurdering av innsendt dokumentasjon 29-11-2017 Statens legemiddelverk 17/00252
Hurtig metodevurdering Ustekinumab (Stelara) til behandling av voksne pasienter med moderat til alvorlig Crohns sykdom (CD) Vurdering av innsendt dokumentasjon 29-11-2017 Statens legemiddelverk 17/00252
Status - gjennomførte og planlagte metodevurderinger «TNF BIO» Hilde Røshol Seniorrådgiver
 Status - gjennomførte og planlagte metodevurderinger «TNF BIO» Hilde Røshol Seniorrådgiver Agenda Hurtig metodevurdering prosess og metodikk Gjennomført og planlagte metodevurderinger innenfor «TNFBIO»
Status - gjennomførte og planlagte metodevurderinger «TNF BIO» Hilde Røshol Seniorrådgiver Agenda Hurtig metodevurdering prosess og metodikk Gjennomført og planlagte metodevurderinger innenfor «TNFBIO»
TNF/BiO og dermatologiske utfordringer. Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS
 TNF/BiO og dermatologiske utfordringer Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS Viktige dermatologiske lidelser som behandles med monoklonale
TNF/BiO og dermatologiske utfordringer Øystein Sandanger, MD, PhD Seksjon for hudsykdommer, OUS Institutt for indremedisinsk forskning, OUS Viktige dermatologiske lidelser som behandles med monoklonale
NASJONALE FAGLIGE RETNINGSLINJER FOR BRUK AV BIOLOGISKE MEDIKAMENTER VED BEHANDLING AV ATOPISK EKSEM
 20. FEBRUAR 2019 NASJONALE FAGLIGE RETNINGSLINJER FOR BRUK AV BIOLOGISKE MEDIKAMENTER VED BEHANDLING AV ATOPISK EKSEM FORSLAG PETTER GJERSVIK DNLF 1. Bakgrunn Styret i Norsk forening for dermatologi og
20. FEBRUAR 2019 NASJONALE FAGLIGE RETNINGSLINJER FOR BRUK AV BIOLOGISKE MEDIKAMENTER VED BEHANDLING AV ATOPISK EKSEM FORSLAG PETTER GJERSVIK DNLF 1. Bakgrunn Styret i Norsk forening for dermatologi og
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3 511.1 Seksjon for legemiddelrefusjon/ Enrique Ji~ez
 Statens legemiddelverk Norwegian Medicines Agency Novartis Norge AS Postboks 237 Økern 0510 OSLO Norge DAGSPOST Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3
Statens legemiddelverk Norwegian Medicines Agency Novartis Norge AS Postboks 237 Økern 0510 OSLO Norge DAGSPOST Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3
Hurtig metodevurdering
 Hurtig metodevurdering Sekukinumab (Cosentyx) til behandling av ankyloserende spondylitt Vurdering av innsendt dokumentasjon 27-05-2016 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst
Hurtig metodevurdering Sekukinumab (Cosentyx) til behandling av ankyloserende spondylitt Vurdering av innsendt dokumentasjon 27-05-2016 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst
OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED IKKE-SMÅCELLET LUNGEKREFT AV TYPEN PLATEEPITELKARSINOM SOM IKKE UTTRYKKER PD-L1
 Helsedirektoratet Postboks 7000 St. Olavsplass 0130 OSLO Sekretariatet for nye metoder Deres ref.: Dato: Vår ref.: Saksbehandler: 23.11.2017 17/15899-1 BSt CH OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED
Helsedirektoratet Postboks 7000 St. Olavsplass 0130 OSLO Sekretariatet for nye metoder Deres ref.: Dato: Vår ref.: Saksbehandler: 23.11.2017 17/15899-1 BSt CH OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED
Medikamentell Behandling
 www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
Refusjonsrapport. Vurdering av søknad om forhåndsgodkjent refusjon 2. 11-11-2013 Statens legemiddelverk
 Refusjonsrapport aflibercept (Eylea) til behandling av aldersrelatert våt makula-degenerasjon (våt AMD). Vurdering av søknad om forhåndsgodkjent refusjon 2 11-11-2013 Statens legemiddelverk Brev stiles
Refusjonsrapport aflibercept (Eylea) til behandling av aldersrelatert våt makula-degenerasjon (våt AMD). Vurdering av søknad om forhåndsgodkjent refusjon 2 11-11-2013 Statens legemiddelverk Brev stiles
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten Guselkumab (Tremfya) til behandling av moderat til alvorlig psoriasis Vurdering av innsendt dokumentasjon 19-04-2018 Statens
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten Guselkumab (Tremfya) til behandling av moderat til alvorlig psoriasis Vurdering av innsendt dokumentasjon 19-04-2018 Statens
Hurtig metodevurdering
 Hurtig metodevurdering Brodalumab (Kyntheum) til behandling av moderat til alvorlig plakkpsoriasis Vurdering av innsendt dokumentasjon 25-10-2017 Statens legemiddelverk 17/07348 LØ/LR/BSt 25-10-2017 side
Hurtig metodevurdering Brodalumab (Kyntheum) til behandling av moderat til alvorlig plakkpsoriasis Vurdering av innsendt dokumentasjon 25-10-2017 Statens legemiddelverk 17/07348 LØ/LR/BSt 25-10-2017 side
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina Kvalheim
 NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina REFUSJONSVEDTAK Vi viser til Deres søknad
NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina REFUSJONSVEDTAK Vi viser til Deres søknad
Kurs i legemiddeløkonomi 20. mai 2015
 Kurs i legemiddeløkonomi 20. mai 2015 Erik Sagdahl erik.sagdahl@legemiddelverket.no Morten Aaserud morten.aaserud@legemiddelverket.no Legemidler. Finansiering/betaling Blåresept Sykehus Forhåndsgodkjent
Kurs i legemiddeløkonomi 20. mai 2015 Erik Sagdahl erik.sagdahl@legemiddelverket.no Morten Aaserud morten.aaserud@legemiddelverket.no Legemidler. Finansiering/betaling Blåresept Sykehus Forhåndsgodkjent
Viktig informasjon for pasienter
 Ditt navn: Din adresse: Ditt telefonnummer: Din leges navn: _ Din leges adresse: _ Behandling av psoriasis med Stelara Viktig informasjon for pasienter Din leges telefonnummer: _ Her kan du notere legens
Ditt navn: Din adresse: Ditt telefonnummer: Din leges navn: _ Din leges adresse: _ Behandling av psoriasis med Stelara Viktig informasjon for pasienter Din leges telefonnummer: _ Her kan du notere legens
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten Iksekizumab (Taltz) til behandling av plakkpsoriasis Vurdering av innsendt dokumentasjon 08-06-2018 Statens legemiddelverk 2018-03675
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten Iksekizumab (Taltz) til behandling av plakkpsoriasis Vurdering av innsendt dokumentasjon 08-06-2018 Statens legemiddelverk 2018-03675
Viktig informasjon for pasienter
 Ferdigfylte Stelara -sprøyter! Behandling av psoriasis med Stelara Viktig informasjon for pasienter 2 Dette heftet inneholder viktig informasjon om Stelara (ustekinumab) som du har fått foreskrevet til
Ferdigfylte Stelara -sprøyter! Behandling av psoriasis med Stelara Viktig informasjon for pasienter 2 Dette heftet inneholder viktig informasjon om Stelara (ustekinumab) som du har fått foreskrevet til
Metodevurdering for lungekreft og PD1-hemmere. Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi
 Metodevurdering for lungekreft og PD1-hemmere Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi Hva er hurtig metodevurderinger? Dette er en systematisk måte å
Metodevurdering for lungekreft og PD1-hemmere Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi Hva er hurtig metodevurderinger? Dette er en systematisk måte å
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert / Seksjon for legemiddelrefusjon/ Helle Endresen
 Chiesi pharma AB Box 63 S-182 11 Danderyd Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert 16.10.2014 14/10880-5 Seksjon for legemiddelrefusjon/ Helle Endresen REFUSJONSVEDTAK Vi viser til
Chiesi pharma AB Box 63 S-182 11 Danderyd Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert 16.10.2014 14/10880-5 Seksjon for legemiddelrefusjon/ Helle Endresen REFUSJONSVEDTAK Vi viser til
Generelt om plassering av finansieringsansvaret for legemidler
 v4-29.07.2015 Returadresse: Helsedirektoratet, Pb. 7000 St. Olavs plass, 0130 Oslo, Norway HDIR Innland 17960510 Adresseinformasjon fylles inn ved ekspedering. Se mottakerliste nedenfor. Adresseinformasjon
v4-29.07.2015 Returadresse: Helsedirektoratet, Pb. 7000 St. Olavs plass, 0130 Oslo, Norway HDIR Innland 17960510 Adresseinformasjon fylles inn ved ekspedering. Se mottakerliste nedenfor. Adresseinformasjon
DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER
 DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER Beslutninger og erfaringer fra revmatologisk seksjon Drammen Sykehus VVHF Åse S. Lexberg, avdelings overlege, revmatologisk seksjon,
DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER Beslutninger og erfaringer fra revmatologisk seksjon Drammen Sykehus VVHF Åse S. Lexberg, avdelings overlege, revmatologisk seksjon,
Hurtig metodevurdering
 ) Hurtig metodevurdering Dimetylfumarat (Skilarence) til behandling av moderat til alvorlig plakkpsoriasis Vurdering av innsendt dokumentasjon 08-01-2018 Statens legemiddelverk 17/07252 LØ/LR/ 08-01-2018
) Hurtig metodevurdering Dimetylfumarat (Skilarence) til behandling av moderat til alvorlig plakkpsoriasis Vurdering av innsendt dokumentasjon 08-01-2018 Statens legemiddelverk 17/07252 LØ/LR/ 08-01-2018
LIS-avtaler i perioden og anbefalinger for valg av biologiske legemidler innenfor revmatologiske-, mage-tarm- og hudsykdommer.
 Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Oktober 2012 LIS-TNF/BIO AVTALER 2012 revidert Endringen skyldes ny indikasjon for Humira (adalimumab): Behandling av voksne med alvorlig
Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Oktober 2012 LIS-TNF/BIO AVTALER 2012 revidert Endringen skyldes ny indikasjon for Humira (adalimumab): Behandling av voksne med alvorlig
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Behandlingsmålet er å senke øyetrykket tilstrekkelig til å unngå synsfeltskader eller progresjon av slike skader.
 Refusjonsrapport Azarga til behandling av glaukom 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for Azarga (brinzolamid og timolol) etter forskrift av 28. juni 2007 nr. 814 om stønad til dekning
Refusjonsrapport Azarga til behandling av glaukom 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for Azarga (brinzolamid og timolol) etter forskrift av 28. juni 2007 nr. 814 om stønad til dekning
RMP versjon 11.2 Sept 2017 NO
 Veiledning for helsepersonell om ILARIS (canakinumab) for behandling av pasienter med: Periodiske febersyndromer: CAPS, TRAPS, HIDS/MKD, FMF Still s sykdom (inkludert AOSD og sjia) eller arthritis urica
Veiledning for helsepersonell om ILARIS (canakinumab) for behandling av pasienter med: Periodiske febersyndromer: CAPS, TRAPS, HIDS/MKD, FMF Still s sykdom (inkludert AOSD og sjia) eller arthritis urica
LIS-avtaler i perioden 1.2.2014-28.2.2015 og anbefalinger for valg av biologiske legemidler innenfor revmatologiske-, mage-tarm- og hudsykdommer.
 Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF 27. januar 2014 LIS-TNF/BIO AVTALER 2014 LIS-avtaler i perioden 1.2.2014-28.2.2015 og anbefalinger for valg av biologiske legemidler
Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF 27. januar 2014 LIS-TNF/BIO AVTALER 2014 LIS-avtaler i perioden 1.2.2014-28.2.2015 og anbefalinger for valg av biologiske legemidler
LIS-TNF/BIO AVTALER 2011, revidert april 2011
 Vedlegg C til oppdatert versjon av informasjonspakke om biologiske legemidler og MS-legemidler (utgave nummer 2) Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF April 2011 LIS-TNF/BIO
Vedlegg C til oppdatert versjon av informasjonspakke om biologiske legemidler og MS-legemidler (utgave nummer 2) Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF April 2011 LIS-TNF/BIO
Forskrivningsstøtte og muligheter for kontroll av legemidler i spesialisthelsetjenesten
 Forskrivningsstøtte og muligheter for kontroll av legemidler i spesialisthelsetjenesten Legemiddelkomiteseminar 1.juni 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Innføring av nye
Forskrivningsstøtte og muligheter for kontroll av legemidler i spesialisthelsetjenesten Legemiddelkomiteseminar 1.juni 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Innføring av nye
Bruk av. En veiledning for helsepersonell
 Bruk av En veiledning for helsepersonell Når Kineret blir forskrevet for cryopyrinassosierte periodiske syndromer (CAPS), vennligst kommuniser informasjonen som er fremlagt i dette heftet til pasienten/omsorgspersonen
Bruk av En veiledning for helsepersonell Når Kineret blir forskrevet for cryopyrinassosierte periodiske syndromer (CAPS), vennligst kommuniser informasjonen som er fremlagt i dette heftet til pasienten/omsorgspersonen
Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging?
 Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging? Notat fra en tverretatlig arbeidsgruppe 1 31.01.2019 1 Bestående
Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging? Notat fra en tverretatlig arbeidsgruppe 1 31.01.2019 1 Bestående
Hurtig metodevurdering
 Hurtig metodevurdering Sekukinumab (Cosentyx) til behandling av psoriasisartritt Vurdering av innsendt dokumentasjon 22-08-2016 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst
Hurtig metodevurdering Sekukinumab (Cosentyx) til behandling av psoriasisartritt Vurdering av innsendt dokumentasjon 22-08-2016 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Hurtig metodevurdering
 Hurtig metodevurdering Vedolizumab (Entyvio) til 2. og 3. linjebehandling av moderat til alvorlig Crohns sykdom Vurdering av innsendt dokumentasjon 09-10-2015 Statens legemiddelverk Brev stiles til Statens
Hurtig metodevurdering Vedolizumab (Entyvio) til 2. og 3. linjebehandling av moderat til alvorlig Crohns sykdom Vurdering av innsendt dokumentasjon 09-10-2015 Statens legemiddelverk Brev stiles til Statens
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
ORENCIA (abatacept) ved behandling av revmatoid artritt (RA)
 ORENCIA (abatacept) ved behandling av revmatoid artritt (RA) Hva er ORENCIA (abatacept)? ORENCIA er det første biologiske legemiddelet som blir tilgjengelig både som intravenøs infusjon og selvinjiserende,
ORENCIA (abatacept) ved behandling av revmatoid artritt (RA) Hva er ORENCIA (abatacept)? ORENCIA er det første biologiske legemiddelet som blir tilgjengelig både som intravenøs infusjon og selvinjiserende,
Hurtig metodevurdering
 Hurtig metodevurdering Vedolizumab (Entyvio) til 2. og 3. linjebehandling av moderat til alvorlig aktiv ulcerøs kolitt Vurdering av innsendt dokumentasjon 09-10-2015 Statens legemiddelverk Brev stiles
Hurtig metodevurdering Vedolizumab (Entyvio) til 2. og 3. linjebehandling av moderat til alvorlig aktiv ulcerøs kolitt Vurdering av innsendt dokumentasjon 09-10-2015 Statens legemiddelverk Brev stiles
Biologiske legemidler - Hvem har kontroll på kostnadene? Tore K. Kvien Dept of Rheumatology Diakonhjemmet Hospital Oslo, Norway
 Biologiske legemidler - Hvem har kontroll på kostnadene? Tore K. Kvien Dept of Rheumatology Diakonhjemmet Hospital Oslo, Norway Aktuelle biologiske legemidler innen revma, gastro og hud 2010 Forhold som
Biologiske legemidler - Hvem har kontroll på kostnadene? Tore K. Kvien Dept of Rheumatology Diakonhjemmet Hospital Oslo, Norway Aktuelle biologiske legemidler innen revma, gastro og hud 2010 Forhold som
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
Høringsbrev - Forslag om å overføre finansieringsansvaret for Benepali (etanercept) til de regionale helseforetakene
 v4-29.07.2015 HELSE MIDT-NORGE RHF Postboks 464 7501 STJØRDAL Deres ref.: Vår ref.: 16/4835-1 Saksbehandler: Dato: 09.02.2016 Høringsbrev - Forslag om å overføre finansieringsansvaret for Benepali (etanercept)
v4-29.07.2015 HELSE MIDT-NORGE RHF Postboks 464 7501 STJØRDAL Deres ref.: Vår ref.: 16/4835-1 Saksbehandler: Dato: 09.02.2016 Høringsbrev - Forslag om å overføre finansieringsansvaret for Benepali (etanercept)
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH
 Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere darifenacin (Emselex) for pliktmessig refusjon
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere darifenacin (Emselex) for pliktmessig refusjon
Til deg som har fått Stelara
 Ditt navn: Din adresse: Til deg som har fått Stelara Pasientinformasjon om psoriasis og behandling med Stelara Ditt telefonnummer: Legens navn: Legens adresse: Legens telefonnummer: Noter kontaktopplysningene
Ditt navn: Din adresse: Til deg som har fått Stelara Pasientinformasjon om psoriasis og behandling med Stelara Ditt telefonnummer: Legens navn: Legens adresse: Legens telefonnummer: Noter kontaktopplysningene
RAPPORT FRA UANMELDT TILSYN DER JARDIANCE VAR TEMA. Hovedformålet med tilsyn er at vi ønsker å bidra til å sikre:
 BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 05.11.2015 15/13231-11 Legemiddelinformasjon Stab/ Christel Nyhus Bø RAPPORT FRA UANMELDT TILSYN
BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 05.11.2015 15/13231-11 Legemiddelinformasjon Stab/ Christel Nyhus Bø RAPPORT FRA UANMELDT TILSYN
KINERET - VIKTIG SIKKERHETSINFORMASJON
 KINERET - VIKTIG SIKKERHETSINFORMSJON VEILENING FOR HELSEPERSONELL Vennligst kommuniser informasjonen som er fremlagt i dette heftet til pasienten/ omsorgspersonen for å sikre riktig dosering og bruk av
KINERET - VIKTIG SIKKERHETSINFORMSJON VEILENING FOR HELSEPERSONELL Vennligst kommuniser informasjonen som er fremlagt i dette heftet til pasienten/ omsorgspersonen for å sikre riktig dosering og bruk av
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
side 4/47 3-SIDERS SAMMENDRAG
 side 2/47 FORORD Implementering av Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten skal bidra til at nye metoder som er aktuelle å innføre i spesialisthelsetjenesten blir vurdert
side 2/47 FORORD Implementering av Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten skal bidra til at nye metoder som er aktuelle å innføre i spesialisthelsetjenesten blir vurdert
LIS-TNF/BIO AVTALER 2013
 Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Januar 2013 LIS-TNF/BIO AVTALER 2013 LIS-avtaler i perioden 1.2.2013-31.1.2014 og anbefalinger for valg av biologiske legemidler innenfor
Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Januar 2013 LIS-TNF/BIO AVTALER 2013 LIS-avtaler i perioden 1.2.2013-31.1.2014 og anbefalinger for valg av biologiske legemidler innenfor
Deres ref.: Dato: Vår ref.: Saksbehandler: / Reidun Os Husteli
 GLAXOSMITHKLINE AS Postboks 180 Vinderen 0319 OSLO Deres ref.: Dato: Vår ref.: Saksbehandler: 29.05.2018 18/00473-7 Reidun Os Husteli REFUSJONSVEDTAK Statens legemiddelverk viser til deres dokumentasjon
GLAXOSMITHKLINE AS Postboks 180 Vinderen 0319 OSLO Deres ref.: Dato: Vår ref.: Saksbehandler: 29.05.2018 18/00473-7 Reidun Os Husteli REFUSJONSVEDTAK Statens legemiddelverk viser til deres dokumentasjon
NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml
 NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml NeuroBloc-veiledning for leger, utgave 1, august 2014 1 Viktig sikkerhetsinformasjon for leger Hensikten med denne håndboken er å
NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml NeuroBloc-veiledning for leger, utgave 1, august 2014 1 Viktig sikkerhetsinformasjon for leger Hensikten med denne håndboken er å
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Tore Solbu 18.02.2015 14/10428-6 Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 TEVA Norway AS P.O.Box 15 1371 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Tore Solbu 18.02.2015 14/10428-6 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
TEVA Norway AS P.O.Box 15 1371 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Tore Solbu 18.02.2015 14/10428-6 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
1 NYE METODER OG PROSESS FOR INNFØRING AV LEGEMIDLER I SPESIALISTHELSETJENESTEN OG UNNTAKSBESTEMMELSER
 1 NYE METODER OG PROSESS FOR INNFØRING AV LEGEMIDLER I SPESIALISTHELSETJENESTEN OG UNNTAKSBESTEMMELSER I Meld. St. 16 (2010-2011) Nasjonal helse- og omsorgsplan 2011-2015, Meld. St.10 (2012-2013) God kvalitet
1 NYE METODER OG PROSESS FOR INNFØRING AV LEGEMIDLER I SPESIALISTHELSETJENESTEN OG UNNTAKSBESTEMMELSER I Meld. St. 16 (2010-2011) Nasjonal helse- og omsorgsplan 2011-2015, Meld. St.10 (2012-2013) God kvalitet
Oppfølging av prioriteringsmeldingen
 Helse- og omsorgsdepartementet Oppfølging av prioriteringsmeldingen Seminar Sykehusinnkjøp, Stavanger 29. august 2017 Avdelingsdirektør Are Forbord, Agenda Prioriteringsmeldingen hva var egentlig poenget?
Helse- og omsorgsdepartementet Oppfølging av prioriteringsmeldingen Seminar Sykehusinnkjøp, Stavanger 29. august 2017 Avdelingsdirektør Are Forbord, Agenda Prioriteringsmeldingen hva var egentlig poenget?
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Psoriasis er en hudsykdom karakterisert ved røde områder i huden dekket av sølvhvite skjell.
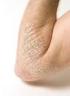 Psoriasis Psoriasis er en hudsykdom karakterisert ved røde områder i huden dekket av sølvhvite skjell. De vanligste lokalisasjoner er: - hodebunn - albuer - knær - nedre del av ryggen Psoriasis kan også
Psoriasis Psoriasis er en hudsykdom karakterisert ved røde områder i huden dekket av sølvhvite skjell. De vanligste lokalisasjoner er: - hodebunn - albuer - knær - nedre del av ryggen Psoriasis kan også
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2017_063 Anakinra (Kineret) til behandling av aktiv Stills sykdom, inkludert systemisk juvenil idiopatisk artritt og Stills
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2017_063 Anakinra (Kineret) til behandling av aktiv Stills sykdom, inkludert systemisk juvenil idiopatisk artritt og Stills
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
HUMIRA (adalimumab) Pasienten i fokus
 HUMIRA (adalimumab) Pasienten i fokus Pediatrisk Crohns Sykdom & Neglepsoriasis Tobias Heatta-Speicher, PhD Medical Affairs Manager LIS anbudsseminar 26. januar 2016 1 HUMIRA (adalimumab) rekombinant fullhumant
HUMIRA (adalimumab) Pasienten i fokus Pediatrisk Crohns Sykdom & Neglepsoriasis Tobias Heatta-Speicher, PhD Medical Affairs Manager LIS anbudsseminar 26. januar 2016 1 HUMIRA (adalimumab) rekombinant fullhumant
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
LIS-TNF/BIO AVTALER 2012 revidert april 2012
 Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF April 2012 LIS-TNF/BIO AVTALER 2012 revidert april 2012 LIS-avtaler i perioden 1.2.2012-31.1.2013 og anbefalinger for valg av biologiske
Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF April 2012 LIS-TNF/BIO AVTALER 2012 revidert april 2012 LIS-avtaler i perioden 1.2.2012-31.1.2013 og anbefalinger for valg av biologiske
Legemiddelverkets erfaringer med nasjonale hurtig metodevurderinger. Kristin Svanqvist Statens legemiddelverk 4.mai 2015
 Legemiddelverkets erfaringer med nasjonale hurtig metodevurderinger Kristin Svanqvist Statens legemiddelverk 4.mai 2015 Markedsadgang versus offentlig finansiering Markedsføringstillatelsen = Markedsadgang/godkjenning
Legemiddelverkets erfaringer med nasjonale hurtig metodevurderinger Kristin Svanqvist Statens legemiddelverk 4.mai 2015 Markedsadgang versus offentlig finansiering Markedsføringstillatelsen = Markedsadgang/godkjenning
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Beslutningsforum for nye metoder
 Beslutningsforum for nye metoder Dato: 16. november 2015 Kl.: 14.00-15.30 Sted: Hotel Park Inn by Radisson Oslo Airport, Gardermoen Møtedato: 16. november 2015 Arkivnr.: Saksbeh/tlf: Sted/dato: 2014/182-118/012
Beslutningsforum for nye metoder Dato: 16. november 2015 Kl.: 14.00-15.30 Sted: Hotel Park Inn by Radisson Oslo Airport, Gardermoen Møtedato: 16. november 2015 Arkivnr.: Saksbeh/tlf: Sted/dato: 2014/182-118/012
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag til nasjonal metodevurdering (15.9.2015)
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering (15.9.2015) Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering (15.9.2015) Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det
Nasjonal metodevurdering i spesialisthelsetjenetsen. Geir Tollåli Fagdirektør Helse Nord RHF
 Nasjonal metodevurdering i spesialisthelsetjenetsen Geir Tollåli Fagdirektør Helse Nord RHF Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten Etablere metodevurdering som praksis
Nasjonal metodevurdering i spesialisthelsetjenetsen Geir Tollåli Fagdirektør Helse Nord RHF Nasjonalt system for innføring av nye metoder i spesialisthelsetjenesten Etablere metodevurdering som praksis
Ashkan Kourdalipour, Jørgensen Kristian Samdal
 Zambon Zambon S.p.A., Italia Repr. Nigaard Pharma Storg. 8 B Postboks 373 2001 Lillestrøm Deres referanse Vår dato Vår referanse Seksjon/saksutredere LØ/LR/ Christina Kuljis/ Eivind 09/06/2016 15/16242
Zambon Zambon S.p.A., Italia Repr. Nigaard Pharma Storg. 8 B Postboks 373 2001 Lillestrøm Deres referanse Vår dato Vår referanse Seksjon/saksutredere LØ/LR/ Christina Kuljis/ Eivind 09/06/2016 15/16242
181: Behandling skal kun startes av spesialist i indremedisin, barnesykdommer eller ved sykehusavdeling med tilsvarende spesialitet
 Novo Nordisk Scandinavia AS Baker Østbys vei 5Postboks 24 1309 RUD Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 29.01.2016 15/16181-3 Seksjon for legemiddelrefusjon/ Pilar martin Vivaldi/ Anne
Novo Nordisk Scandinavia AS Baker Østbys vei 5Postboks 24 1309 RUD Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 29.01.2016 15/16181-3 Seksjon for legemiddelrefusjon/ Pilar martin Vivaldi/ Anne
Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler
 Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi Eventuelle interessekonflikter Ansatt ved Statens
Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi Eventuelle interessekonflikter Ansatt ved Statens
Forslag til nasjonal metodevurdering (15.09.2015)
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering (15.09.2015) Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering (15.09.2015) Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener
Hepatitt C - Metodevurderinger av nye legemidler. Kristin Svanqvist Enhetsleder Metodevurderinger
 Hepatitt C - Metodevurderinger av nye legemidler Kristin Svanqvist Enhetsleder Metodevurderinger Bakgrunn 2014 nye legemidler til behandling av hepatitt C kommer på det norske markedet Pris per pakning
Hepatitt C - Metodevurderinger av nye legemidler Kristin Svanqvist Enhetsleder Metodevurderinger Bakgrunn 2014 nye legemidler til behandling av hepatitt C kommer på det norske markedet Pris per pakning
Refusjonsrapport. Vurdering av søknad om forhåndsgodkjent refusjon 2. 02-06-2014 Statens legemiddelverk
 Refusjonsrapport Alitretinoin (Toctino) til behandling av alvorlig kronisk håndeksem. Vurdering av søknad om forhåndsgodkjent refusjon 2 02-06-2014 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Refusjonsrapport Alitretinoin (Toctino) til behandling av alvorlig kronisk håndeksem. Vurdering av søknad om forhåndsgodkjent refusjon 2 02-06-2014 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Onkologisk Forum, Espen Movik, forsker
 Onkologisk Forum, 19.11.09 Metylnaltrekson Kunnskapsesenterets ved obstipasjon hos palliative nye PPT-mal pasienter Espen Movik, forsker Om rapporten Kunnskapssenterets rapport publisert i oktober 09.
Onkologisk Forum, 19.11.09 Metylnaltrekson Kunnskapsesenterets ved obstipasjon hos palliative nye PPT-mal pasienter Espen Movik, forsker Om rapporten Kunnskapssenterets rapport publisert i oktober 09.
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjeneste
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjeneste ID2018_086 Trientin tetrahydroklorid (Cuprior) til behandling av Wilsons sykdom Vurdering av innsendt dokumentasjon 21-05-2019
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjeneste ID2018_086 Trientin tetrahydroklorid (Cuprior) til behandling av Wilsons sykdom Vurdering av innsendt dokumentasjon 21-05-2019
Hva vet man om riktig bruk når et nytt legemiddel godkjennes?
 Hva vet man om riktig bruk når et nytt legemiddel godkjennes? Eva Skovlund Statens Legemiddelverk Farmasøytisk institutt, UiO Farmasidagene 2010 MASSE! Men ofte mindre enn vi skulle ønske Til grunn for
Hva vet man om riktig bruk når et nytt legemiddel godkjennes? Eva Skovlund Statens Legemiddelverk Farmasøytisk institutt, UiO Farmasidagene 2010 MASSE! Men ofte mindre enn vi skulle ønske Til grunn for
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: / Seksjon for legemiddelomsetning/ Leung Ming Yu
 Wickstrøm & Langkilde ApS Hjulmagervej 4A DK-7100 Velje Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.01.2016 15/14643-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser til
Wickstrøm & Langkilde ApS Hjulmagervej 4A DK-7100 Velje Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.01.2016 15/14643-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser til
Veiledning til forskriver
 Viktig sikkerhetsinformasjon MAVENCLAD 10 mg tabletter kladribin Veiledning til forskriver Melding av bivirkninger Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til sitt regionale legemiddelinformasjonssenter
Viktig sikkerhetsinformasjon MAVENCLAD 10 mg tabletter kladribin Veiledning til forskriver Melding av bivirkninger Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til sitt regionale legemiddelinformasjonssenter
Legemiddelverket foreslår at følgende legemidler tas opp på byttelisten:
 Se mottakerliste Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 28.05.2014 12/00145-32 Seksjon for legemiddelrefusjon/ Anne Marthe HØRING OM OPPTAK PÅ BYTTELISTEN Legemiddelverket foreslår at følgende
Se mottakerliste Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 28.05.2014 12/00145-32 Seksjon for legemiddelrefusjon/ Anne Marthe HØRING OM OPPTAK PÅ BYTTELISTEN Legemiddelverket foreslår at følgende
Prioriteringsveileder - Hud- og veneriske sykdommer
 Prioriteringsveileder - Hud- og veneriske sykdommer Publisert Feb 27, 2015, oppdatert Apr 12, 2015 Fagspesifikk innledning - dermatologi Fagspesifikk innledning - dermatologi Innledning Dermatologifaget
Prioriteringsveileder - Hud- og veneriske sykdommer Publisert Feb 27, 2015, oppdatert Apr 12, 2015 Fagspesifikk innledning - dermatologi Fagspesifikk innledning - dermatologi Innledning Dermatologifaget
LIS ANBEFALINGER FOR RITUKSIMAB
 LIS ANBEFALINGER FOR RITUKSIMAB 01.02.2019-31.01.2020 LIS ANBEFALINGER FOR RITUKSIMAB Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Vår ref 2018/858 Vår dato 07.01.2019 Avtaleperiode
LIS ANBEFALINGER FOR RITUKSIMAB 01.02.2019-31.01.2020 LIS ANBEFALINGER FOR RITUKSIMAB Helse Sør-Øst RHF Helse Vest RHF Helse Midt-Norge RHF Helse Nord RHF Vår ref 2018/858 Vår dato 07.01.2019 Avtaleperiode
