Vedlegg III. Endringer i relevante deler av produktinformasjonen
|
|
|
- Henriette Ingvaldsen
- 6 år siden
- Visninger:
Transkript
1 Vedlegg III Endringer i relevante deler av produktinformasjonen Merk: Disse endringene i relevante deler av produktinformasjonen er utfallet av voldgiftsprosedyren. Etter kommisjonsvedtaket skal medlemslandets kompetente myndigheter sammen med referanselandet fortløpende oppdatere produktinformasjonen etter behov i henhold til prosedyrene i avsnitt III i kapittel 4 i direktiv 2001/83/EF. 30
2 Endringer i relevante deler av produktinformasjonen Den eksisterende produktinformasjonen skal rettes (innsetting, erstatning eller sletting av tekst ved behov) for å gjenspeile den avtalte formuleringen under. Intravenøs gadotersyre, gadobutrol, gadoteridol uforsterket MR-avbildning. Den laveste dosen som gir tilstrekkelig forsterkning for diagnostiske formål, skal brukes. Dosen skal beregnes basert på pasientens kroppsvekt og skal ikke overskride den anbefalte dosen per kg kroppsvekt som er angitt under dette punktet. Intraartikulær gadotersyre uforsterket MR-avbildning. Den laveste dosen som gir tilstrekkelig forsterkning for diagnostiske formål, skal brukes. Intraartikulær gadopentetsyre uforsterket MR-avbildning, og når et annet godkjent preparat ikke kan brukes. Den laveste dosen som gir tilstrekkelig forsterkning for diagnostiske formål, skal brukes. 31
3 Pkt. 4.4 Advarsler og forsiktighetsregler Etter intravenøs administrering kan <virkestoff (INN)> bli holdt tilbake i hjernen og i annet vev i kroppen (skjelett, lever, nyrer, hud) og kan forårsake doseavhengige økninger i T1-vektet signalintensitet i hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Kliniske konsekvenser er ikke kjent. Tilbakeholdelse av gadolinium i hjernen er ikke sett ved intraartikulær administrering. Mulige diagnostiseringsfordeler ved bruk av <virkestoff (INN)> hos pasienter som vil ha behov for gjentatte skanninger, skal vurderes opp mot potensialet for avleiring av gadolinium i hjernen og annet vev. Pkt. 5.2 Farmakokinetiske egenskaper <Virkestoff (INN)> er en lineær GdCA. Studier har vist at gadolinium holdes tilbake i kroppen etter eksponering for GdCAer gitt intravenøst ved betydelig høyere doser enn intraartikulære preparater. Dette omfatter tilbakeholdelse i hjernen og i annet vev og organer. Med lineære GdCAer kan dette forårsake doseavhengige økninger i T1-vektet signalintensitet i hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Signalintensiteten øker og ikke-kliniske data viser at gadolinium frigjøres fra lineære GdCAer. Pakningsvedlegg Avsnitt 2: Hva du må vite før du bruker <produktnavn> o Opphopning i kroppen <Produktnavn> virker fordi det inneholder et metall som heter gadolinium. Studier har vist at små mengder gadolinium kan bli igjen i kroppen, også i hjernen. Dette er ikke sett for de små mengdene som er gitt ved injeksjoner i leddet. Intravenøs gadoksetsyre <Produktnavn> er indisert for påvisning av fokale leverlesjoner og gir informasjon om lesjonstypen ved T1-vektet MR-avbildning. uforsterket MR-avbildning, og når forsinket faseavbildning er nødvendig. Dette legemidlet er kun for diagnostisk bruk ved intravenøs administrering. Den laveste dosen som gir tilstrekkelig forsterkning for diagnostiske formål, skal brukes. Dosen skal beregnes basert på pasientens kroppsvekt og skal ikke overskride den anbefalte dosen per kg kroppsvekt som er angitt under dette punktet. Pkt. 4.4 Advarsler og forsiktighetsregler Etter administrering kan <virkestoff (INN)> bli holdt tilbake i hjernen og i annet vev i kroppen (skjelett, lever, nyrer, hud) og kan forårsake doseavhengige økninger i T1-vektet signalintensitet i 32
4 hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Kliniske konsekvenser er ikke kjent. Mulige diagnostiseringsfordeler ved bruk av <virkestoff (INN)> hos pasienter som vil ha behov for gjentatte skanninger, skal vurderes opp mot potensialet for avleiring av gadolinium i hjernen og annet vev. Pkt. 5.2 Farmakokinetiske egenskaper <Virkestoff (INN)> er en lineær GdCA. Studier har vist at gadolinium holdes tilbake i kroppen etter eksponering for GdCAer. Dette omfatter tilbakeholdelse i hjernen og i annet vev og organer. Med lineære GdCAer kan dette forårsake doseavhengige økninger i T1-vektet signalintensitet i hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Signalintensiteten øker og ikke-kliniske data viser at gadolinium frigjøres fra lineære GdCAer. Pakningsvedlegg Avsnitt 2: Hva du må vite før du bruker <produktnavn> o Opphopning i kroppen <Produktnavn> virker fordi det inneholder et metall som heter gadolinium. Studier har vist at små mengder gadolinium kan bli igjen i kroppen, også i hjernen. Det er ikke sett noen bivirkninger på grunn av gadolinium som har blitt igjen i hjernen. Intravenøs gadobensyre (begrensning av indikasjon alle referanser til andre indikasjoner skal fjernes i hele produktinformasjonen) Dette legemidlet er kun til diagnostiske formål. <Produktnavn> er et paramagnetisk kontrastmiddel for bruk i diagnostisk MR-avbildning indisert for: av leveren hos voksne og barn (over 2 år) MR av hjerne og ryggrad hos voksne og barn over 2 år, der det gir bedre påvisning av lesjoner og gir diagnostisk informasjon utover den som fås ved MR-undersøkelse uten kontrastforsterkning (se pkt. 5.1). MR av hele kroppen hos voksne og barn (over 2 år) inkludert hode og nakkeregion, thorax (inkludert hjertet og bryst hos kvinner) abdomen (pankreas og lever) abdomen (mage-tarmkanal), retroperitonealomådet (nyre, binyrer), bekken (prostata, urinblære og uterus) og muskelskjelettsystemet, der det letter identifiseringen av unormale strukturer eller lesjoner og bidrar til differensiering mellom friskt og patologisk vev (se pkt. 4.2 og 5.1). Magnetisk resonansangiografi (MRA) for vurdering av stenoser, okklusjoner og kollateraler hos voksne og barn (over 2 år). Spesifikke undersøkelser av hjertet inkludert måling av myokardperfusjon under farmakologisk stress og diagnostikk av viabilitet ( forsinket opptak ). uforsterket MR-avbildning og når forsinket faseavbildning er nødvendig. 33
5 Målorgan Hjerne og ryggrad Lever, nyrer, urinveier, binyrer Magnetisk resonansangiografi Hode og nakkeregionen, thorax (inkludert hjertet og bryst hos kvinner) abdomen (mage-tarmkanal inkludert pankreas), bekken (prostata, urinblære og uterus) og muskel-skjelettsystem Hjerte-MR Måling av hjertemasse eller myokardviabilitet Måling av myokardperfusjon Anbefalt dose 0,1 mmol/kg kroppsvekt (0,2 ml/kg av 0,5 M løsningen) 0,05 mmol/kg kroppsvekt (0,1 ml/kg av 0,5 M løsningen) 0,1 mmol/kg kroppsvekt (0,2 ml/kg av 0,5 M løsningen) 0,1 mmol/kg kroppsvekt (0,2 ml/kg av 0,5 M løsningen) 0,1 mmol/kg kroppsvekt, administrert som en enkel bolusdose på 0,2 ml/kg av 0,5 M løsningen. To separate injeksjoner på 0,05 mmol/kg kroppsvekt (som hver tilsvarer 0,1 ml/kg av 0,5 M løsningen) ved avbildning i hvile og under stress. Den anbefalte dosen av <virkestoff (INN) > hos voksne og barn, er 0,05 mmol/kg kroppsvekt (0,1 ml/kg av oppløsningen på 0,5 M). Den laveste dosen som gir tilstrekkelig forsterkning for diagnostiske formål, skal brukes. Dosen skal beregnes basert på pasientens kroppsvekt og skal ikke overskride den anbefalte dosen per kg kroppsvekt som er angitt under dette punktet. ( ) Bildeinnhenting etter bruk av kontrastmiddel: Lever Dynamisk avbildning: Umiddelbart etter bolusinjeksjon. Forsinket avbildning: mellom 40 og 120 minutter etter injeksjonen, avhengig av de individuelle avbildningsbehov. Hjerne og ryggrad inntil 60 minutter etter administreringen. MRA umiddelbart etter administreringen, med scan-forsinkelse kalkulert på grunnlag av testbolus eller automatisk bolusdeteksjonsteknikk. Dersom automatisk kontrast-deteksjonspulssekvens ikke benyttes ved tidsberegning av bolus, skal en testbolusinjeksjon på <2 ml av kontrastmidlet benyttes for å beregne riktig scan-forsinkelse. Bryst En T1-vektet, ekkogradert sekvens med tidsoppløsning på 2 minutter eller midre bør fremskaffes før injeksjon av kontrast, og gjentas flere ganger i løpet av en periode på 5 til 8 minutter etter en rask intravenøs bolusinjeksjon av kontrast. Andre områder av T1-vektede sekvenser fremskaffet som enten dynamisk eller statisk forsinket avbildning. kroppen Spesielle populasjoner Nedsatt nyrefunksjon ( ) 34
6 Hvis bruk av <Produktnavn> ikke kan unngås, skal dosen ikke overskride 0,1 mmol/kg kroppsvekt ved bruk til MR av hjernen og ryggraden, MR-angiografi, MR av bryst eller MR av hele kroppen, og skal ikke overskride 0,05 mmol/kg kroppsvekt. Ved bruk til MR av lever, nyrer, urinveier eller binyrer. Det skal ikke benyttes mer enn én dose per skanning, med unntak av MR-avbildning av hjerteperfusjon, der to doser på 0,05 mmol/kg kroppsvekt kan administreres ved samme undersøkelse. På grunn av manglende informasjon om gjentatt administrering, skal injeksjoner med <Produktnavn> ikke gjentas med mindre intervallene mellom injeksjonene er minst 7 dager. Pkt. 4.4 Advarsler og forsiktighetsregler Etter administrering kan <virkestoff (INN)> bli holdt tilbake i hjernen og i annet vev i kroppen (skjelett, lever, nyrer, hud) og kan forårsake doseavhengige økninger i T1-vektet signalintensitet i hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Kliniske konsekvenser er ikke kjent. Mulige diagnostiseringsfordeler ved bruk av <virkestoff (INN)> hos pasienter som vil ha behov for gjentatte skanninger, skal vurderes opp mot potensialet for avleiring av gadolinium i hjernen og annet vev. Pkt. 5.2 Farmakokinetiske egenskaper <Virkestoff (INN)> er en lineær GdCA. Studier har vist at gadolinium holdes tilbake i kroppen etter eksponering for GdCAer. Dette omfatter tilbakeholdelse i hjernen og i annet vev og organer. Med lineære GdCAer kan dette forårsake doseavhengige økninger i T1-vektet signalintensitet i hjernen, spesielt i nucleus dentatus, globus pallidus og thalamus. Signalintensiteten øker og ikke-kliniske data viser at gadolinium frigjøres fra lineære GdCAer. Pakningsvedlegg Avsnitt 1 Hva <Produktnavn> er og hva det brukes mot <Produktnavn> er et spesielt fargestoff (eller kontrastmiddel) som inneholder det sjeldne jordmetallet gadolinium og forbedrer bilder av leveren hjernen/ryggraden, arterier og andre områder av kroppenunder MR-undersøkelser. Det hjelper legen din å finne eventuelle unormale tilstander i leveren dinhjernen/ryggraden, arterier og andre områder av kroppen. Dette legemidlet er kun til diagnostisk bruk. <Produktnavn> er godkjent for bruk hos barn over to år. Avsnitt 2: Hva du må vite før du bruker <produktnavn> o Opphopning i kroppen <Produktnavn> virker fordi det inneholder et metall som heter gadolinium. Studier har vist at små mengder gadolinium kan bli igjen i kroppen, også i hjernen. Det er ikke sett noen bivirkninger på grunn av gadolinium som har blitt igjen i hjernen. Avsnitt 3 Hvordan du bruker <Produktnavn> <Produktnavn> injiseres i en blodåre, som regel i armen din, rett før en MR-undersøkelse. Mengden i milliliter som du får injisert, avhenger av hvor mye du veier (kg kroppsvekt). Den anbefalte dosen er: MR-undersøkelse av hjernen/ryggraden: 0,2 ml per kg kroppsvekt MR-undersøkaler av arterier (blodårer): 0,2 ml per kg kroppsvekt MR-undersøkelse av leveren, nyrer, urinveier eller binyrer: 0,1 ml per kg kroppsvekt MR-undersøkelse av brystet, hjertet eller andre områder av kroppen: 0,2 ml per kg kroppsvekt 35
7 del for helsepersonell: Bildeinnhenting etter bruk av kontrastmiddel: Lever Dynamisk avbildning: Forsinket avbildning: Umiddelbart etter bolusinjeksjon. mellom 40 og 120 minutter etter injeksjonen avhengig av de individuelle avbildningsbehov. Hjerne inntil 60 minutter etter administreringen. og ryggrad MRA Bryst Andre områder av kroppen umiddelbart etter administreringen, med scan-forsinkelse beregnet på grunnlag av testbolus eller automatisk bolusdeteksjonsteknikk. Dersom automatisk kontrastdeteksjonspulssekvens ikke benyttes ved tidsberegning av bolus, skal en testbolusinjeksjon på 2 ml av kontrastmidlet benyttes for å beregne riktig scanforsinkelse. En T1-vektet, ekkogradert sekvens med tidsoppløsning på 2 minutter eller mindre bør fremskaffes før injeksjon av kontrast, og gjentas flere ganger i løpet av en periode på 5 til 8 minutter etter en rask intravenøs bolusinjeksjon av kontrast. T1-vektede sekvenser bør fremskaffes enten for dynamisk eller statisk forsinkede bilder. Før administrering av <Produktnavn> anbefales det at alle pasienter screenes for nedsatt nyrefunksjon ved å ta laboratorieprøver. Det har vært flere rapporter om nefrogen systemisk fibrose (NSF) forbundet med bruk av enkelte kontrastmidler som inneholder gadolinium, hos pasienter med akutt eller kronisk alvorlig nedsatt nyrefunksjon (GFR <30 ml/minutt/1,73 m 2 ). Pasienter som gjennomgår levertransplantasjon er utsatt for spesiell risiko ettersom forekomsten av akutt nyresvikt er høy i denne gruppen. Fordi det er en mulighet for at NSF kan oppstå med <Produktnavn>, bør det derfor unngås hos pasienter med alvorlig nedsatt nyrefunksjon og hos pasienter i den perioperative levertransplantasjonsperioden med mindre den diagnostiske informasjonen er avgjørende og ikke tilgjengelig med MR der det ikke brukes kontrastmiddel. Hvis bruk av <Produktnavn> ikke kan unngås, skal dosen ikke overskride 0,1 mmol/kg kroppsvekt ved bruk til MR av hjernen og ryggraden, MR-angiografi, MR av bryst eller MR av hele kroppen og skal ikke overskride0,05 mmol/kg kroppsvekt ved bruk til MR av leveren., nyrene, urinveiene eller binyrene. Det skal ikke benyttes mer enn én dose per undersøkelse, med unntak av MR-avbildning ved hjerteperfusjon, der to doser på 0,05 mmol/kg kroppsvekt kan administreres ved samme undersøkelse. Det mangler informasjon om gjentatt dosering, og injeksjoner med <Produktnavn> bør derfor ikke gjentas med mindre intervallene mellom injeksjonene er minst 7 dager. På grunn av manglende informasjon om gjentatt administrering, skal injeksjoner med <Produktnavn> ikke gjentas med mindre intervallene mellom injeksjonene er minst 7 dager. 36
1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk.
 1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning til intraartikulær bruk inneholder
1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning til intraartikulær bruk inneholder
MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte
 1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
Omniscan gir bedre visualisering av unormale strukturer eller lesjoner og kan bidra til differensiering mellom friskt og patologisk vev.
 1 LEGEMIDLETS NAVN PREPARATOMTALE Omniscan 0,5 mmol/ml injeksjonsvæske, oppløsning Omniscan 0,5 mmol/ml injeksjonsvæske, oppløsning, ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder:
1 LEGEMIDLETS NAVN PREPARATOMTALE Omniscan 0,5 mmol/ml injeksjonsvæske, oppløsning Omniscan 0,5 mmol/ml injeksjonsvæske, oppløsning, ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder:
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Ablavar 0,25 mmol/ml, injeksjonsvæske, oppløsning Gadofosveset
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ablavar 0,25 mmol/ml, injeksjonsvæske, oppløsning Gadofosveset Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ablavar 0,25 mmol/ml, injeksjonsvæske, oppløsning Gadofosveset Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette
PREPARATOMTALE 1. LEGEMIDLETS NAVN. ProHance 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 PREPARATOMTALE 1. LEGEMIDLETS NAVN ProHance 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadoteridol 279,3 mg (0,5 mmol)/ml For fullstendig liste over hjelpestoffer,
PREPARATOMTALE 1. LEGEMIDLETS NAVN ProHance 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadoteridol 279,3 mg (0,5 mmol)/ml For fullstendig liste over hjelpestoffer,
Pakningsvedlegg: Informasjon til brukeren. Optimark 500 mikromol/ml injeksjonsvæske, oppløsning i en ferdigfylt sprøyte gadoversetamid
 Pakningsvedlegg: Informasjon til brukeren Optimark 500 mikromol/ml injeksjonsvæske, oppløsning i en ferdigfylt sprøyte gadoversetamid Les nøye gjennom dette pakningsvedlegget før du får dette legemidlet.
Pakningsvedlegg: Informasjon til brukeren Optimark 500 mikromol/ml injeksjonsvæske, oppløsning i en ferdigfylt sprøyte gadoversetamid Les nøye gjennom dette pakningsvedlegget før du får dette legemidlet.
1. VETERINÆRPREPARATETS NAVN
 1. VETERINÆRPREPARATETS NAVN Metomotyl 2,5 mg/ml injeksjonsvæske til katt og hund Metomotyl 5 mg/ml injeksjonsvæske til katt og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 2,5 mg/ml injeksjonsvæske
1. VETERINÆRPREPARATETS NAVN Metomotyl 2,5 mg/ml injeksjonsvæske til katt og hund Metomotyl 5 mg/ml injeksjonsvæske til katt og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 2,5 mg/ml injeksjonsvæske
Anbefalinger fra PRAC etter signalutredning - oppdatering av produktinformasjon
 5. februar 2015 EMA/PRAC/95586/2015 PRAC- Det europeiske legemiddelkontorets komité for legemiddelovervåkning Anbefalinger fra PRAC etter signalutredning - oppdatering av produktinformasjon Vedtatt 6.-9.
5. februar 2015 EMA/PRAC/95586/2015 PRAC- Det europeiske legemiddelkontorets komité for legemiddelovervåkning Anbefalinger fra PRAC etter signalutredning - oppdatering av produktinformasjon Vedtatt 6.-9.
Tillegg til preparatomtale og pakningsvedlegg presentert av EMA (det europeiske legemiddelkontoret)
 Vedlegg II Tillegg til preparatomtale og pakningsvedlegg presentert av EMA (det europeiske legemiddelkontoret) Denne preparatomtalen og pakningsvedlegget er et resultat av voldgiftsprosedyren. Produktinformasjonen
Vedlegg II Tillegg til preparatomtale og pakningsvedlegg presentert av EMA (det europeiske legemiddelkontoret) Denne preparatomtalen og pakningsvedlegget er et resultat av voldgiftsprosedyren. Produktinformasjonen
Bør bare brukes på gynekologiske- eller fødeavdelinger med nødvendig utrustning. Minprostin skal
 1. LEGEMIDLETS NAVN Minprostin 0,5 mg / 2,5 ml endocervikalgel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Dinoproston (prostaglandin E2) 0,2 mg/ml For fullstendig liste over hjelpestoffer se pkt. 6.1.
1. LEGEMIDLETS NAVN Minprostin 0,5 mg / 2,5 ml endocervikalgel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Dinoproston (prostaglandin E2) 0,2 mg/ml For fullstendig liste over hjelpestoffer se pkt. 6.1.
Hjelpestoffer med kjent effekt: 1 ml inneholder 0,00056 mmol (tilsvarer 0,013 mg) natrium (se pkt. 4.4).
 1. LEGEMIDLETS NAVN Gadovist 1,0 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte/sylinderampulle 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder 604,72 mg
1. LEGEMIDLETS NAVN Gadovist 1,0 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte/sylinderampulle 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder 604,72 mg
1 ml injeksjonsvæske, oppløsning inneholder 604,72 mg gadobutrol (tilsvarende 1,0 mmol gadobutrol med 157,25 mg gadolinium).
 1. LEGEMIDLETS NAVN Gadovist 1,0 mmol/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder 604,72 mg gadobutrol (tilsvarende 1,0 mmol gadobutrol
1. LEGEMIDLETS NAVN Gadovist 1,0 mmol/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder 604,72 mg gadobutrol (tilsvarende 1,0 mmol gadobutrol
Vedlegg II. Endringer til relevante avsnitt i preparatomtale og pakningsvedlegg
 Vedlegg II Endringer til relevante avsnitt i preparatomtale og pakningsvedlegg 1 For preparater som inneholder angiotensinkonverterende enyzymhemmerne (ACEhemmere) benazepril, kaptopril, cilazapril, delapril,
Vedlegg II Endringer til relevante avsnitt i preparatomtale og pakningsvedlegg 1 For preparater som inneholder angiotensinkonverterende enyzymhemmerne (ACEhemmere) benazepril, kaptopril, cilazapril, delapril,
Ibuprofen Tablets 400mg 300MG 400MG
 Medlemsland EØS Innehaver av markedsføringstillatelse INN Fantasinavn/ Legemidlets navn Styrke Legemiddelform Administrasjonsvei Storbritannia Medley Pharma Limited Unit 2A, Olympic Way, Sefton Business
Medlemsland EØS Innehaver av markedsføringstillatelse INN Fantasinavn/ Legemidlets navn Styrke Legemiddelform Administrasjonsvei Storbritannia Medley Pharma Limited Unit 2A, Olympic Way, Sefton Business
1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som dimegluminsalt
 1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som
1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som
1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som dimegluminsalt
 1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som
1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre 334 mg (0,5 M) som
PREPARATOMTALE 1. LEGEMIDLETS NAVN. Dotarem 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Dotarem 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadotersyre tilsvarende DOTA tilsvarende gadoliniumoksid 279,3 mg/ml (= 0,5
PREPARATOMTALE 1. LEGEMIDLETS NAVN Dotarem 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadotersyre tilsvarende DOTA tilsvarende gadoliniumoksid 279,3 mg/ml (= 0,5
NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml
 NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml NeuroBloc-veiledning for leger, utgave 1, august 2014 1 Viktig sikkerhetsinformasjon for leger Hensikten med denne håndboken er å
NeuroBloc Botulinumtoksin type B injeksjonsvæske, oppløsning 5000 E/ml NeuroBloc-veiledning for leger, utgave 1, august 2014 1 Viktig sikkerhetsinformasjon for leger Hensikten med denne håndboken er å
PREPARATOMTALE. Anbefalt dose er 0,2 ml/kg kroppsvekt (0,1 mmol/kg kroppsvekt) til voksne.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Dotarem 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadotersyre tilsvarende DOTA tilsvarende gadoliniumoksid 279,3 mg/ml (= 0,5
PREPARATOMTALE 1. LEGEMIDLETS NAVN Dotarem 279,3 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Gadotersyre tilsvarende DOTA tilsvarende gadoliniumoksid 279,3 mg/ml (= 0,5
MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte
 1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
PREPARATOMTALE. Aktiv ingrediens Mengde 1 ml rekonstituert Soluvit inneholder: Tiaminmononitrat 3,1 mg 0,31 mg (Tilsvarer Vitamin B1 2,5 mg)
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Soluvit, pulver til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 hetteglass Soluvit inneholder: Aktiv ingrediens Mengde 1 ml rekonstituert
PREPARATOMTALE 1. LEGEMIDLETS NAVN Soluvit, pulver til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 hetteglass Soluvit inneholder: Aktiv ingrediens Mengde 1 ml rekonstituert
1. LEGEMIDLETS NAVN. MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
1. LEGEMIDLETS NAVN MultiHance 334 mg/ml (0,5 mmol/ml) injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: gadobensyre
Hvem er dette heftet beregnet på?
 Kronisk nyresvikt Hvem er dette heftet beregnet på? Dette heftet er ment til deg som helsepersonell og er et verktøy ved opplæring og dialog med omsorgspersoner og foreldre til barn med kronisk nyresvikt.
Kronisk nyresvikt Hvem er dette heftet beregnet på? Dette heftet er ment til deg som helsepersonell og er et verktøy ved opplæring og dialog med omsorgspersoner og foreldre til barn med kronisk nyresvikt.
Preparatomtale (SPC) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder: Vi polysakkarid fra Salmonella typhi
 1 LEGEMIDLETS NAVN Preparatomtale (SPC) Typherix 25 mikrogram/0,5 ml, injeksjonsvæske, oppløsning. Vaksine mot tyfoidfeber (Vi polysakkarid) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder:
1 LEGEMIDLETS NAVN Preparatomtale (SPC) Typherix 25 mikrogram/0,5 ml, injeksjonsvæske, oppløsning. Vaksine mot tyfoidfeber (Vi polysakkarid) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder:
Vedlegg III Endringer til preparatomtalen og pakningsvedlegget
 Vedlegg III Endringer til preparatomtalen og pakningsvedlegget Merknad: Disse endringene skal innlemmes i den gjeldende preparatomtalen, merkingen og pakningsvedlegget som er de endelige versjonene oppnådd
Vedlegg III Endringer til preparatomtalen og pakningsvedlegget Merknad: Disse endringene skal innlemmes i den gjeldende preparatomtalen, merkingen og pakningsvedlegget som er de endelige versjonene oppnådd
VEDLEGG III ENDRINGER TIL RELEVANTE DELER AV PREPARATOMTALE OG PAKNINGSVEDLEGG
 VEDLEGG III ENDRINGER TIL RELEVANTE DELER AV PREPARATOMTALE OG PAKNINGSVEDLEGG Mrek: Endringene i preparatomtalen og pakningsvedlegget må eventuelt senere oppdateres av de nasjonale kompetente myndighetene,
VEDLEGG III ENDRINGER TIL RELEVANTE DELER AV PREPARATOMTALE OG PAKNINGSVEDLEGG Mrek: Endringene i preparatomtalen og pakningsvedlegget må eventuelt senere oppdateres av de nasjonale kompetente myndighetene,
1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk.
 1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning til intraartikulær bruk inneholder
1. LEGEMIDLETS NAVN Magnevist 1,88 mg/ml (2 mmol Gd/l) injeksjonsvæske, oppløsning til intraartikulær bruk. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning til intraartikulær bruk inneholder
Viktig informasjon til helsepersonell som behandler. HBV-pasienter. (voksne og barn) med tenofovir disoproksil. TEVA 245 mg filmdrasjerte tabletter
 Viktig informasjon til helsepersonell som behandler HBV-pasienter (voksne og barn) med tenofovir disoproksil TEVA 245 mg filmdrasjerte tabletter Til helsepersonell som behandler voksne med HBV Renal håndtering
Viktig informasjon til helsepersonell som behandler HBV-pasienter (voksne og barn) med tenofovir disoproksil TEVA 245 mg filmdrasjerte tabletter Til helsepersonell som behandler voksne med HBV Renal håndtering
4.1 Indikasjoner Sporelementtilskudd for å dekke basale til moderat økte behov ved parenteral ernæring.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Addaven, konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Addaven inneholder: 1 ml 1 ampulle (10 ml) Kromklorid (6H2O) 5,33 mikrog
PREPARATOMTALE 1. LEGEMIDLETS NAVN Addaven, konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Addaven inneholder: 1 ml 1 ampulle (10 ml) Kromklorid (6H2O) 5,33 mikrog
Citalopram bør gis som en enkelt daglig dose på 20 mg. Avhengig av individuell respons kan dosen økes til maksimalt 40 mg daglig.
 Citalopram og risiko for QT-forlengelse PREPARATOMTALE citalopram 10, 20, 30 og 40 mg tabletter 4.2. Dosering og administrasjonsmåte Depresjon Citalopram bør gis som en enkelt daglig dose på 20 mg. Avhengig
Citalopram og risiko for QT-forlengelse PREPARATOMTALE citalopram 10, 20, 30 og 40 mg tabletter 4.2. Dosering og administrasjonsmåte Depresjon Citalopram bør gis som en enkelt daglig dose på 20 mg. Avhengig
PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund
 PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
Sedering av hest for transport, undersøkelse og behandling, premedikasjon før induksjon av generell anestesi.
 PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Sedivet vet. 10 mg/ml injeksjonsvæske, oppløsning til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff:
PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Sedivet vet. 10 mg/ml injeksjonsvæske, oppløsning til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff:
Hypoglykemiske tilstander, f.eks. insulinkoma. Behov for parenteral karbohydrattilførsel.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1
Vedlegg I. Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen
 Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
PENTHROX (metoksyfluran)
 PENTHROX (metoksyfluran) Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette
PENTHROX (metoksyfluran) Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette
Metoder. Røntgen Ultralyd. CTA MRA Angiografi TEE
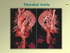 Thorakal Aorta Metoder Røntgen Ultralyd TEE CTA MRA Angiografi Metoder Røntgen Ultralyd TEE CTA Angiografi MRA Metoder Røntgen Metoder Røntgen Metoder Røntgen Ultralyd TEE CTA Angiografi MRA Transthorakal
Thorakal Aorta Metoder Røntgen Ultralyd TEE CTA MRA Angiografi Metoder Røntgen Ultralyd TEE CTA Angiografi MRA Metoder Røntgen Metoder Røntgen Metoder Røntgen Ultralyd TEE CTA Angiografi MRA Transthorakal
Pediatrisk populasjon: Legemidlet bør ikke brukes til barn siden det ikke finnes tilgjengelige sikkerhetsdata.
 1. LEGEMIDLETS NAVN Kaliumklorid Orifarm 750 mg depottabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En depottablett inneholder 750 mg kaliumklorid. For fullstendig liste over hjelpestoffer, se pkt.
1. LEGEMIDLETS NAVN Kaliumklorid Orifarm 750 mg depottabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En depottablett inneholder 750 mg kaliumklorid. For fullstendig liste over hjelpestoffer, se pkt.
CUBICIN VIKTIG SIKKERHETS- INFORMASJON
 CUBICIN VIKTIG SIKKERHETS- INFORMASJON For fullstendige opplysninger se preparatomtalen (SPC) som kan søkes opp på www.legemiddelverket.no/legemiddelsoek Anbefalinger Pediatriske pasienter Det er rapportert
CUBICIN VIKTIG SIKKERHETS- INFORMASJON For fullstendige opplysninger se preparatomtalen (SPC) som kan søkes opp på www.legemiddelverket.no/legemiddelsoek Anbefalinger Pediatriske pasienter Det er rapportert
1. LEGEMIDLETS NAVN. Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte
 1. LEGEMIDLETS NAVN Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 279,3
1. LEGEMIDLETS NAVN Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning Clariscan 0,5 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 279,3
NO DHPC 01/2017 HALDOL OG HALDOL DEPOT, ALLE DOSERINGSFORMER (TABLETTER, INJEKSJONSVÆSKE, OPPLØSNING) Kjære helsepersonell,
 11.08.2017 NO DHPC 01/2017 HALDOL OG HALDOL DEPOT, ALLE DOSERINGSFORMER (TABLETTER, INJEKSJONSVÆSKE, OPPLØSNING) Kjære helsepersonell, Janssen Cilag AS ønsker å informere om at Det europeiske legemiddelkontoret
11.08.2017 NO DHPC 01/2017 HALDOL OG HALDOL DEPOT, ALLE DOSERINGSFORMER (TABLETTER, INJEKSJONSVÆSKE, OPPLØSNING) Kjære helsepersonell, Janssen Cilag AS ønsker å informere om at Det europeiske legemiddelkontoret
PREPARATOMTALE. 154 mmol/l 154 mmol/l
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Natriumklorid Braun 9 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Natriumklorid Elektrolyttinnhold:
PREPARATOMTALE 1. LEGEMIDLETS NAVN Natriumklorid Braun 9 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Natriumklorid Elektrolyttinnhold:
MR KONTRAST OG NYRESYKDOM
 MR KONTRAST OG NYRESYKDOM Høstmøtet, Norsk Indremedisinsk Forening Oslo, den 27/10 2011 v. overlege Jakob Anker Jørgensen Disposisjon MR kontrast midler Nefrogen systemisk fibrose klinikk og et historisk
MR KONTRAST OG NYRESYKDOM Høstmøtet, Norsk Indremedisinsk Forening Oslo, den 27/10 2011 v. overlege Jakob Anker Jørgensen Disposisjon MR kontrast midler Nefrogen systemisk fibrose klinikk og et historisk
Veiledning til forskriver
 Viktig sikkerhetsinformasjon MAVENCLAD 10 mg tabletter kladribin Veiledning til forskriver Melding av bivirkninger Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til sitt regionale legemiddelinformasjonssenter
Viktig sikkerhetsinformasjon MAVENCLAD 10 mg tabletter kladribin Veiledning til forskriver Melding av bivirkninger Helsepersonell oppfordres til å melde enhver mistenkt bivirkning til sitt regionale legemiddelinformasjonssenter
unntatt reseptplikt, markedsført Voltarol 11,6 mg/g (1,16%) gel 50 g
 Innspill til endring i LUA-listen GSK Consumer Healthcare/Novartis Norge AS Preparatnavn Prosedyretype Virkestoff MTnr Prosedyretype Pakningsstørrelse unntatt reseptplikt, markedsført Voltarol 11,6 mg/g
Innspill til endring i LUA-listen GSK Consumer Healthcare/Novartis Norge AS Preparatnavn Prosedyretype Virkestoff MTnr Prosedyretype Pakningsstørrelse unntatt reseptplikt, markedsført Voltarol 11,6 mg/g
1. VETERINÆRPREPARATETS NAVN. Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Meloksikam 5 mg Hjelpestoff: Etanol
1. VETERINÆRPREPARATETS NAVN Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Meloksikam 5 mg Hjelpestoff: Etanol
EKSAMENSOPPGAVE/ EKSAMENSOPPGÅVE
 AVDELING FOR HELSE- OG SOSIALFAG EKSAMENSOPPGAVE/ EKSAMENSOPPGÅVE Utdanning : Institutt for radiografi Kull : R09 Emnekode/-navn/-namn : BRF10 Farmakologi med medikamentregning Eksamensform : Skriftlig/skriftleg
AVDELING FOR HELSE- OG SOSIALFAG EKSAMENSOPPGAVE/ EKSAMENSOPPGÅVE Utdanning : Institutt for radiografi Kull : R09 Emnekode/-navn/-namn : BRF10 Farmakologi med medikamentregning Eksamensform : Skriftlig/skriftleg
1. LEGEMIDLETS NAVN. Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. LEGEMIDLETS NAVN Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Kaliumklorid 74,6 mg/ml, tilsvarende 1 mmol/ml Elektrolyttprofilen til 1 ml
1. LEGEMIDLETS NAVN Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Kaliumklorid 74,6 mg/ml, tilsvarende 1 mmol/ml Elektrolyttprofilen til 1 ml
PREPARATOMTALE. Hjelpestoff(er) med kjent effekt: Cetylalkohol 1,10 % w/w, stearylalkohol 0,50 % w/w and propylenglykol 2,00 % w/w
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Bettamousse 1mg/g (0,1 %) skum 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 g skum inneholder 1 mg betametason (0,1 %) som valerat Hjelpestoff(er) med kjent effekt: Cetylalkohol
PREPARATOMTALE 1. LEGEMIDLETS NAVN Bettamousse 1mg/g (0,1 %) skum 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 g skum inneholder 1 mg betametason (0,1 %) som valerat Hjelpestoff(er) med kjent effekt: Cetylalkohol
Oppløsnings- og fortynningsvæske til pulvere, konsentrater og oppløsninger til injeksjon.
 1 1. LEGEMIDLETS NAVN Sterile Water Fresenius Kabi, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml oppløsningsvæske inneholder: 100 g vann til injeksjonsvæsker 3.
1 1. LEGEMIDLETS NAVN Sterile Water Fresenius Kabi, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml oppløsningsvæske inneholder: 100 g vann til injeksjonsvæsker 3.
PREPARATOMTALE. Gonazon
 PREPARATOMTALE Gonazon 1. VETERINÆRPREPARATETS NAVN Gonazon konsentrat til injeksjonsvæske for hunner i laksefamilien. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING HETTEGLASS INNEHOLDENDE KONSENTRAT : Virkestoff
PREPARATOMTALE Gonazon 1. VETERINÆRPREPARATETS NAVN Gonazon konsentrat til injeksjonsvæske for hunner i laksefamilien. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING HETTEGLASS INNEHOLDENDE KONSENTRAT : Virkestoff
Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk
 1. LEGEMIDLETS NAVN 1 Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Natriumklorid 9 mg/ml inneholder: Natriumklorid Vann til
1. LEGEMIDLETS NAVN 1 Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Natriumklorid 9 mg/ml inneholder: Natriumklorid Vann til
Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin
 1. VETERINÆRPREPARATETS NAVN Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: mikrogram R(+)-Kloprostenol
1. VETERINÆRPREPARATETS NAVN Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: mikrogram R(+)-Kloprostenol
1. LEGEMIDLETS NAVN. Mannitol 150 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING. 1000 ml inneholder: Mannitol 150 g
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Mannitol 150 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml inneholder: Mannitol 150 g Osmolalitet: ca. 950 mosmol/kg vann ph:
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Mannitol 150 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml inneholder: Mannitol 150 g Osmolalitet: ca. 950 mosmol/kg vann ph:
Vedlegg I. Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen
 Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
1 ml injeksjonsvæske inneholder 469 mg (0,5 mmol) dimeglumingadopentetat.
 1. LEGEMIDLETS NAVN Magnevist 0,5 mmol/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske inneholder 469 mg (0,5 mmol) dimeglumingadopentetat. For fullstendig
1. LEGEMIDLETS NAVN Magnevist 0,5 mmol/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske inneholder 469 mg (0,5 mmol) dimeglumingadopentetat. For fullstendig
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
1. LEGEMIDLETS NAVN. Hjelpestoff(er) med kjent effekt: Isomalt 1830,0 mg (E953) og 457,6 mg flytende maltitol (E965).
 1. LEGEMIDLETS NAVN Solvivo 0,6 mg/1,2 mg sugetablett med mintsmak Solvivo 0,6 mg/1,2 mg sugetablett med honning- og sitronsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver sugetablett inneholder: amylmetakresol
1. LEGEMIDLETS NAVN Solvivo 0,6 mg/1,2 mg sugetablett med mintsmak Solvivo 0,6 mg/1,2 mg sugetablett med honning- og sitronsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver sugetablett inneholder: amylmetakresol
Vær sikker på at dyret har gjenvunnet normale svelgereflekser før det tilbys fôr og drikke.
 1. VETERINÆRPREPARATETS NAVN Sedastop vet. 5 mg/ml injeksjonsvæske, 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezol 4,27 mg (tilsv. 5,0 mg atipamezolhydroklorid) Hjelpestoff:
1. VETERINÆRPREPARATETS NAVN Sedastop vet. 5 mg/ml injeksjonsvæske, 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezol 4,27 mg (tilsv. 5,0 mg atipamezolhydroklorid) Hjelpestoff:
Primovist 0,25 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte
 1. LEGEMIDLETS NAVN Primovist 0,25 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder 0,25 mmol dinatriumgadoksetat (dinatriumgd-eob-dtpa)
1. LEGEMIDLETS NAVN Primovist 0,25 mmol/ml injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder 0,25 mmol dinatriumgadoksetat (dinatriumgd-eob-dtpa)
Tilberedning og injeksjon
 Se s. 2, 10 og 11 for dosering voksne og barn Tilberedning og injeksjon qilaris 150 mg pulver for oppløsning til injeksjon Veiledning for pasienter og helsepersonell om klargjøring og administrering av
Se s. 2, 10 og 11 for dosering voksne og barn Tilberedning og injeksjon qilaris 150 mg pulver for oppløsning til injeksjon Veiledning for pasienter og helsepersonell om klargjøring og administrering av
Vedlegg III. Endring til relevante avsnitt i produktinformasjonen
 Vedlegg III Endring til relevante avsnitt i produktinformasjonen Merk: Endringene i relevante avsnitt i preparatomtalen og pakningsvedlegget er et resultat av en referralprosedyre. Produktinformasjonen
Vedlegg III Endring til relevante avsnitt i produktinformasjonen Merk: Endringene i relevante avsnitt i preparatomtalen og pakningsvedlegget er et resultat av en referralprosedyre. Produktinformasjonen
Dosering Doseringen justeres individuelt på grunnlag av pasientens alder, kroppsvekt og kliniske tilstand.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Kalium-Natrium-Glucose Braun infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Virkestoffer: Glukose (i form
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Kalium-Natrium-Glucose Braun infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Virkestoffer: Glukose (i form
1. VETERINÆRPREPARATETS NAVN. Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Toltrazuril Hjelpestoffer: Natriumbenzoat (E
1. VETERINÆRPREPARATETS NAVN Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Toltrazuril Hjelpestoffer: Natriumbenzoat (E
Én ml inneholder 1 mg dokusatnatrium (natriumdioktylsulfosuksinat) og 250 mg sorbitol (E 420).
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Klyx (1 mg/ml) / (250 mg/ml) rektalvæske,
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Klyx (1 mg/ml) / (250 mg/ml) rektalvæske,
1. LEGEMIDLETS NAVN. Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest
 1. LEGEMIDLETS NAVN Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Soluprick Positiv kontroll:
1. LEGEMIDLETS NAVN Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Soluprick Positiv kontroll:
Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin.
 1. LEGEMIDLETS NAVN Minirin 0,1 mg/ml nesedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin. For fullstendig
1. LEGEMIDLETS NAVN Minirin 0,1 mg/ml nesedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin. For fullstendig
1. VETERINÆRPREPARATETS NAVN. Revertor vet 5 mg/ml injeksjonsvæske, oppløsning til hund og katt 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Revertor vet 5 mg/ml til hund og katt 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezolhydroklorid 5,0 mg Hjelpestoff: Metylparahydroksybenzoat
1. VETERINÆRPREPARATETS NAVN Revertor vet 5 mg/ml til hund og katt 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezolhydroklorid 5,0 mg Hjelpestoff: Metylparahydroksybenzoat
1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Diprosalic liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
PREPARATOMTALE 1. LEGEMIDLETS NAVN Diprosalic liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
Skal ikke brukes samtidig med piperazinholdige preparater. Se pkt. 4.7 og 4.8.
 1. VETERINÆRPREPARATETS NAVN Welpan vet.15 mg/ml + 5 mg/ml mikstur, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder Virkestoffer: Febantel Pyrantel 15,0 mg 5,0 mg (som pyrantelembonat
1. VETERINÆRPREPARATETS NAVN Welpan vet.15 mg/ml + 5 mg/ml mikstur, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder Virkestoffer: Febantel Pyrantel 15,0 mg 5,0 mg (som pyrantelembonat
Energi for maksimal ytelse
 Energi for maksimal ytelse Det er bevist at øker livskvaliteten hos eldre hunder, ved å sørge for en forbedret og mer aktiv livsstil. Propentofyllin, virkestoffet i, øker oksygentilførselen til cellene,
Energi for maksimal ytelse Det er bevist at øker livskvaliteten hos eldre hunder, ved å sørge for en forbedret og mer aktiv livsstil. Propentofyllin, virkestoffet i, øker oksygentilførselen til cellene,
RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN
 Til sykepleier - Veileder for dosering og administrasjon RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN En veiledning som skal hjelpe
Til sykepleier - Veileder for dosering og administrasjon RoActemra for Systemisk Juvenil Idiopatisk Artritt (sjia) VEILEDER FOR DOSERING OG ADMINISTRASJON - TRINN FOR TRINN En veiledning som skal hjelpe
Forskriverveiledning for Xarelto (rivaroksaban)
 Forskriverveiledning for Xarelto (rivaroksaban) NB: Fullstendig forskriverinformasjon finnes i godkjent preparatomtale Pasientkort Et pasientkort skal gis til hver enkelt pasient som får forskrevet Xarelto
Forskriverveiledning for Xarelto (rivaroksaban) NB: Fullstendig forskriverinformasjon finnes i godkjent preparatomtale Pasientkort Et pasientkort skal gis til hver enkelt pasient som får forskrevet Xarelto
Tradisjonelt plantebasert legemiddel for å lindre lokale muskelsmerter hos voksne.
 1. LEGEMIDLETS NAVN Chiana-Olje dråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1ml inneholder: 1 ml Menthae x piperita L.aetheroleum (peppermynteolje) 3. LEGEMIDDELFORM Dråper, oppløsning
1. LEGEMIDLETS NAVN Chiana-Olje dråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1ml inneholder: 1 ml Menthae x piperita L.aetheroleum (peppermynteolje) 3. LEGEMIDDELFORM Dråper, oppløsning
Eldre Det er ikke nødvendig å justere dosen ved behandling av eldre pasienter.
 1. LEGEMIDLETS NAVN Glucosamin Orifarm 400 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Glukosamin 400 mg (som glukosaminsulfatkaliumklorid). For fullstendig liste over hjelpestoffer
1. LEGEMIDLETS NAVN Glucosamin Orifarm 400 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Glukosamin 400 mg (som glukosaminsulfatkaliumklorid). For fullstendig liste over hjelpestoffer
Tilberedning og injeksjon
 Se s. 2 og 10 for anbefalt dosering Tilberedning og injeksjon qilaris 150 mg pulver til injeksjonsvæske, oppløsning Veiledning for pasienter og helsepersonell om klargjøring og administrering av ILARIS
Se s. 2 og 10 for anbefalt dosering Tilberedning og injeksjon qilaris 150 mg pulver til injeksjonsvæske, oppløsning Veiledning for pasienter og helsepersonell om klargjøring og administrering av ILARIS
Sedering og analgesi for undersøkelse, behandling og mindre kirurgiske inngrep hos hest og storfe.
 1. VETERINÆRPREPARATETS NAVN Domosedan vet. 10 mg/ml 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Detomidinhydroklorid 10 mg Se punkt 6.1 for komplett liste over hjelpestoffer.
1. VETERINÆRPREPARATETS NAVN Domosedan vet. 10 mg/ml 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Detomidinhydroklorid 10 mg Se punkt 6.1 for komplett liste over hjelpestoffer.
Shire utgir dette materialet for risikohåndtering som en del av sin tilknytning til EMA for å implementere den godkjente risikohåndteringsplanen.
 Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Shire utgir dette opplæringsmaterialet for å implementere den godkjente risikohåndteringsplanen som en del av sin forpliktelse overfor EMA.
Rekonstituering og administrering av Cinryze (C1-hemmer [human]) Shire utgir dette opplæringsmaterialet for å implementere den godkjente risikohåndteringsplanen som en del av sin forpliktelse overfor EMA.
Pakningsvedlegg: Informasjon til brukeren. Clarityn 10 mg tablett loratadin
 Pakningsvedlegg: Informasjon til brukeren Clarityn 10 mg tablett loratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er viktig for
Pakningsvedlegg: Informasjon til brukeren Clarityn 10 mg tablett loratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er viktig for
Oppløsnings- eller fortynningsmiddel ved tilberedning av injeksjonsvæsker.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold
Hjelpestoffer med kjent effekt: sorbitol (256 mg/ml), metylparahydroksybenzoat (1 mg/ml) og etanol (40 mg/ml)
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Solvipect comp 2,5 mg/ml + 5 mg/ml mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder: Etylmorfinhydroklorid 2,5 mg Guaifenesin 5
PREPARATOMTALE 1. LEGEMIDLETS NAVN Solvipect comp 2,5 mg/ml + 5 mg/ml mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder: Etylmorfinhydroklorid 2,5 mg Guaifenesin 5
1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer se pkt. 6.1.
 1. LEGEMIDLETS NAVN Weifapenin 50 mg/ml pulver til mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer
1. LEGEMIDLETS NAVN Weifapenin 50 mg/ml pulver til mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer
Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1.
 1. LEGEMIDLETS NAVN Xylocain liniment 3 % 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
1. LEGEMIDLETS NAVN Xylocain liniment 3 % 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
PREPARATOMTALE. Page 1
 PREPARATOMTALE Page 1 1. LEGEMIDLETS NAVN Oftagel 2,5 mg/g øyegel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Karbomer 974P 2,5 mg/g Hjelpestoff(er) med kjent virkning: benzalkoniumklorid (0,06 mg/g) For
PREPARATOMTALE Page 1 1. LEGEMIDLETS NAVN Oftagel 2,5 mg/g øyegel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Karbomer 974P 2,5 mg/g Hjelpestoff(er) med kjent virkning: benzalkoniumklorid (0,06 mg/g) For
1. VETERINÆRPREPARATETS NAVN. Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff(er): Buserelinacetat
1. VETERINÆRPREPARATETS NAVN Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff(er): Buserelinacetat
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Romefen vet injeksjonsvæske, oppløsning 100 mg/ml 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff 1 ml inneholder: Ketoprofen 100 mg 3. LEGEMIDDELFORM
VEDLEGG I PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Romefen vet injeksjonsvæske, oppløsning 100 mg/ml 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff 1 ml inneholder: Ketoprofen 100 mg 3. LEGEMIDDELFORM
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Dysect vet 12,5 g/l påhellingsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Alfacypermetrin 12,5 g/l Hjelpestoffer: Klorofyll-kobberkompleks
VEDLEGG I PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Dysect vet 12,5 g/l påhellingsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Alfacypermetrin 12,5 g/l Hjelpestoffer: Klorofyll-kobberkompleks
Viktig sikkerhetsinformasjon for å redusere risikoen for immunrelaterte bivirkninger. Informasjon til pasienter
 Pasientveiledning BAVENCIO (avelumab) Viktig sikkerhetsinformasjon for å redusere risikoen for immunrelaterte bivirkninger Informasjon til pasienter Dette legemidlet er underlagt særlig overvåking for
Pasientveiledning BAVENCIO (avelumab) Viktig sikkerhetsinformasjon for å redusere risikoen for immunrelaterte bivirkninger Informasjon til pasienter Dette legemidlet er underlagt særlig overvåking for
Til aktiv immunisering av Atlantisk laks for å redusere lesjoner i hjerte, dødelighet, og vekttap forårsaket av pankreas sykdom (PD).
 1. VETERINÆRPREPARATETS NAVN Norvax Compact PD vet. injeksjonsvæske, emulsjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose 0,1 ml vaksine Virkestoff(er): Salmon pancreas disease virus (SPDV) stamme
1. VETERINÆRPREPARATETS NAVN Norvax Compact PD vet. injeksjonsvæske, emulsjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose 0,1 ml vaksine Virkestoff(er): Salmon pancreas disease virus (SPDV) stamme
Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter]
![Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter] Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter]](/thumbs/39/19534687.jpg) PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 1 mmol/ml konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml konsentrat til infusjonsvæske inneholder:
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 1 mmol/ml konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml konsentrat til infusjonsvæske inneholder:
Behandlingsområdet vaskes med såpe og vann og deretter tørkes med håndkle e.l. før påføringen.
 1. LEGEMIDLETS NAVN Wartec 5 mg/ml liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Podofyllotoksin 5 mg/ml For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Liniment,
1. LEGEMIDLETS NAVN Wartec 5 mg/ml liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Podofyllotoksin 5 mg/ml For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Liniment,
PREPARATOMTALE (SPC) 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig liste over hjelpestoffer se pkt. 6.1.
 PREPARATOMTALE (SPC) 1. LEGEMIDLETS NAVN Weifapenin 400 mg og 650 mg tabletter. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig
PREPARATOMTALE (SPC) 1. LEGEMIDLETS NAVN Weifapenin 400 mg og 650 mg tabletter. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig
Brannskader: Brannsåret skal først renses, og deretter påføres kremen hele det affiserte området i et 3-5 mm tykt lag.
 1. LEGEMIDLETS NAVN Flamazine 10 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sølvsulfadiazin 10 mg/g (1 %) For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM Krem 4. KLINISKE
1. LEGEMIDLETS NAVN Flamazine 10 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sølvsulfadiazin 10 mg/g (1 %) For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM Krem 4. KLINISKE
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Lidokel-Adrenalin vet. "Kela" 20 mg/ml + 0,036 mg/ml injeksjonsvæske, oppløsning til hest og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoffer:
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Lidokel-Adrenalin vet. "Kela" 20 mg/ml + 0,036 mg/ml injeksjonsvæske, oppløsning til hest og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoffer:
Brosjyre for ofte stilte spørsmål
 Aripiprazol Helsepersonell Brosjyre for ofte stilte spørsmål Aripiprazol er indisert for inntil 12 ukers behandling av moderate til alvorlige maniske episoder hos ungdom med bipolar I lidelse i aldersgruppen
Aripiprazol Helsepersonell Brosjyre for ofte stilte spørsmål Aripiprazol er indisert for inntil 12 ukers behandling av moderate til alvorlige maniske episoder hos ungdom med bipolar I lidelse i aldersgruppen
4. KLINISKE OPPLYSNINGER 4.1 Indikasjoner Urinveisinfeksjoner forårsaket av mecillinamfølsomme mikroorganismer
 1. LEGEMIDLETS NAVN Selexid 1 g pulver til injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hvert hetteglass inneholder: Mecillinam 1 gram For fullstendig liste over hjelpestoffer,
1. LEGEMIDLETS NAVN Selexid 1 g pulver til injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hvert hetteglass inneholder: Mecillinam 1 gram For fullstendig liste over hjelpestoffer,
Overgang fra konvensjonell til CT agonal angiografi
 Overgang fra konvensjonell til CT agonal angiografi Gardermoen 14.9.2018 Prof. Nils-Einar Kløw Seksjonsoverlege for Thorax-, kar-, hjerte- og intervensjonsradiologi, Aker og Ullevål sykehus Bakgrunn Helsedirektoratet
Overgang fra konvensjonell til CT agonal angiografi Gardermoen 14.9.2018 Prof. Nils-Einar Kløw Seksjonsoverlege for Thorax-, kar-, hjerte- og intervensjonsradiologi, Aker og Ullevål sykehus Bakgrunn Helsedirektoratet
1. LEGEMIDLETS NAVN. Hibiscrub oppløsning 40 mg/ml til bruk på hud 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Hibiscrub oppløsning 40 mg/ml til bruk på hud 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Klorheksidindiglukonat 40 mg 3. LEGEMIDDELFORM Oppløsning
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Hibiscrub oppløsning 40 mg/ml til bruk på hud 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Klorheksidindiglukonat 40 mg 3. LEGEMIDDELFORM Oppløsning
Pasientveiledning Lemtrada
 Pasientveiledning Lemtrada Viktig sikkerhetsinformasjon Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt
Pasientveiledning Lemtrada Viktig sikkerhetsinformasjon Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt
Vedlegg I. Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen
 Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
Vedlegg I Vitenskapelige konklusjoner og grunnlag for endring i vilkårene for markedsføringstillatelsen 1 Vitenskapelige konklusjoner Basert på evalueringsrapporten fra PRAC vedrørende den/de periodiske
PREPARATOMTALE. Poliovirus type 1 (Brunhilde), type 2 (MEF-1) og type 3 (Saukett), dyrket i Vero-celler, renses og inaktiveres.
 PREPARATOMTALE 1 LEGEMIDLETS NAVN Veropol Injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose = 0,5 ml: Poliovirus type 1, inaktivert Poliovirus type 2,
PREPARATOMTALE 1 LEGEMIDLETS NAVN Veropol Injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose = 0,5 ml: Poliovirus type 1, inaktivert Poliovirus type 2,
