I LISA RAVIMI OMADUSTE KOKKUVÕTE
|
|
|
- Victoria Madsen
- 6 år siden
- Visninger:
Transkript
1 I LISA RAVIMI OMADUSTE KOKKUVÕTE 1
2 1. RAVIMPREPARAADI NIMETUS Constella 290 mikrogrammi kõvakapslid. 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS Üks kapsel sisaldab 290 mikrogrammi linaklotiidi. Abiainete täielik loetelu vt lõik RAVIMVORM Kõvakapsel Valge, kollakasvalge kuni oranž läbipaistmatu kapsel (18 mm x 6,35 mm), millele on halli tindiga märgistus KLIINILISED ANDMED 4.1 Näidustused Constella on näidustatud kõhukinnisusega esineva mõõduka kuni raske soole ärritussündroomi sümptomaatiliseks raviks täiskasvanutel. 4.2 Annustamine ja manustamisviis Annustamine Soovitatav annus on üks kapsel (290 mikrogrammi) üks kord päevas. Arstid peavad ravi jätkamise vajadust perioodiliselt hindama. Linaklotiidi efektiivsus vähemalt 6 kuu vältel on tõestatud topeltpimedates platseebokontrolliga uuringutes. Kui patsientidel ei ole sümptomid pärast 4-nädalast ravi paranenud, tuleb patsient uuesti läbi vaadata ning hinnata ravi jätkamise eeliseid ja riske. Patsientide erirühmad Maksa- või neerukahjustusega patsiendid Annuse reguleerimine pole maksa- või neerukahjustusega patsientide puhul vajalik (vt lõik 5.2). Eakad patsiendid Kuigi eakate patsientide korral ei ole annuse kohandamine vajalik, tuleb ravi hoolikalt jälgida ning perioodiliselt uuesti hinnata (vt lõik 4.4). Lapsed Constella ohutus ja efektiivsus lastel vanuses 0 kuni 18 aastat ei ole veel tõestatud. Andmed puuduvad. Seda ravimit ei soovitata kasutada lastel ja noorukitel (vt lõigud 4.4 ja 5.1). 2
3 Manustamisviis Suukaudseks kasutamiseks. Kapsel tuleb võtta vähemalt 30 minutit enne söögikorda (vt lõik 4.5). 4.3 Vastunäidustused Ülitundlikkus toimeaine või lõigus 6.1 loetletud mis tahes abiainete suhtes. Teadaoleva või kahtlustatava seedetrakti mehaanilise obstruktsiooniga patsiendid. 4.4 Erihoiatused ja ettevaatusabinõud kasutamisel Constellat tuleb kasutada pärast orgaaniliste haiguste välistamist ja mõõduka kuni raske soole ärritussündroomi (vt lõik 5.1) diagnoosi kinnitamist. Patsiendid peavad olema teadlikud, et ravi ajal võib esineda kõhulahtisust ja seedetrakti alumise osa verejooks. Neid tuleb juhendada teavitama oma arsti raske või pikaajalise kõhulahtisuse esinemisest või seedetrakti alumise osa verejooksust (vt lõik 4.8). Pikaajalise (st üle 1 nädala kestva) või raske kõhulahtisuse esinemisel tuleks kaaluda kuni kõhulahtisuse lakkamiseni linaklotiidi manustamise ajutist lõpetamist. Täiendav ettevaatus on vajalik patsientide puhul, kellel on soodumus vee või elektrolüütide tasakaalu häirumisele (nt eakad, kardiovaskulaarhaiguste (CV), diabeedi või hüpertensiooniga patsiendid) ja kaaluda tuleb elektrolüütide taseme jälgimist. Linaklotiidi kasutamist kroonilise põletikulise soolehaiguse nagu Crohni tõve või haavandilise koliidiga patsientidel ei ole uuritud; seetõttu pole Constella kasutamine neil patsientidel soovitatav. Eakad patsiendid Andmed eakate patsientide kohta on piiratud (vt lõik 5.1). Seoses kliinilistes uuringutes täheldatud diarröa suurema riskiga (vt lõik 4.8) tuleb pöörata nendele patsientidele suuremat tähelepanu ning tähelepanelikult ja perioodiliselt tuleb hinnata ravist saadava kasu ja riski suhet. Lapsed Constellat ei tohi lastel ja noorukitel kasutada, kuna seda ei ole selles populatsioonis uuritud. Kuna esimestel eluaastatel esineb teadaolevalt guanülaattsüklaas-c (GC-C) retseptorite ülemäärane aktiivsus, võivad alla 2-aastased lapsed olla linaklotiidi toimete suhtes eriti tundlikud. 4.5 Koostoimed teiste ravimitega ja muud koostoimed Koostoimeid ei ole uuritud. Linaklotiid on pärast soovitatavate kliiniliste annuste manustamist plasmas harva tuvastatav ja in vitro uuringud on näidanud, et linaklotiid ei ole tsütokroom P450 ensüümsüsteemi substraat ega ka inhibiitor/indutseerija ning et see ei reageeri mitmete tavaliste väljavoolu- ja sissevoolutransporteritega (vt lõik 5.2). Toidu koostoime kliiniline uuring tervetel patsientidel näitas, et linaklotiid raviannustes ei olnud plasmas tuvastatav ei pärast sööki ega pärast paastumist. Constella võtmine pärast sööki põhjustas sagedasemaid ja vedelamaid väljaheiteid ning rohkem gastrointestinaalseid kõrvalnähte kui võtmine pärast paastumist (vt lõik 5.1). Kapsel tuleb võtta 30 minutit enne sööki (vt lõik 4.2). Samaaegne ravi prootonpumba inhibiitorite, lahtistite või mittesteroidsete põletikuvastaste ravimitega võib kõhulahtisuse ohtu suurendada. Constella ning nende ravimite koosmanustamisel tuleb olla ettevaatlik. Raske või pikaajaline kõhulahtisus võib mõjutada teiste suukaudsete ravimite imendumist. Suukaudsete rasestumisvastaste vahendite mõju võib väheneda, mistõttu on soovitatav kasutada täiendavaid rasestumisvastaseid meetodeid, et tagada suukaudse rasestumisvastase vahendi toimimine 3
4 (vt suukaudse rasestumisvastase vahendi teavet). Ettevaatlik tuleb olla seedetraktis imenduvate kitsa terapeutilise vahemikuga ravimite (nagu levotüroksiin) määramisel, sest nende mõju võib väheneda. 4.6 Fertiilsus, rasedus ja imetamine Rasedus Andmed linaklotiidi kasutamise kohta rasedatel on piiratud. Loomkatsed ei näita otsest ega kaudset kahjulikku toimet reproduktiivsusele (vt lõik 5.3). Ettevaatusena on parem vältida Constella kasutamist raseduse ajal. Imetamine Ei ole teada, kas linaklotiid eritub rinnapiima. Riski vastsündinutele/imikutele ei saa välistada. Rinnaga toitmise katkestamine või ravi katkestamine/jätkamine üle Constella ga, tuleb otsustada arvestades imetamise kasu lapsele ja ravi kasu naisele. Fertiilsus Loomkatsed ei näita mingit toimet ei isas- ega emasloomade fertiilsusele. 4.7 Toime reaktsioonikiirusele Constella ei mõjuta või mõjutab ebaoluliselt autojuhtimise ja masinate käsitsemise võimet. 4.8 Kõrvaltoimed Ohutusprofiili kokkuvõte Kontrolliga kliinilistes uuringutes manustati linaklotiidi suukaudselt 1166 soole ärritussündroomiga patsiendile. Neist patsientidest sai 892 isikut linaklotiidi soovitatavas annuses 290 mikrogrammi ööpäevas. Summaarne ravimiga kokkupuude kliinilises programmis ületas 1500 patsientaastat. Kõige sagedasem Constella raviga seostatav kõrvaltoime oli kõhulahtisus, mis oli peamiselt kerge kuni mõõduka raskusega ja esines alla 20% patsientidest. Harvadel ja rasketel juhtudel võib kõhulahtisuse tagajärjel tekkida dehüdratsioon, hüpokaleemia, bikarbonaadi taseme vähenemine veres, pearinglus ja ortostaatiline hüpotensioon. Teised sagedased kõrvaltoimed (> 1%) olid kõhuvalu, kõhu paisumine ja kõhupuhitus. Kõrvaltoimete tabel Kontrolliga kliiniliste uuringute käigus soovitatava annusega, 290 mikrogrammi ööpäevas, teatati järgmistest kõrvaltoimetest, mille sagedused on: väga sage ( 1/10), sage ( 1/100 kuni <1/10), aegajalt ( 1/1000 kuni <1/100), harv ( 1/ kuni <1/1000), väga harv (<1/10 000) ja teadmata (ei saa hinnata olemasolevate andmete alusel). 4
5 MedDRA organsüsteemi klass Infektsioonid ja infestatsioonid Ainevahetus- ja toitumishäired Närvisüsteemi häired Väga sage Sage Aeg-ajalt Harv Teadmata Viraalne gastroenteriit Pearinglus Hüpokaleemia Dehüdratsioon Söögiisu vähenemine Vaskulaarsed häired Ortostaatiline hüpotensioon Seedetrakti häired Naha ja nahaaluskoe kahjustused Uuringud Kõhulahtisus Kõhuvalu Kõhupuhitus Kõhu paisumine Roojapidamatus Roojamispakitsus Seedetrakti alumise osa veritsus, s.h hemorroidide veritsus ja veritsus pärasoolest Iiveldus Oksendamine Bikarbonaadi taseme vähenemine veres Lööve Valitud kõrvaltoimete kirjeldus Kõhulahtisus on sagedaseim kõrvaltoime ja see vastab toimeaine farmakoloogilisele toimele. Ravi saanud patsientidest 2% koges rasket kõhulahtisust ning 5% patsientidest katkestas ravi kliinilistes uuringutes kõhulahtisuse tõttu. Enamik teatatud kõhulahtisuse juhtudest olid kerged (43%) kuni mõõdukad (47%); 2%-l ravitud patsientidel esines raske kõhulahtisus. Ligikaudu pooled kõhulahtisuse episoodidest algas esimese ravinädala jooksul. Ligikaudu kolmandikul patsientidest möödus kõhulahtisus seitsme päeva jooksul, kuid 80 patsiendil (50%) kestis kõhulahtisus rohkem kui 28 päeva (need moodustasid 9,9% kõigist linaklotiidiga ravitud patsientidest). Viis protsenti patsientidest katkestas kliinilistes uuringutes ravi kõhulahtisuse tõttu. Kõhulahtisusest tingitult ravi katkestanud patsientidel taandus kõhulahtisus paari päeva jooksul pärast ravi katkestamist. Võrreldes kliinilistesse uuringutesse kaasatud soole ärritussündroomi kogupopulatsiooniga, teatasid kõhulahtisust sagedamini eakad (> 65 aastat vanad), hüpertensiooniga ja diabeediga patsiendid. Võimalikest kõrvaltoimetest teavitamine Ravimi võimalikest kõrvaltoimetest on oluline teavitada ka pärast ravimi müügiloa väljastamist. See võimaldab jätkuvalt hinnata ravimi kasu/riski suhet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest kõrvaltoimetest riikliku teavitamissüsteemi, mis on loetletud V lisas, kaudu. 5
6 4.9 Üleannustamine Üleannustamine võib põhjustada ravimi teadaolevate farmakodünaamiliste toimete võimendumisest tingitud sümptomeid, peamiselt kõhulahtisust. Tervetel vabatahtlikel läbiviidud uuringus, mille käigus manustati üksikannus 2897-mikrogramm (kuni 10 korda suurem soovitatavast raviannusest), oli patsientide ohutusprofiil kooskõlas üldpopulatsiooniga, sealjuures oli kõhulahtisus sagedaseim teatatud kõrvaltoime. Üleannustamisel peaks patsienti ravima sümptomaatiliselt ja vajadusel rakendama toetavaid meetmeid. 5. FARMAKOLOOGILISED OMADUSED 5.1 Farmakodünaamilised omadused Farmakoterapeutiline rühm: kõhukinnisuse vastased ained, teised kõhukinnisuse vastased ained, ATCkood: A06AX04 Toimemehhanism Linaklotiid on guanülaattsüklaas-c (GC-C) retseptori agonistide klassi esindaja, millel on siseelunditele analgeetiline toime ja ka sekretoorne toime. Linaklotiid on 14 aminohappest koosnev sünteetiline peptiid, mis on struktuurilt seotud endogeense guanüliinpeptiidide perekonnaga. Nii linaklotiid kui ka selle aktiivne metaboliit seonduvad GC-C retseptoriga seedetrakti epiteeli valendikupoolsel pinnal. On täheldatud, et oma mõju tõttu GC-C-le vähendab linaklotiid siseelundite valu ja suurendab seedetrakti läbitavust loommudelitel ning jämesoole läbitavust inimestel. GC-C aktiveerumise tulemus on tsüklilise guanosiinmonofosfaadi (cgmp) kontsentratsioonide suurenemine nii rakuväliselt kui ka -siseselt. Rakuväline cgmp vähendab valu juhtivate närvikiudude aktiivsust, leevendades tulemusena siseelundite valu loommudelitel. Aktiveerides tsüstilise fibroosi transmembraanse juhtivuse regulaatori (CFTR), põhjustab rakusisene cgmp kloriidi ja bikarbonaadi eritumise seedetrakti valendikku, mille tulemusel suureneb soolesisene vedeliku hulk ja kiireneb läbitavus. Farmakodünaamilised toimed Ristuva disainiga toidu koostoimeuuringus manustati 18 tervele uuringus osalejale 290 mikrogrammi Constellat 7 päeva jooksul kas tühja või täis kõhuga. Constella võtmine vahetult pärast kõrge rasvasisaldusega hommikusööki andis paastunud olekus võtmisega võrreldes tulemuseks sagedasemad ja vedelamad väljaheited ning põhjustas rohkem gastrointestinaalseid kõrvalnähte. Kliiniline efektiivsus ja ohutus Linaklotiidi efektiivsust tõestati kahes randomiseeritud topeltpimedas platseebokontrolliga 3. faasi kliinilises uuringus soole ärritussündroomiga patsientidel. Ühes kliinilises uuringus (uuring 1) raviti 802 patsienti 290 mikrogrammi Constella või platseeboga üks kord ööpäevas 26 nädala jooksul. Teises kliinilises uuringus (uuring 2) raviti 800 patsienti 12 nädalat ja seejärel randomiseeriti uuesti täiendavaks 4-nädalaseks raviperioodiks. 2-nädalase ravieelse algperioodi jooksul oli patsientide kõhuvalu keskmine skoor 5,6 (skaalal ), kõhuvaluta päevi oli 2,2%, keskmine kõhupuhituse skoor oli 6,6 (skaalal ) ja nädala keskmine spontaansete defekatsioonide (ing k spontaneous bowel movements, SBM) arv oli 1,8. 3. faasi kliinilistesse uuringutesse kaasatud patsientide lähteandmed olid järgmised: keskmine vanus oli 43,9 aastat [vahemikus aastat; 5,3% oli 65 aastased] ja 90,1% patsiente oli naissoost. Kõik patsiendid vastasid soole ärritussündroomi Rooma II kriteeriumidele ja olid kohustatud teatama, kui neil esines 2-nädalase algperioodi jooksul kõhuvalu, mis ületas numbrilisel punktisel skaalal skoori 3 (kriteerium on vastavuses mõõdukast kuni raske soole ärritussündroomi populatsiooniga), ja kui neil esines < 3 täielikku spontaanset defekatsiooni ja 5 SBM-i nädalas. 6
7 Mõlema kliinilise uuringu esmased kombineeritud tulemusnäitajad olid soole ärritussündroomi leevendusastme ravivastuse määr ning kõhuvalu/ebamugavustunde ravivastuse määr 12 nädalal. Soole ärritussündroomi leevenduse ravivastus saavutati, kui patsiendil leevenesid sümptomid oluliselt või täielikult vähemalt 50% raviperioodi ulatuses; kõhuvalu/ebamugavustunde ravivastusega patsient oli patsient, kelle sümptomid paranesid vähemalt 30% võrra vähemalt 50% raviperioodi ulatuses. 12 nädala andmete puhul näitab 1. uuring, et soole ärritussündroomi leevendusastme ravivastust sai täheldada 39%-l linaklotiidiga ravitud patsientidest võrreldes 17%-ga patsientidest, kes said platseebot (p < 0,0001), ning kõhuvalu/ebamugavustunde ravivastuse saavutas 54% linaklotiidiga ravitud patsientidest võrreldes 39%-ga patsientidest, kes said platseebot (p < 0,0001). 2. uuring näitab, et soole ärritussündroomi leevendusastme ravivastust sai täheldada 37%-l linaklotiidiga ravitud patsientidest võrreldes 19%-ga patsientidest, kes said platseebot (p < 0,0001), ning kõhuvalu/ebamugavustunde ravivastuse saavutas 55% linaklotiidiga ravitud patsientidest võrreldes 42%-ga patsientidest, kes said platseebot (p = 0,0002). 26 nädala andmete puhul näitab 1. uuring, et soole ärritussündroomi (p < 0,0001) ja kõhuvalu/ebamugavustunde leevendusastme ravivastust (p < 0,0001) sai täheldada vastavalt 37%-l ja 54%-l linaklotiidiga ravitud patsientidest võrreldes 17% ja 36%-ga patsientidest, kes said platseebot. Mõlemas uuringus täheldati neid tulemusi 1. nädalal ja need kestsid kogu raviperioodi vältel (joonised 1 ja 2). Kui ravi lõpetati pärast 3-kuulist pidevat ravi, täheldati, et linaklotiid ei põhjusta tagasilöögiefekti. Joonis 1. Soole ärritussündroomi (IBS) leevenduse ravivastus Fig. 1 IBS Degree of Relief Responder Joonis 2. Kõhuvalu/ebamugavustunde ravivastus Fig 2. Abdominal Pain/Discomfort Responder Ravivastusega Responders patsiendid (%) (%) * * * * * * p p-väärtus value < < 0,0001 * p * value p-väärtus < < 0,0001 * * * * * * * * * * * * * * * * * * 290 µg platseebo Ravivastusega Responders patsiendid (%) (%) * * 290 µg platseebo Uuringu Trial nädal Week Pooled Phase III Efficacy clinical studies (Study 1 and 2) III faasi kliiniliste uuringute koondandmed (uuring nr 1 ja nr 2) OC Approach (ITT Population) (ravikavatsuslik populatsioon) Uuringu Trial nädal Week III Pooled faasi kliiniliste Phase III uuringute Efficacy clinical koondandmed studies (Study (uuring 1 nr and 1 ja 2) nr 2) (ravikavatsuslik OC Approach (ITT populatsioon) Population) Soole ärritussündroomi teised tunnused ja sümptomid, sealhulgas puhitus, täieliku spontaanse defekatsiooni (ing k complete SBM, CSBM) sagedus, pingutamine ja väljaheite konsistents, paranesid linaklotiidiga ravitud patsientidel võrreldes platseebot saanud patsientidega (p < 0,0001) nagu on näidatud järgmises tabelis. Need toimed saavutati 1. nädalal ja kestsid kogu raviperioodi vältel. Linaklotiidi mõju soole ärritussündroomi sümptomitele ravi esimese 12 nädala jooksul ühendatud 3. faasi kliinilistes uuringutes (uuringud 1 ja 2). Peamised teisesed tulemusnäitajad Puhitus (NRS-il 11 punkti) Platseebo (N = 797) Algväärtus Keskmine 12 nädalat Keskmine Muutus algväärtuse suhtes Keskmine 7 Linaklotiid (N = 805) Algväärtus Keskmine 12 nädalat Keskmine Muutus algväärtuse suhtes Keskmine 6,5 5,4-1,0 6,7 4,6 1,9 0,9* LS-i keskmine erinevus platseebost
8 CSBM-i/nädalas 0,2 1,0 0,7 0,2 2,5 2,2 1,6* Väljaheite konsistents 2,3 3,0 0,6 2,3 4,4 2,0 1,4* (BSFS-i skoor) Pingutus (5- punktine järjestikskaala) 3,5 2,8 0,6 3,6 2,2 1,3 0,6* *p < 0,0001, linaklotiid vs. platseebo. LS: vähimruut CSBM: täielik spontaanne defekatsioon Ravi linaklotiidiga andis tulemuseks ka valideeritud ja haigusspetsiifilise elukvaliteedi määra olulise paranemise (IBS-QoL; p < 0,0001), ja EuroQoL (p = 0,001). Kliiniliselt olulise vastuse üldise IBS- QoL-i puhul (erinevus > 14 punkti) saavutas 54% linaklotiidiga ravitud patsientidest võrreldes 39% platseeboga ravitud patsientidega. Lapsed Euroopa Ravimiamet on peatanud kohustuse esitada Constellaga läbi viidud kliiniliste uuringute tulemused laste ühe või mitme alarühma kohta kroonilise idiopaatilise kõhukinnisuse korral (teave lastel kasutamise kohta vt lõik 4.2). 5.2 Farmakokineetilised omadused Imendumine Üldjuhul on linaklotiid pärast suukaudsete raviannuste manustamist vereplasmas minimaalselt tuvastatav, mistõttu ei saa arvutada standardseid farmakokineetika parameetreid. Pärast linaklotiidi kuni 966-mikrogrammiste üksikannuste ja kuni 290-mikrogrammiste mitmekordsete annuste manustamist ei olnud lähteaine ega aktiivse metaboliidi (destürosiin) tase plasmas tuvastatav mikrogrammi linaklotiidi manustamisel 8. päeval, pärast 7-päevast ravikuuri 290 mikrogrammiga ööpäevas, oli linaklotiid tuvastatav vaid 2 patsiendil 18-st, kusjuures kontsentratsioonid olid veidi üle määramise alampiiri 0,2 ng/ml (kontsentratsioonide vahemik oli 0, ,735 ng/ml). Kahes 3. faasi uuringus, milles patsientidele manustati 290 mikrogrammi linaklotiidi üks kord ööpäevas, tuvastati linaklotiidi vaid 2 patsiendil 162-st pärast ligikaudu 2 tunni möödumist linaklotiidi esimese annuse manustamisest (kontsentratsioonid olid 0,241 ng/ml kuni 0,239 ng/ml) ja mitte ühelgi 162 patsiendist pärast 4-nädalast ravi. Aktiivset metaboliiti ei tuvastatud ühelgi ajaperioodil ühelgi patsiendil 162-st. Jaotumine Kuna linaklotiid on raviannuste manustamise järgselt plasmas harva tuvastatav, ei ole standardseid jaotuvuse uuringuid läbi viidud. Eeldatavasti jaotub linaklotiid süsteemselt ebaolulisel hulgal või üldse mitte. Biotransformatsioon Linaklotiid metaboliseeritakse seedetraktis lokaalselt peamiseks aktiivseks metaboliidiks destürosiiniks. Nii linaklotiid kui ka aktiivne metaboliit destürosiin redutseeritakse ja proteolüüsitakse seedetraktis ensümaatiliselt väiksemateks peptiidideks ja looduslikeks aminohapeteks. Linaklotiidi ja selle peamise aktiivse metaboliidi MM potentsiaalset inhibeerivat toimet inimese väljavoolutransporteritele BCRP, MRP2, MRP3 ja MRP4 ning sissevoolutransporteritele OATP1B1, OATP1B3, OATP2B1, PEPT1 ja OCTN1 uuriti in vitro. Selle uuringu tulemused näitasid, et kumbki peptiid ei ole kliiniliselt oluliste kontsentratsioonide kasutamisel uuritud transporterite inhibiitor. Linaklotiidi ja selle metaboliitide toimet tavapäraste seedetraktiensüümide (CYP2C9 ja CYP3A4) ning maksaensüümide (CYP1A2, 2B6, 2C8, 2C9, 2C19, 2D6, 2E1 ja 3A4) inhibeerimisel või maksaensüümide (CYP1A2, 2B6 ja 3A4/5) indutseerimisel uuriti in vitro. Nende uuringute tulemused näitasid, et linaklotiid ja tema metaboliit destürosiin ei ole tsütokroom P450 ensüümsüsteemi inhibiitorid ega indutseerijad. 8
9 Eritumine Pärast linaklotiidi ühekordse suukaudse annuse 2897 mikrogrammi manustamist 8. päeval pärast 7- päevast ravi annusega 290 mikrogrammi/päevas 18 tervel vabatahtlikul, tuvastati väljaheites ligikaudu 3...5% annusest, millest praktiliselt kõik oli aktiivse metaboliidi destürosiinina. Vanus ja sugu Kliinilisi uuringuid vanuse ja soo mõju hindamise kohta linaklotiidi kliinilisele farmakokineetikale ei ole läbi viidud, kuna see on plasmas harva tuvastatav. Sugu ei oma eeldatavasti annustamisele mingit mõju. Vanust puudutava teabe saamiseks vt lõike 4.2, 4.4 ja 4.8. Neerukahjustus Constella kasutamist neerukahjustusega patsientidel ei ole uuritud. Linaklotiid on plasmas harva tuvastatav, mistõttu ei mõjuta neerukahjustus eeldatavalt lähteaine ega metaboliidi kliirensit. Maksakahjustus Constella kasutamist maksakahjustusega patsientidel ei ole uuritud. Linaklotiid on plasmas harva tuvastatav ja seda ei metaboliseeri maksa tsütokroomi P450 ensüümid, mistõttu ei mõjuta maksakahjustus eeldatavalt ravimi ega metaboliidi metabolismi ega kliirensit. 5.3 Prekliinilised ohutusandmed Farmakoloogilise ohutuse, korduvtoksilisuse, genotoksilisuse, kartsinogeensuse, reproduktsiooni- ja arengutoksilisuse mittekliinilised uuringud ei ole näidanud kahjulikku toimet inimesele. 6. FARMATSEUTILISED ANDMED 6.1 Abiainete loetelu Kapsli sisu Mikrokristalliline tselluloos Hüpromelloos 4 6 mpa s asendustüüp 2910 Kaltsiumkloriiddihüdraat Leutsiin Kapsli kest Titaandioksiid (E171) Želatiin Punane raudoksiid (E172) Kollane raudoksiid (E172) Kapsli tint Šellak Propüleenglükool Kontsentreeritud ammoniaagilahus Kaaliumhüdroksiid Titaandioksiid (E171) Must raudoksiid (E172) 6.2 Sobimatus Ei kohaldata. 9
10 6.3 Kõlblikkusaeg Avamata pudel, milles on 28 või 90 kapslit, ja multipakk, milles on 112 kapslit (neli 28 kapsliga pakendit): 3 aastat. Avamata pudel, milles on 10 kapslit: 24 kuud. Pärast esmast avamist: 18 nädalat. 6.4 Säilitamise eritingimused Hoida temperatuuril kuni 30 ºC. Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. Pudel sisaldab üht või enamat niiskust imavat silikageeli sisaldavat suletud pakendit, et hoida kapsleid kuivana. Hoidke niiskust imavaid pakendeid pudelis. 6.5 Pakendi iseloomustus ja sisu Valge suure tihedusega polüetüleenist (HDPE) pudel pitseeritud, lapsekindla korgiga koos ühe või enama silikageeli sisaldava niiskust imava pakendiga. Pakendi suurused: 10, 28, või 90 kapslit ning mitmikpakendid, milles on 112 kapslit (neli 28 kapsliga pudelit). Kõik pakendi suurused ei pruugi olla müügil. 6.6 Erihoiatused ravimpreparaadi hävitamiseks Kasutamata ravimpreparaat või jäätmematerjal tuleb hävitada vastavalt kohalikele nõuetele. 7. MÜÜGILOA HOIDJA Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa 8. MÜÜGILOA NUMBER (NUMBRID) EU/1/12/801/001 EU/1/12/801/002 EU/1/12/801/004 EU/1/12/801/ ESMASE MÜÜGILOA VÄLJASTAMISE/MÜÜGILOA UUENDAMISE KUUPÄEV Müügiloa esmase väljastamise kuupäev: 26. november 2012 Müügiloa viimase uuendamise kuupäev: 10. TEKSTI LÄBIVAATAMISE KUUPÄEV Täpne teave selle ravimpreparaadi kohta on Euroopa Ravimiameti kodulehel: 10
11 II LISA A. RAVIMIPARTII KASUTAMISEKS VABASTAMISE EEST VASTUTAV TOOTJA B. HANKE- JA KASUTUSTINGIMUSED VÕI PIIRANGUD C. MÜÜGILOA MUUD TINGIMUSED JA NÕUDED D. RAVIMPREPARAADI OHUTU JA EFEKTIIVSE KASUTAMISE TINGIMUSED JA PIIRANGUD 11
12 A. RAVIMIPARTII KASUTAMISEKS VABASTAMISE EEST VASTUTAV TOOTJA Ravimipartii kasutamiseks vabastamise eest vastutava tootja nimi ja aadress Industrias Farmacéuticas Almirall, S.A. Ctra. Nacional II, Km Sant Andreu de la Barca Barcelona Hispaania B. HANKE- JA KASUTUSTINGIMUSED VÕI PIIRANGUD Retseptiravim. C. MÜÜGILOA MUUD TINGIMUSED JA NÕUDED Perioodilised ohutusaruanded Nõuded asjaomase ravimi perioodiliste ohutusaruannete esitamiseks on sätestatud direktiivi 2001/83/EÜ artikli 107c punkti 7 kohaselt liidu kontrollpäevade loetelus (EURD loetelu) ja iga hilisem uuendus avaldatakse Euroopa ravimite veebiportaalis. D. RAVIMPREPARAADI OHUTU JA EFEKTIIVSE KASUTAMISE TINGIMUSED JA PIIRANGUD Riskijuhtimiskava Müügiloa hoidja peab nõutavad ravimiohutuse toimingud ja sekkumismeetmed läbi viima vastavalt müügiloa taotluse moodulis esitatud kokkulepitud riskijuhtimiskavale ja mis tahes järgmistele ajakohastatud riskijuhtimiskavadele. Ajakohastatud riskijuhtimiskava tuleb esitada: Euroopa Ravimiameti nõudel; kui muudetakse riskijuhtimissüsteemi, eriti kui saadakse uut teavet, mis võib oluliselt mõjutada riski/kasu suhet, või kui saavutatakse oluline (ravimiohutuse või riski minimeerimise) eesmärk. 12
13 III LISA PAKENDI MÄRGISTUS JA INFOLEHT 13
14 A. PAKENDI MÄRGISTUS 14
15 VÄLISPAKENDIL PEAVAD OLEMA JÄRGMISED ANDMED ÜHTE PUDELIT SISALDAV KARP 1. RAVIMPREPARAADI NIMETUS Constella 290 mikrogrammi kõvakapslid linaklotiid 2. TOIMEAINE(TE) SISALDUS Iga kapsel sisaldab 290 mikrogrammi linaklotiidi. 3. ABIAINED 4. RAVIMVORM JA PAKENDI SUURUS Kõvakapsel 10 kapslit 28 kapslit 90 kapslit 5. MANUSTAMISVIIS JA -TEE(D) Enne ravimi kasutamist lugege pakendi infolehte. Suukaudne. 6. ERIHOIATUS, ET RAVIMIT TULEB HOIDA LASTE EEST VARJATUD JA KÄTTESAAMATUS KOHAS Hoida laste eest varjatud ja kättesaamatus kohas. 7. TEISED ERIHOIATUSED (VAJADUSEL) 8. KÕLBLIKKUSAEG Kõlblik kuni: Pärast avamist kasutada 18 nädala jooksul. 9. SÄILITAMISE ERITINGIMUSED Hoida temperatuuril kuni 30 ºC. Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. 15
16 10. ERINÕUDED KASUTAMATA JÄÄNUD RAVIMPREPARAADI VÕI SELLEST TEKKINUD JÄÄTMEMATERJALI HÄVITAMISEKS, VASTAVALT VAJADUSELE 11. MÜÜGILOA HOIDJA NIMI JA AADRESS Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa 12. MÜÜGILOA NUMBER (NUMBRID) EU/1/12/801/ kapslit EU/1/12/801/ kapslit EU/1/12/801/ kapslit 13. PARTII NUMBER Partii nr: 14. RAVIMI VÄLJASTAMISTINGIMUSED Retseptiravim 15. KASUTUSJUHEND 16. TEAVE BRAILLE KIRJAS (PUNKTKIRJAS) constella 290 µg 17. AINULAADNE IDENTIFIKAATOR 2D-vöötkood Lisatud on 2D-vöötkood, mis sisaldab ainulaadset identifikaatorit. 18. AINULAADNE IDENTIFIKAATOR INIMLOETAVAD ANDMED PC: SN: NN: 16
17 VÄLISPAKENDIL PEAVAD OLEMA JÄRGMISED ANDMED NELJA 28 KAPSLIGA PUDELIT SISALDAV VÄLISKARP (MULTIPAKK) SINISE RAAMIGA 1. RAVIMPREPARAADI NIMETUS Constella 290 mikrogrammi kõvakapslid linaklotiid 2. TOIMEAINE(TE) SISALDUS Iga kapsel sisaldab 290 mikrogrammi linaklotiidi. 3. ABIAINED 4. RAVIMVORM JA PAKENDI SUURUS Kõvakapsel Mitmikpakend: 112 kapslit (neli 28 kapsliga pudelit) 5. MANUSTAMISVIIS JA -TEE(D) Enne ravimi kasutamist lugege pakendi infolehte. Suukaudne. 6. ERIHOIATUS, ET RAVIMIT TULEB HOIDA LASTE EEST VARJATUD JA KÄTTESAAMATUS KOHAS Hoida laste eest varjatud ja kättesaamatus kohas. 7. TEISED ERIHOIATUSED (VAJADUSEL) 8. KÕLBLIKKUSAEG Kõlblik kuni: Pärast avamist kasutada 18 nädala jooksul. 9. SÄILITAMISE ERITINGIMUSED Hoida temperatuuril kuni 30 ºC. Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. 17
18 10. ERINÕUDED KASUTAMATA JÄÄNUD RAVIMPREPARAADI VÕI SELLEST TEKKINUD JÄÄTMEMATERJALI HÄVITAMISEKS, VASTAVALT VAJADUSELE 11. MÜÜGILOA HOIDJA NIMI JA AADRESS Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa 12. MÜÜGILOA NUMBER (NUMBRID) EU/1/12/801/005 mitmikpakend: 112 kapslit (neli 28 kapsliga pudelit) 13. PARTII NUMBER Partii nr: 14. RAVIMI VÄLJASTAMISTINGIMUSED Retseptiravim 15. KASUTUSJUHEND 16. TEAVE BRAILLE KIRJAS (PUNKTKIRJAS) constella 290 µg 17. AINULAADNE IDENTIFIKAATOR 2D-vöötkood Lisatud on 2D-vöötkood, mis sisaldab ainulaadset identifikaatorit. 18. AINULAADNE IDENTIFIKAATOR INIMLOETAVAD ANDMED PC: SN: NN: 18
19 VÄLISPAKENDIL PEAVAD OLEMA JÄRGMISED ANDMED ÜHTE 28 KAPSLIGA PUDELIT SISALDAV SISEKARP (MITMIKPAKEND) ILMA SINISE RAAMITA 1. RAVIMPREPARAADI NIMETUS Constella 290 mikrogrammi kõvakapslid linaklotiid 2. TOIMEAINE(TE) SISALDUS Iga kapsel sisaldab 290 mikrogrammi linaklotiidi. 3. ABIAINED 4. RAVIMVORM JA PAKENDI SUURUS Kõvakapsel 28 kapslit. Multipaki osa, mida ei saa eraldi müüa. 5. MANUSTAMISVIIS JA -TEE(D) Enne ravimi kasutamist lugege pakendi infolehte. Suukaudne. 6. ERIHOIATUS, ET RAVIMIT TULEB HOIDA LASTE EEST VARJATUD JA KÄTTESAAMATUS KOHAS Hoida laste eest varjatud ja kättesaamatus kohas. 7. TEISED ERIHOIATUSED (VAJADUSEL) 8. KÕLBLIKKUSAEG Kõlblik kuni: Pärast avamist kasutada 18 nädala jooksul. 9. SÄILITAMISE ERITINGIMUSED Hoida temperatuuril kuni 30 ºC. Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. 19
20 10. ERINÕUDED KASUTAMATA JÄÄNUD RAVIMPREPARAADI VÕI SELLEST TEKKINUD JÄÄTMEMATERJALI HÄVITAMISEKS, VASTAVALT VAJADUSELE 11. MÜÜGILOA HOIDJA NIMI JA AADRESS Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa 12. MÜÜGILOA NUMBER (NUMBRID) EU/1/12/801/005 mitmikpakend: 112 kapslit (neli 28 kapsliga pudelit) 13. PARTII NUMBER Partii nr: 14. RAVIMI VÄLJASTAMISTINGIMUSED Retseptiravim 15. KASUTUSJUHEND 16. TEAVE BRAILLE KIRJAS (PUNKTKIRJAS) constella 290 µg 17. AINULAADNE IDENTIFIKAATOR 2D-vöötkood 18. AINULAADNE IDENTIFIKAATOR INIMLOETAVAD ANDMED 20
21 SISEPAKENDIL PEAVAD OLEMA JÄRGMISED ANDMED PUDEL 1. RAVIMPREPARAADI NIMETUS Constella 290 mcg kõvakapslid linaklotiid 2. TOIMEAINE(TE) SISALDUS Iga kapsel sisaldab 290 mikrogrammi linaklotiidi. 3. ABIAINED 4. RAVIMVORM JA PAKENDI SUURUS Kõvakapsel 10 kapslit 28 kapslit 90 kapslit 5. MANUSTAMISVIIS JA -TEE(D) Enne ravimi kasutamist lugege pakendi infolehte. Suukaudne. 6. ERIHOIATUS, ET RAVIMIT TULEB HOIDA LASTE EEST VARJATUD JA KÄTTESAAMATUS KOHAS Hoida laste eest varjatud ja kättesaamatus kohas. 7. TEISED ERIHOIATUSED (VAJADUSEL) 8. KÕLBLIKKUSAEG Kõlblik kuni: Pärast avamist kasutada 18 nädala jooksul. 9. SÄILITAMISE ERITINGIMUSED Hoida temperatuuril kuni 30 ºC Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. 21
22 10. ERINÕUDED KASUTAMATA JÄÄNUD RAVIMPREPARAADI VÕI SELLEST TEKKINUD JÄÄTMEMATERJALI HÄVITAMISEKS, VASTAVALT VAJADUSELE 11. MÜÜGILOA HOIDJA NIMI JA AADRESS Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa 12. MÜÜGILOA NUMBER (NUMBRID) EU/1/12/801/ kapslit EU/1/12/801/ kapslit EU/1/12/801/ kapslit EU/1/12/801/005 multipakk: 112 kapslit (neli 28 kapsliga pudelit) 13. PARTII NUMBER Partii nr: 14. RAVIMI VÄLJASTAMISTINGIMUSED Retseptiravim 15. KASUTUSJUHEND 16. TEAVE BRAILLE KIRJAS (PUNKTKIRJAS) 17. AINULAADNE IDENTIFIKAATOR 2D-vöötkood 18. AINULAADNE IDENTIFIKAATOR INIMLOETAVAD ANDMED 22
23 B. PAKENDI INFOLEHT 23
24 Pakendi infoleht: teave patsiendile Constella 290 mikrogrammi kõvakapslid linaklotiid Enne ravimi kasutamist lugege hoolikalt infolehte, sest siin on teile vajalikku teavet. - Hoidke infoleht alles, et seda vajadusel uuesti lugeda. - Kui teil on lisaküsimusi, pidage nõu oma arsti või apteekriga. - Ravim on välja kirjutatud üksnes teile. Ärge andke seda kellelegi teisele. Ravim võib olla neile kahjulik, isegi kui haigusnähud on sarnased. - Kui teil tekib ükskõik milline kõrvaltoime, pidage nõu oma arsti või apteekriga. Kõrvaltoime võib olla ka selline, mida selles infolehes ei ole nimetatud. Vt lõik 4. Infolehe sisukord 1. Mis ravim on Constella ja milleks seda kasutatakse 2. Mida on vaja teada enne Constella võtmist 3. Kuidas Constellat võtta 4. Võimalikud kõrvaltoimed 5. Kuidas Constellat säilitada 6. Pakendi sisu ja muu teave 1. Mis ravim on Constella ja milleks seda kasutatakse Milleks Constellat kasutatakse Constella sisaldab toimeainet linaklotiidi. Seda kasutatakse kõhukinnisusega kulgeva mõõduka kuni raske soole ärritussündroomi sümptomite raviks täiskasvanud patsientidel. Soole ärritussündroom on sage seedetrakti haigus. Kõhukinnisusega kulgeva soole ärritussündroomi peamised sümptomid on: mao- või kõhuvalu; puhitustunne; harvad kõvad väikesed või pabulataolised väljaheited (faeces). Need sümptomid võivad inimestel erineda. Kuidas Constella toimib Constella toimib lokaalselt teie seedetraktis, aidates vähendada valu ja alandada puhitust ning taastada soolestiku normaalset funktsiooni. See ei imendu organismi, vaid kinnitub seedetrakti pinnal oleva retseptori külge. Seda retseptorit nimetatakse guanülaattsüklaas-c-ks. Ravim blokeerib sellele retseptorile kinnitumisega valuaistingu ja võimaldab vedelikul organismist seedetrakti siseneda, soodustades seeläbi rooja väljutamist ning aktiveerides soolestiku funktsiooni. 2. Mida on vaja teada enne Constella võtmist Ärge võtke Constellat: - kui olete linaklotiidi või selle ravimi mis tahes koostisosa(de) (loetletud lõigus 6) suhtes allergiline; - kui teie või teie arst teab, et teie maos või soolestikus esineb sulgus. 24
25 Hoiatused ja ettevaatusabinõud Teie arst on teile selle ravimi määranud pärast teiste haiguste, eriti seedetrakti häirete välistamist ning veendumist selles, et kannatate kõhukinnisusega soole ärritussündroomi all. Kuna teistel haigustel võivad olla samasugused sümptomid kui soole ärritussündroomil, on oluline, et teavitaksite arsti viivitamatult mis tahes muudatustest sümptomites või nende ebaregulaarsusest. Kui teil esineb raske või pikaajaline kõhulahtisus (sagedased vesised väljaheited 7 päeva jooksul või kauem), lõpetage palun Constella võtmine ja võtke ühendust oma arstiga (vt lõik 4). Kõhulahtisusest tuleneva vedeliku ja elektrolüütide (nt kaaliumi) kao kompenseerimiseks jooge palju vedelikku. Rääkige oma arstiga, kui teil esineb veritsust seedetraktist või pärasoolest. Kui olete üle 65-aastane, olge eriti ettevaatlik, sest kõhulahtisuse tekkimise oht on suurem. Olge eriti ettevaatlik ka siis, kui teil on raske või pikaajaline kõhulahtisus ja te kannatate veel mõne haiguse (näiteks kõrge vererõhu) all, teil on varem olnud südame või veresoontega seotud haigus (näiteks varasem südameinfarkt) või teil on diabeet. Rääkige oma arstiga, kui teil on põletikuline soolehaigus (näiteks Crohni tõbi või haavandiline koliit), sest Constella ei ole neile patsientidele soovitatav. Lapsed ja noorukid Ärge andke seda ravimit lastele ja alla 18-aastastele noorukitele, kuna Constella ohutus ja efektiivsus selles vanusegrupis pole tõestatud. Muud ravimid ja Constella Teatage oma arstile või apteekrile, kui te võtate või olete hiljuti võtnud või kavatsete võtta mis tahes muid ravimeid. Raskekujuline või pikaajaline kõhulahtisus võib mõjutada mõne allpool loetletud ravimi toimimist: - Suukaudsed rasestumisvastased vahendid. Kui teil on raskekujuline kõhulahtisus, ei pruugi rasestumisvastane tablett efektiivselt toimida ning soovituslik on rasestumisvastase lisameetodi kasutamine. Vaadake rasestumisvastase tableti pakendi infolehel toodud instruktsioone. - Ravimid, mis vajavad hoolikat ja täpset doseerimist, näiteks levotüroksiin (hormoon, millega ravitakse kilpnäärme alatalitlust). Mõni ravim võib koos Constellaga võtmisel suurendada kõhulahtisuse ohtu, nt: - ravimid, mida nimetatakse prootonpumba inhibiitoriteks ja mida kasutatakse maohaavandite või liigse maohappe ravis. - valu ja põletiku ravis kasutatavad mittesteroidsed põletikuvastased ravimid. - lahtistid. Constella koos toiduga Toiduga võtmisel põhjustab Constella sagedasemaid defekatsioone ja kõhulahtisust (vedelamaid väljaheiteid) võrreldes manustamisega tühjale kõhule (vt lõik 3). Rasedus ja imetamine Teave Constella toime kohta rasedatele ja imetavatele naistele on piiratud. Ärge võtke seda ravimit, kui te olete rase, arvate end olevat rase või kavatsete rasestuda, välja arvatud juhul, kui teie arst seda soovitab. Kui imetate, siis võtke Constellat ainult siis, kui teie arst seda soovitab. Autojuhtimine ja masinatega töötamine Constellal puudub toime teie autojuhtimise ja masinate käsitsemise võimele. 25
26 3. Kuidas Constellat võtta Võtke seda ravimit alati täpselt nii, nagu arst on teile selgitanud. Kui te ei ole milleski kindel, pidage nõu oma arsti või apteekriga. Soovitatav annus on üks kapsel (st 290 mikrogrammi linaklotiidi) suu kaudu üks kord ööpäevas. Kapsel tuleb võtta vähemalt 30 minutit enne sööki. Kui sümptomid ei ole pärast nelja ravinädalat leevendunud, konsulteerige arstiga. Kui te võtate Constellat rohkem kui ette nähtud Constella ettenähtust suurema annuse võtmise kõige tõenäolisem toime on kõhulahtisus. Kui olete võtnud seda ravimit liiga palju, võtke ühendust oma arsti või apteekriga. Kui te unustate Constellat võtta Ärge võtke kahekordset annust, kui annus jäi eelmisel korral võtmata. Võtke lihtsalt järgmine annus ettenähtud ajal ja jätkake tavapärase skeemi järgi. Kui te lõpetate Constella võtmise Enne ravi lõpetamist on soovitatav seda oma arstiga arutada. Siiski võib ravi Constellaga mis tahes ajal ohutult lõpetada. Kui teil on lisaküsimusi selle ravimi kasutamise kohta, pidage nõu oma arsti või apteekriga. 4. Võimalikud kõrvaltoimed Nagu kõik ravimid, võib ka see ravim põhjustada kõrvaltoimeid, kuigi kõigil neid ei teki. Väga sageli kõrvaltoimed (võivad esineda enam kui 1 inimesel 10-st) Kõhulahtisus Kõhulahtisus on tavaliselt lühiajaline; kui teil aga tekib raske või pikaajaline kõhulahtisus (sagedased või vesised väljaheited 7 päeva jooksul või kauem) ja tunnete peapööritust, uimasust või minestate, lõpetage Constella võtmine ja võtke ühendust oma arstiga. Sageli esinevad kõrvaltoimed (võivad esineda kuni 1 inimesel 10-st) Mao- või kõhuvalu Puhitustunne Kõhugaasid Kõhugripp (viraalne gastroenteriit) Peapööritustunne Aeg-ajalt esinevad kõrvaltoimed (võivad esineda kuni 1 inimesel 100-st) Kontrollimatu ja spontaanne rooja väljutamine (roojapidamatus) Roojapakitsus Pearinglus pärast püstitõusmist Vedelikupuudus Madal kaaliumitase veres Söögiisu vähenemine Veritsus pärakust Verejooks seedetraktist või pärasoolest, k.a hemorroidide veritsus Iiveldus Oksendamine 26
27 Harva esinevad kõrvaltoimed (võivad esineda kuni 1 inimesel 1000-st) Bikarbonaadi taseme vähenemine veres Teadmata esinemissagedusega kõrvaltoimed (esinemissagedust ei saa hinnata olemasolevate andmete alusel) Lööve Kõrvaltoimetest teavitamine Kui teil tekib ükskõik milline kõrvaltoime, pidage nõu oma arsti või apteekriga. Kõrvaltoime võib olla ka selline, mida selles infolehes ei ole nimetatud. Kõrvaltoimetest võite ka ise teavitada riikliku teavitussüsteemi, mis on loetletud V lisas, kaudu. Teavitades aitate saada rohkem infot ravimi ohutusest. 5. Kuidas Constellat säilitada Hoidke seda ravimit laste eest varjatud ja kättesaamatus kohas. Ärge kasutage seda ravimit pärast kõlblikkusaega, mis on märgitud karbil ja pudelil pärast Kõlblik kuni:. Kõlblikkusaeg viitab selle kuu viimasele päevale. Pärast pudeli avamist tuleb kapslid ära kasutada 18 nädala jooksul. Hoida temperatuuril kuni 30 ºC. Hoida pudel tihedalt suletuna, niiskuse eest kaitstult. Hoiatus. Pudel sisaldab üht või enamat niiskust imavat silikageeli sisaldavat suletud pakendit, et hoida kapsleid kuivana. Hoidke niiskust imavaid pakendeid pudelis. Ärge neid alla neelake. Ärge kasutage seda ravimit, kui täheldate pudelil kahjustust või mis tahes muutust kapslite välimuses. Ärge visake ravimeid kanalisatsiooni ega olmejäätmete hulka. Küsige oma apteekrilt, kuidas visata ära ravimeid, mida te enam ei kasuta. Need meetmed aitavad kaitsta keskkonda. 6. Pakendi sisu ja muu teave Mida Constella sisaldab - Toimeaine on linaklotiid. Iga kapsel sisaldab 290 mikrogrammi linaklotiidi. - Teised koostisosad on: Kapsli sisu: mikrokristalliline tselluloos, hüpromelloos, kaltsiumkloriiddihüdraat ja leutsiin. Kapsli kest: punane raudoksiid (E172), titaandioksiid (E171), kollane raudoksiid (E172) ja želatiin. Trükitint: šellak, propüleenglükool, kontsentreeritud ammoniaagilahus, kaaliumhüdroksiid, titaandioksiid (E171) ja must raudoksiid (E172). Kuidas Constella välja näeb ja pakendi sisu Kapslid on valged, kollakasvalged kuni oranžid läbipaistmatud kõvakapslid, millele on halli tindiga märgistus 290. Need on pakitud valgesse suure tihedusega polüetüleenist (HDPE) pudelisse, millel on pitseeritud lapsekindel keeratav kork, koos ühe või enama silikageeli sisaldava niiskust imava pakendiga. 27
28 Constella on saadaval pakendites, mis sisaldavad 10, 28või 90 kapslit, ning multipakkides, milles on neli 28 kapsliga pudelit ehk kokku 112 kapslit. Kõik pakendi suurused ei pruugi olla müügil. Müügiloa hoidja Allergan Pharmaceuticals International Limited Clonshaugh Industrial Estate Coolock Dublin 17 Iirimaa Tootja Industrias Farmacéuticas Almirall, S.A. Ctra. Nacional II, Km. 593, E Sant Andreu de la Barca, Barcelona Hispaania Lisaküsimuste tekkimisel selle ravimi kohta pöörduge palun müügiloa hoidja kohaliku esindaja poole: België/Belgique/Belgien Allergan n.v Tél/Tel: +32 (0) България Алерган България ЕООД Тел.: +359 (0) Česká republika Allergan CZ s.r.o. Tel: Danmark Allergan Norden AB Tlf/Puh/Tel: + 46 (0) Deutschland Pharm-Allergan GmbH Tel: Eesti Allergan Baltics UAB Tel: Ελλάδα Allergan Hellas Pharmaceuticals S.A. Τηλ: España Allergan S.A. Tel: France Allergan France SAS Tél: +33 (0) Hrvatska Ewopharma d.o.o. Tel: Lietuva Allergan Baltics UAB Tel: Luxembourg/Luxemburg/ Nederland Allergan n.v Tél/Tel: +32 (0) Magyarország Allergan Hungary Kft. Tel.: Ireland/Malta/ United Kingdom Allergan Ltd Tel: + 44 (0) Nederland Allergan n.v Tél/Tel: +32 (0) Norge Allergan Norden AB Tlf/Puh/Tel: + 46 (0) Österreich Pharm-Allergan GmbH Tel: Polska Allergan Sp. z o.o. Tel: Portugal Profarin Lda. Tel: România Allergan S.R.L. Tel:
29 Ireland Allergan Ltd Tel: + 44 (0) Ísland Actavis ehf. Sími: Italia Allergan S.p.A Tel: Κύπρος Allergan Hellas Pharmaceuticals S.A. Τηλ: Latvija Allergan Baltics UAB Tel: Slovenija Ewopharma d.o.o. Tel: (0) Slovenská republika Allergan SK s.r.o. Tel: Suomi/Finland Allergan Norden AB Tlf/Puh/Tel: + 46 (0) Sverige Allergan Norden AB Tlf/Puh/Tel: + 46 (0) United Kingdom Allergan Ltd Tel: + 44 (0) Infoleht on viimati uuendatud Muud teabeallikad Täpne teave selle ravimi kohta on Euroopa Ravimiameti kodulehel: 29
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE
 PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Montelukast Portfarma 10 mg õhukese polümeerikattega tabletid Täiskasvanutele ja alates 15-aastastele noorukitele Montelukast Enne ravimi kasutamist lugege hoolikalt
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Montelukast Portfarma 10 mg õhukese polümeerikattega tabletid Täiskasvanutele ja alates 15-aastastele noorukitele Montelukast Enne ravimi kasutamist lugege hoolikalt
Pakendi infoleht: teave kasutajale
 Pakendi infoleht: teave kasutajale Adalat Oros 20 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros 30 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros 60 mg toimeainet prolongeeritult
Pakendi infoleht: teave kasutajale Adalat Oros 20 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros 30 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros 60 mg toimeainet prolongeeritult
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE. Montelukast Orion, 10 mg tabletid Montelukast Täiskasvanutele ja noorukitele alates 15 aasta vanusest
 PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Montelukast Orion, 10 mg tabletid Montelukast Täiskasvanutele ja noorukitele alates 15 aasta vanusest Enne ravimi võtmist lugege hoolikalt infolehte. - Hoidke
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Montelukast Orion, 10 mg tabletid Montelukast Täiskasvanutele ja noorukitele alates 15 aasta vanusest Enne ravimi võtmist lugege hoolikalt infolehte. - Hoidke
RAVIMI OMADUSTE KOKKUVÕTE. Toimeainet prolongeeritult vabastav tablett sisaldab 20, 30 või 60 mg nifedipiini. INN. Nifedipinum
 RAVIMI OMADUSTE KOKKUVÕTE 1. RAVIMPREPARAADI NIMETUS Adalat Oros, 20 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros, 30 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros, 60
RAVIMI OMADUSTE KOKKUVÕTE 1. RAVIMPREPARAADI NIMETUS Adalat Oros, 20 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros, 30 mg toimeainet prolongeeritult vabastavad tabletid Adalat Oros, 60
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE. Cardace Comp, 2,5 mg/12,5 mg tabletid Cardace Plus, 5 mg/25 mg tabletid Ramipriil/hüdroklorotiasiid
 PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Cardace Comp, 2,5 mg/12,5 mg tabletid Cardace Plus, 5 mg/25 mg tabletid Ramipriil/hüdroklorotiasiid Enne ravimi võtmist lugege hoolikalt infolehte Hoidke infoleht
PAKENDI INFOLEHT: INFORMATSIOON KASUTAJALE Cardace Comp, 2,5 mg/12,5 mg tabletid Cardace Plus, 5 mg/25 mg tabletid Ramipriil/hüdroklorotiasiid Enne ravimi võtmist lugege hoolikalt infolehte Hoidke infoleht
I LISA RAVIMI OMADUSTE KOKKUVÕTE. Ravimil on müügiluba lõppenud
 I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest
I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 Käesoleva ravimi suhtes kohaldatakse täiendavat järelevalvet, mis võimaldab kiiresti tuvastada uut ohutusteavet. Tervishoiutöötajatel palutakse teavitada kõigist võimalikest
I LISA RAVIMI OMADUSTE KOKKUVÕTE
 I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 1. RAVIMPREPARAADI NIMETUS Ribavirin Teva Pharma B.V. 200 mg õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS Üks Ribavirin Teva Pharma B.V.
I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 1. RAVIMPREPARAADI NIMETUS Ribavirin Teva Pharma B.V. 200 mg õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS Üks Ribavirin Teva Pharma B.V.
RAVIMI OMADUSTE KOKKUVÕTE
 RAVIMI OMADUSTE KOKKUVÕTE 1. RAVIMPREPARAADI NIMETUS Prestarium Arginine 5mg, õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS Perindopriilarginiin. Üks õhukese polümeerikattega
RAVIMI OMADUSTE KOKKUVÕTE 1. RAVIMPREPARAADI NIMETUS Prestarium Arginine 5mg, õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS Perindopriilarginiin. Üks õhukese polümeerikattega
RAVIMI OMADUSTE KOKKUVÕTE
 1. RAVIMPREPARAADI NIMETUS RAVIMI OMADUSTE KOKKUVÕTE RANISAN 75 mg, õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS 1 õhukese polümeerikattega tablett sisaldab 84 mg ranitidiinvesinikkloriidi,
1. RAVIMPREPARAADI NIMETUS RAVIMI OMADUSTE KOKKUVÕTE RANISAN 75 mg, õhukese polümeerikattega tabletid 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS 1 õhukese polümeerikattega tablett sisaldab 84 mg ranitidiinvesinikkloriidi,
I LISA RAVIMI OMADUSTE KOKKUVÕTE
 I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 1. RAVIMPREPARAADI NIMETUS Xeloda 150 mg õhukese polümeerikattega tabletid. Xeloda 500 mg õhukese polümeerikattega tabletid. 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
I LISA RAVIMI OMADUSTE KOKKUVÕTE 1 1. RAVIMPREPARAADI NIMETUS Xeloda 150 mg õhukese polümeerikattega tabletid. Xeloda 500 mg õhukese polümeerikattega tabletid. 2. KVALITATIIVNE JA KVANTITATIIVNE KOOSTIS
Pakningsvedlegg: Informasjon til brukeren. Vyndaqel 20 mg myke kapsler Tafamidis
 Pakningsvedlegg: Informasjon til brukeren Vyndaqel 20 mg myke kapsler Tafamidis Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved
Pakningsvedlegg: Informasjon til brukeren Vyndaqel 20 mg myke kapsler Tafamidis Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved
Eksamen 19.05.2014. FSP5936/PSP5590 Estisk nivå I Elevar og privatistar / Elever og privatister. http://eksamensarkiv.net/ Nynorsk/Bokmål
 Eksamen 19.05.2014 FSP5936/PSP5590 Estisk nivå I Elevar og privatistar / Elever og privatister Nynorsk/Bokmål Oppgåve 1 Svar på spørsmålet nedanfor med fem seks setningar på estisk. Mida sa tegid eelmisel
Eksamen 19.05.2014 FSP5936/PSP5590 Estisk nivå I Elevar og privatistar / Elever og privatister Nynorsk/Bokmål Oppgåve 1 Svar på spørsmålet nedanfor med fem seks setningar på estisk. Mida sa tegid eelmisel
Imaginaarühik. Reaalarvude vallas ei ole igal võrrandil lahendit. Näiteks puudub lahend ruutvõrrandil (1)
 Kompleksarvud Imaginaarühik Reaalarvude vallas ei ole igal võrrandil lahendit. Näiteks puudub lahend ruutvõrrandil x 0. Et oleks võimalik lahendada iga ruutvõrrandit, on kasutusele võetud imaginaarühik,
Kompleksarvud Imaginaarühik Reaalarvude vallas ei ole igal võrrandil lahendit. Näiteks puudub lahend ruutvõrrandil x 0. Et oleks võimalik lahendada iga ruutvõrrandit, on kasutusele võetud imaginaarühik,
Pakningsvedlegg: informasjon til pasienten. Aerius 0,5 mg/ml mikstur, oppløsning desloratadin
 Pakningsvedlegg: informasjon til pasienten Aerius 0,5 mg/ml mikstur, oppløsning desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: informasjon til pasienten Aerius 0,5 mg/ml mikstur, oppløsning desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Santen Oy B. PAKNINGSVEDLEGG
 B. PAKNINGSVEDLEGG 18 Pakningsvedlegg: Informasjon til pasienten IKERVIS 1 mg/ml øyedråper, emulsjon ciklosporin (ciclosporin) Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
B. PAKNINGSVEDLEGG 18 Pakningsvedlegg: Informasjon til pasienten IKERVIS 1 mg/ml øyedråper, emulsjon ciklosporin (ciclosporin) Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: informasjon til pasienten. Aerius 0,5 mg/ml mikstur, oppløsning desloratadin
 Pakningsvedlegg: informasjon til pasienten Aerius 0,5 mg/ml mikstur, oppløsning desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: informasjon til pasienten Aerius 0,5 mg/ml mikstur, oppløsning desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren. Bridion 100 mg/ml injeksjonsvæske, oppløsning sugammadex
 Pakningsvedlegg: Informasjon til brukeren Bridion 100 mg/ml injeksjonsvæske, oppløsning sugammadex Les nøye gjennom dette pakningsvedlegget før dette legemidlet blir gitt til deg. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren Bridion 100 mg/ml injeksjonsvæske, oppløsning sugammadex Les nøye gjennom dette pakningsvedlegget før dette legemidlet blir gitt til deg. Det inneholder informasjon
VELUX INTEGRA FMK / FMG
 VELUX INTEGRA FMK / FMG VAS 454262-2018-01 4 VELUX 24 VELUX KUX 100 1 2 VELUX 5 L R VELUX 25 CVP FMK / FMK-R FMG / FMG-R FMK-R FMG-R 1 452015-2013-02 13 EN 1873:2005 CVP XXXXXX XXXXXX XXXXXXXX Pages 4-22
VELUX INTEGRA FMK / FMG VAS 454262-2018-01 4 VELUX 24 VELUX KUX 100 1 2 VELUX 5 L R VELUX 25 CVP FMK / FMK-R FMG / FMG-R FMK-R FMG-R 1 452015-2013-02 13 EN 1873:2005 CVP XXXXXX XXXXXX XXXXXXXX Pages 4-22
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Constella 290 mikrogram harde kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver kapsel inneholder 290 mikrogram linaklotid. For fullstendig liste over
VEDLEGG I PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Constella 290 mikrogram harde kapsler. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver kapsel inneholder 290 mikrogram linaklotid. For fullstendig liste over
PAKNINGSVEDLEGG. EMADINE 0,5 mg/ml øyedråper, oppløsning. Emestadin.
 PAKNINGSVEDLEGG EMADINE 0,5 mg/ml øyedråper, oppløsning. Emestadin. Les nøye gjennom dette pakningsvedlegget, før du begynner å bruke legemidlet: - Ta vare på dette pakningsvedlegget. Du kan få behov for
PAKNINGSVEDLEGG EMADINE 0,5 mg/ml øyedråper, oppløsning. Emestadin. Les nøye gjennom dette pakningsvedlegget, før du begynner å bruke legemidlet: - Ta vare på dette pakningsvedlegget. Du kan få behov for
Pakningsvedlegg: Informasjon til pasienten. Aerius 2,5 mg smeltetabletter desloratadin
 Pakningsvedlegg: Informasjon til pasienten Aerius 2,5 mg smeltetabletter desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er
Pakningsvedlegg: Informasjon til pasienten Aerius 2,5 mg smeltetabletter desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er
Pakningsvedlegg: Informasjon til pasienten. Azomyr 5 mg tabletter, filmdrasjerte desloratadin
 Pakningsvedlegg: Informasjon til pasienten Azomyr 5 mg tabletter, filmdrasjerte desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten Azomyr 5 mg tabletter, filmdrasjerte desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten. Januvia 25 mg filmdrasjerte tabletter sitagliptin
 Pakningsvedlegg: Informasjon til pasienten Januvia 25 mg filmdrasjerte tabletter sitagliptin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten Januvia 25 mg filmdrasjerte tabletter sitagliptin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten. Zerbaxa 1 g/0,5 g pulver til konsentrat til infusjonsvæske, oppløsning ceftolozan/tazobaktam
 Pakningsvedlegg: Informasjon til pasienten Zerbaxa 1 g/0,5 g pulver til konsentrat til infusjonsvæske, oppløsning ceftolozan/tazobaktam Dette legemidlet er underlagt særlig overvåking for å oppdage ny
Pakningsvedlegg: Informasjon til pasienten Zerbaxa 1 g/0,5 g pulver til konsentrat til infusjonsvæske, oppløsning ceftolozan/tazobaktam Dette legemidlet er underlagt særlig overvåking for å oppdage ny
B. PAKNINGSVEDLEGG 23
 B. PAKNINGSVEDLEGG 23 Pakningsvedlegg: Informasjon til pasienten Bretaris Genuair 322 mikrogram inhalasjonspulver aklidinium (aklidiniumbromid) Dette legemidlet er underlagt særlig overvåking for å oppdage
B. PAKNINGSVEDLEGG 23 Pakningsvedlegg: Informasjon til pasienten Bretaris Genuair 322 mikrogram inhalasjonspulver aklidinium (aklidiniumbromid) Dette legemidlet er underlagt særlig overvåking for å oppdage
DETAILJOONISED Terassõrestikuga siseseinad
 .. A0 (EI0) 07 D. Välisnurk/sisenurk D. Nurk, sisemine/välimine Kinnipahteldatav nurgaliist Nurgaprofiil Norgipsi pahteldussüsteem koos vuugilindiga Max 00 mm Kinnipahteldatav nurgaliist Norgipsi pahteldussüsteem
.. A0 (EI0) 07 D. Välisnurk/sisenurk D. Nurk, sisemine/välimine Kinnipahteldatav nurgaliist Nurgaprofiil Norgipsi pahteldussüsteem koos vuugilindiga Max 00 mm Kinnipahteldatav nurgaliist Norgipsi pahteldussüsteem
Pakningsvedlegg: Informasjon til pasienten. Aerius 5 mg tabletter, filmdrasjerte desloratadin
 Pakningsvedlegg: Informasjon til pasienten Aerius 5 mg tabletter, filmdrasjerte desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten Aerius 5 mg tabletter, filmdrasjerte desloratadin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. HBVAXPRO 10 mikrogram, injeksjonsvæske, suspensjon Vaksine mot hepatitt B (rdna)
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN HBVAXPRO 10 mikrogram, injeksjonsvæske, suspensjon Vaksine mot hepatitt B (rdna) Les nøye gjennom dette pakningsvedlegget før du vaksineres. - Ta vare på dette
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN HBVAXPRO 10 mikrogram, injeksjonsvæske, suspensjon Vaksine mot hepatitt B (rdna) Les nøye gjennom dette pakningsvedlegget før du vaksineres. - Ta vare på dette
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Lixiana 15 mg tabletter, filmdrasjerte Lixiana 30 mg tabletter, filmdrasjerte Lixiana 60 mg tabletter, filmdrasjerte edoksaban Dette legemidlet er underlagt særlig
Pakningsvedlegg: Informasjon til brukeren Lixiana 15 mg tabletter, filmdrasjerte Lixiana 30 mg tabletter, filmdrasjerte Lixiana 60 mg tabletter, filmdrasjerte edoksaban Dette legemidlet er underlagt særlig
Pakningsvedlegg: Informasjon til pasienten. Sildenafil Actavis 25 mg filmdrasjerte tabletter Sildenafil
 Pakningsvedlegg: Informasjon til pasienten Sildenafil Actavis 25 mg filmdrasjerte tabletter Sildenafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten Sildenafil Actavis 25 mg filmdrasjerte tabletter Sildenafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Glustin 15 mg tabletter Pioglitazon
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Glustin 15 mg tabletter Pioglitazon Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget. Du kan få
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Glustin 15 mg tabletter Pioglitazon Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget. Du kan få
Muudame koos tööelu paremaks! Sõidukijuhi töö-, sõidu- ja puhkeaja korraldus. Käsiraamat
 Muudame koos tööelu paremaks! Sõidukijuhi töö-, sõidu- ja puhkeaja korraldus Käsiraamat Sisukord Autor: Priit Tuuna Toimetaja: Evelin Kivimaa Keel ja korrektuur: Liina Smolin Kujundus: www.arteverumstudio.com
Muudame koos tööelu paremaks! Sõidukijuhi töö-, sõidu- ja puhkeaja korraldus Käsiraamat Sisukord Autor: Priit Tuuna Toimetaja: Evelin Kivimaa Keel ja korrektuur: Liina Smolin Kujundus: www.arteverumstudio.com
Pakningsvedlegg: Informasjon til brukeren. Galvus 50 mg tabletter Vildagliptin
 Pakningsvedlegg: Informasjon til brukeren Galvus 50 mg tabletter Vildagliptin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er viktig
Pakningsvedlegg: Informasjon til brukeren Galvus 50 mg tabletter Vildagliptin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er viktig
TEKST2 EESTI ARSTITEADUSÜLIÕPILASTE SELTSI AMETLIK HÄÄLEPAEL NR 54 OKTOOBER maa ja mere taga. Arstitudengite elu laias. maailmas & teised jutud
 CURARE 1 TEKST2 EESTI ARSTITEADUSÜLIÕPILASTE SELTSI AMETLIK HÄÄLEPAEL NR 54 OKTOOBER 2013 7 maa ja mere taga Arstitudengite elu laias maailmas & teised jutud 2 Tere, hüva lugeja! Seekord on meil teie jaoks
CURARE 1 TEKST2 EESTI ARSTITEADUSÜLIÕPILASTE SELTSI AMETLIK HÄÄLEPAEL NR 54 OKTOOBER 2013 7 maa ja mere taga Arstitudengite elu laias maailmas & teised jutud 2 Tere, hüva lugeja! Seekord on meil teie jaoks
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Protopic 0,03 % salve Takrolimusmonohydrat
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Protopic 0,03 % salve Takrolimusmonohydrat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon som er viktig
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Protopic 0,03 % salve Takrolimusmonohydrat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon som er viktig
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. ADCIRCA 20 mg filmdrasjerte tabletter tadalafil
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN ADCIRCA 20 mg filmdrasjerte tabletter tadalafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget.
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN ADCIRCA 20 mg filmdrasjerte tabletter tadalafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget.
Pakningsvedlegg: Informasjon til brukeren. Ifirmasta 300 mg tabletter, filmdrasjerte Irbesartan
 Pakningsvedlegg: Informasjon til brukeren Ifirmasta 300 mg tabletter, filmdrasjerte Irbesartan Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren Ifirmasta 300 mg tabletter, filmdrasjerte Irbesartan Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten. Entyvio 300 mg pulver til konsentrat til infusjonsvæske, oppløsning vedolizumab
 Pakningsvedlegg: Informasjon til pasienten Entyvio 300 mg pulver til konsentrat til infusjonsvæske, oppløsning vedolizumab Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon
Pakningsvedlegg: Informasjon til pasienten Entyvio 300 mg pulver til konsentrat til infusjonsvæske, oppløsning vedolizumab Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon
Irbesartan Zentiva inneholder laktose. Dersom du ikke tåler visse sukkertyper (for eksempel laktose), kontakt legen før du tar dette legemidlet.
 Du må fortelle legen din hvis du tror du er gravid (eller om du tror du kan komme til å bli gravid). Irbesartan Zentiva er ikke anbefalt tidlig i svangerskapet, og må ikke benyttes hvis du er mer enn tre
Du må fortelle legen din hvis du tror du er gravid (eller om du tror du kan komme til å bli gravid). Irbesartan Zentiva er ikke anbefalt tidlig i svangerskapet, og må ikke benyttes hvis du er mer enn tre
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Synflorix injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot pneumokokkinfeksjon (polysakkarid, konjugert, adsorbert) Les nøye gjennom dette pakningsvedlegget
Pakningsvedlegg: Informasjon til brukeren Synflorix injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot pneumokokkinfeksjon (polysakkarid, konjugert, adsorbert) Les nøye gjennom dette pakningsvedlegget
Pakningsvedlegg: Informasjon til pasienten. Orgalutran 0,25 mg/0,5 ml injeksjonsvæske, oppløsning ganirelix
 Pakningsvedlegg: Informasjon til pasienten Orgalutran 0,25 mg/0,5 ml injeksjonsvæske, oppløsning ganirelix Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder
Pakningsvedlegg: Informasjon til pasienten Orgalutran 0,25 mg/0,5 ml injeksjonsvæske, oppløsning ganirelix Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder
Pakningsvedlegg: Informasjon til brukeren RotaTeq, oral oppløsning Rotavirusvaksine, levende
 Pakningsvedlegg: Informasjon til brukeren RotaTeq, oral oppløsning Rotavirusvaksine, levende Les nøye gjennom dette pakningsvedlegget før barnet vaksineres. Det inneholder informasjon som er viktig for
Pakningsvedlegg: Informasjon til brukeren RotaTeq, oral oppløsning Rotavirusvaksine, levende Les nøye gjennom dette pakningsvedlegget før barnet vaksineres. Det inneholder informasjon som er viktig for
Enne testi alustamist tuleb veenduda selles, et asutakse /root kaustas ja mitte milleski muus: pwd
 Eksami käigus tuleb teostada erinevaid administreerimise alaseid operatsioone. Mõned neist on lihtsamad ja mõned keerukamad. Operatsioone teostage /root kaustas ja juurkasutaja õigustes, kui pole öeldud
Eksami käigus tuleb teostada erinevaid administreerimise alaseid operatsioone. Mõned neist on lihtsamad ja mõned keerukamad. Operatsioone teostage /root kaustas ja juurkasutaja õigustes, kui pole öeldud
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Nimvastid 1,5 mg smeltetabletter Nimvastid 3 mg smeltetabletter Nimvastid 4,5 mg smeltetabletter Nimvastid 6 mg smeltetabletter rivastigmin Les nøye gjennom dette
Pakningsvedlegg: Informasjon til brukeren Nimvastid 1,5 mg smeltetabletter Nimvastid 3 mg smeltetabletter Nimvastid 4,5 mg smeltetabletter Nimvastid 6 mg smeltetabletter rivastigmin Les nøye gjennom dette
Det europeiske miljøbyrå (EEA)
 Det europeiske miljøbyrå (EEA) Det europeiske miljøbyrå Oppgave Det europeiske miljøbyrå er EUs organ for formidling av pålitelig, uavhengig informasjon om miljøet. Miljøbyrået er en viktig informasjonskilde
Det europeiske miljøbyrå (EEA) Det europeiske miljøbyrå Oppgave Det europeiske miljøbyrå er EUs organ for formidling av pålitelig, uavhengig informasjon om miljøet. Miljøbyrået er en viktig informasjonskilde
B. PAKNINGSVEDLEGG 1
 B. PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren ellaone 30 mg tablett ulipristalacetat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
B. PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren ellaone 30 mg tablett ulipristalacetat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Trobalt 50 mg filmdrasjerte tabletter Trobalt 100 mg filmdrasjerte tabletter Trobalt 200 mg filmdrasjerte tabletter Trobalt 300 mg filmdrasjerte tabletter Trobalt
Pakningsvedlegg: Informasjon til brukeren Trobalt 50 mg filmdrasjerte tabletter Trobalt 100 mg filmdrasjerte tabletter Trobalt 200 mg filmdrasjerte tabletter Trobalt 300 mg filmdrasjerte tabletter Trobalt
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren ZOSTAVAX Pulver og væske til injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot helvetesild (levende) Les nøye gjennom dette pakningsvedlegget før du
Pakningsvedlegg: Informasjon til brukeren ZOSTAVAX Pulver og væske til injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot helvetesild (levende) Les nøye gjennom dette pakningsvedlegget før du
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. DepoCyte 50 mg injeksjonsvæske, suspensjon Cytarabin
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN DepoCyte 50 mg injeksjonsvæske, suspensjon Cytarabin Les nøye gjennom dette pakningsvedlegget før du får begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget.
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN DepoCyte 50 mg injeksjonsvæske, suspensjon Cytarabin Les nøye gjennom dette pakningsvedlegget før du får begynner å bruke legemidlet. - Ta vare på dette pakningsvedlegget.
User Guide. Eesti. Nasal Pillows System
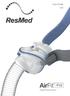 User Guide Eesti Nasal Pillows System Fitting / Tillpassning / Tilpasning / Tilpasning / Sovittaminen / Paigaldamine 1 2 3 Adjustment / Justering / Justering / Justering / Säätäminen / Kohendamine Removal
User Guide Eesti Nasal Pillows System Fitting / Tillpassning / Tilpasning / Tilpasning / Sovittaminen / Paigaldamine 1 2 3 Adjustment / Justering / Justering / Justering / Säätäminen / Kohendamine Removal
B. PAKNINGSVEDLEGG 1
 B. PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren ellaone 30 mg tablett ulipristalacetat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
B. PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren ellaone 30 mg tablett ulipristalacetat Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Tarceva 25 mg filmdrasjerte tabletter Tarceva 100 mg filmdrasjerte tabletter Tarceva 150 mg filmdrasjerte tabletter erlotinib Les nøye gjennom dette pakningsvedlegget
Pakningsvedlegg: Informasjon til brukeren Tarceva 25 mg filmdrasjerte tabletter Tarceva 100 mg filmdrasjerte tabletter Tarceva 150 mg filmdrasjerte tabletter erlotinib Les nøye gjennom dette pakningsvedlegget
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Fevaxyn Pentofel, injeksjonsvæske, suspensjon til katter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose på 1 ml (engangssprøyte): Virkestoffer
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Fevaxyn Pentofel, injeksjonsvæske, suspensjon til katter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose på 1 ml (engangssprøyte): Virkestoffer
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Cervarix injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot humant papillomavirus [type 16, 18] (rekombinant) (med adjuvans, adsorbert) Les nøye gjennom
Pakningsvedlegg: Informasjon til brukeren Cervarix injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot humant papillomavirus [type 16, 18] (rekombinant) (med adjuvans, adsorbert) Les nøye gjennom
B. PAKNINGSVEDLEGG 1
 B. PAKNINGSVEDLEGG 1 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Pandemrix, suspensjon og emulsjon til injeksjonsvæske, emulsjon. Vaksine mot pandemisk influensa (H1N1) (inaktivert, splittvirus, med adjuvans)
B. PAKNINGSVEDLEGG 1 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Pandemrix, suspensjon og emulsjon til injeksjonsvæske, emulsjon. Vaksine mot pandemisk influensa (H1N1) (inaktivert, splittvirus, med adjuvans)
EUROOPA PARLAMENT. Istungidokument
 EUROOPA PARLAMENT 2004 Istungidokument 2009 C6-0017/2006 2003/0262(COD) 19/01/2006 Ühisseisukoht Nõukogu 8. detsembri 2005. aasta ühine seisukoht eesmärgiga võtta vastu Euroopa Parlamendi ja nõukogu määrus
EUROOPA PARLAMENT 2004 Istungidokument 2009 C6-0017/2006 2003/0262(COD) 19/01/2006 Ühisseisukoht Nõukogu 8. detsembri 2005. aasta ühine seisukoht eesmärgiga võtta vastu Euroopa Parlamendi ja nõukogu määrus
Pakningsvedlegg: Informasjon til pasienten. Janumet 50 mg/850 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid
 Pakningsvedlegg: Informasjon til pasienten Janumet 50 mg/850 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: Informasjon til pasienten Janumet 50 mg/850 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Versican Plus L4 injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder: Virkestoffer: Leptospira
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Versican Plus L4 injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder: Virkestoffer: Leptospira
Pakningsvedlegg: Informasjon til brukeren Karvea 150 mg filmdrasjerte tabletter irbesartan
 Pakningsvedlegg: Informasjon til brukeren Karvea 150 mg filmdrasjerte tabletter irbesartan Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren Karvea 150 mg filmdrasjerte tabletter irbesartan Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til brukeren
 Pakningsvedlegg: Informasjon til brukeren Onbrez Breezhaler 150 mikrogram inhalasjonspulver, harde kapsler Onbrez Breezhaler 300 mikrogram inhalasjonspulver, harde kapsler Indakaterol maleat Les nøye gjennom
Pakningsvedlegg: Informasjon til brukeren Onbrez Breezhaler 150 mikrogram inhalasjonspulver, harde kapsler Onbrez Breezhaler 300 mikrogram inhalasjonspulver, harde kapsler Indakaterol maleat Les nøye gjennom
Pakningsvedlegg: Informasjon til pasienten
 Pakningsvedlegg: Informasjon til pasienten Keppra 250 mg filmdrasjerte tabletter Keppra 500 mg filmdrasjerte tabletter Keppra 750 mg filmdrasjerte tabletter Keppra 1000 mg filmdrasjerte tabletter levetiracetam
Pakningsvedlegg: Informasjon til pasienten Keppra 250 mg filmdrasjerte tabletter Keppra 500 mg filmdrasjerte tabletter Keppra 750 mg filmdrasjerte tabletter Keppra 1000 mg filmdrasjerte tabletter levetiracetam
Snø og is VAS 453382-2013-10
 Snø og is VAS 453382-2013-10 VINTERFORHOLD I områder med kraftig snøfall og lange kalde perioder, kan et VELUX takvindu være dekket med snø i lengre tid, og i løpet av vinteren kan store mengder snø hope
Snø og is VAS 453382-2013-10 VINTERFORHOLD I områder med kraftig snøfall og lange kalde perioder, kan et VELUX takvindu være dekket med snø i lengre tid, og i løpet av vinteren kan store mengder snø hope
Pakningsvedlegg: Informasjon til pasienten. Janumet 50 mg/1000 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid
 Pakningsvedlegg: Informasjon til pasienten Janumet 50 mg/1000 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: Informasjon til pasienten Janumet 50 mg/1000 mg filmdrasjerte tabletter sitagliptin/metforminhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
B. PAKNINGSVEDLEGG 25
 B. PAKNINGSVEDLEGG 25 Pakningsvedlegg: Informasjon til pasienten Xofigo 1100 kbq/ml injeksjonsvæske, oppløsning radium (223Ra) diklorid Dette legemidlet er underlagt særlig overvåking for å oppdage ny
B. PAKNINGSVEDLEGG 25 Pakningsvedlegg: Informasjon til pasienten Xofigo 1100 kbq/ml injeksjonsvæske, oppløsning radium (223Ra) diklorid Dette legemidlet er underlagt særlig overvåking for å oppdage ny
väljavõte Telia Eesti AS lõppkasutajate hinnakirjast Seisuga VIII ptk Mittemüüdavad püsiühenduse teenused ärikliendile km-ta km-ga ühik
 1. Interneti- ja kõnepaketid 1.1. Ärikliendi Internet teenus on mittemüüdav 1.1.1. kuutasu 1.1.1.1. kiirus kuni 2 Mbit/s / 2 Mbit/s 78,85 94,62 /kuu 1.1.1.2. kiirus kuni 4 Mbit/s / 4 Mbit/s 142,85 171,42
1. Interneti- ja kõnepaketid 1.1. Ärikliendi Internet teenus on mittemüüdav 1.1.1. kuutasu 1.1.1.1. kiirus kuni 2 Mbit/s / 2 Mbit/s 78,85 94,62 /kuu 1.1.1.2. kiirus kuni 4 Mbit/s / 4 Mbit/s 142,85 171,42
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Twinrix Paediatric injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot hepatitt A (inaktivert) og hepatitt B (rdna) (HAB), (adsorbert) Les nøye gjennom
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Twinrix Paediatric injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot hepatitt A (inaktivert) og hepatitt B (rdna) (HAB), (adsorbert) Les nøye gjennom
EKSPERTHINNANG. Kinnistu nr , aadressil Smuuli 11, Lasnamäe linnaosa, Tallinn. Töö nr /M Tallinn Tellija: Tallinna Maa-amet
 EKSPERTHINNANG Kinnistu nr 9472201, aadressil Smuuli 11, Töö nr 0601-3209/M Tallinn 2006 Tellija: Tallinna Maa-amet 2 SISUKORD Lk. 1. HINDAMISE OBJEKT 3 2. EKSPERTHINNANGU TELLIJA 3 3. HINDAMISE EESMÄRK
EKSPERTHINNANG Kinnistu nr 9472201, aadressil Smuuli 11, Töö nr 0601-3209/M Tallinn 2006 Tellija: Tallinna Maa-amet 2 SISUKORD Lk. 1. HINDAMISE OBJEKT 3 2. EKSPERTHINNANGU TELLIJA 3 3. HINDAMISE EESMÄRK
MONTERINGSVEILEDNING FOR LIFE MONTERINGSVEJLEDNING ASENNUSOHJE MONTAAŽIJUHEND
 E-240 GBS E-340 GBS E-440 GBS E-640 GBS S-240 GBS S-340 GBS S-440 GBS S-640 GBS Gratis nedlasting Gratis download Lataa ilmaiseksi Tasuta Allalaadimine MONTERINGSVEILEDNING MONTERINGSVEJLEDNING ASENNUSOHJE
E-240 GBS E-340 GBS E-440 GBS E-640 GBS S-240 GBS S-340 GBS S-440 GBS S-640 GBS Gratis nedlasting Gratis download Lataa ilmaiseksi Tasuta Allalaadimine MONTERINGSVEILEDNING MONTERINGSVEJLEDNING ASENNUSOHJE
Pakningsvedlegg: Informasjon til pasienten. Vimpat 150 mg tabletter, filmdrasjerte. Vimpat 100 mg tabletter, filmdrasjerte
 Pakningsvedlegg: Informasjon til pasienten Vimpat 50 mg tabletter, filmdrasjerte Vimpat 100 mg tabletter, filmdrasjerte Vimpat 150 mg tabletter, filmdrasjerte Vimpat 200 mg tabletter, filmdrasjerte lakosamid
Pakningsvedlegg: Informasjon til pasienten Vimpat 50 mg tabletter, filmdrasjerte Vimpat 100 mg tabletter, filmdrasjerte Vimpat 150 mg tabletter, filmdrasjerte Vimpat 200 mg tabletter, filmdrasjerte lakosamid
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN VEPURED injeksjonsvæske, suspensjon for gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder: Virkestoff: Rekombinant Verotoksin
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN VEPURED injeksjonsvæske, suspensjon for gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder: Virkestoff: Rekombinant Verotoksin
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Raloxifene Teva 60 mg filmdrasjerte tabletter raloksifenhydroklorid
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Raloxifene Teva 60 mg filmdrasjerte tabletter raloksifenhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Raloxifene Teva 60 mg filmdrasjerte tabletter raloksifenhydroklorid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på dette
Pakningsvedlegg: Informasjon til brukeren. Vizarsin 25 mg smeltetabletter Sildenafil
 Pakningsvedlegg: Informasjon til brukeren Vizarsin 25 mg smeltetabletter Sildenafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er
Pakningsvedlegg: Informasjon til brukeren Vizarsin 25 mg smeltetabletter Sildenafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Versican Plus Pi lyofilisat og væske til injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder:
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Versican Plus Pi lyofilisat og væske til injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 1 ml inneholder:
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ZULVAC SBV injeksjonsvæske, suspensjon til storfe og sau 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Inaktivert Schmallenbergvirus, stamme
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ZULVAC SBV injeksjonsvæske, suspensjon til storfe og sau 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Inaktivert Schmallenbergvirus, stamme
PAKNINGSVEDLEGG Easotic øredråper, suspensjon til hund
 PAKNINGSVEDLEGG Easotic øredråper, suspensjon til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PAKNINGSVEDLEGG Easotic øredråper, suspensjon til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
Pakningsvedlegg: Informasjon til pasienten. PROTELOS 2 g - granulat til mikstur, suspensjon Strontiumranelat
 Pakningsvedlegg: Informasjon til pasienten PROTELOS 2 g - granulat til mikstur, suspensjon Strontiumranelat Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt
Pakningsvedlegg: Informasjon til pasienten PROTELOS 2 g - granulat til mikstur, suspensjon Strontiumranelat Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt
Eelmine kuupäev
 1 / 7 KESTO VEDELDI NR 3 Koostamise kuupäev 07.08.2000 TOOTE OHUTUSKAART Eelmine kuupäev 15.10.1998 1. ANDMED KEMIKAALI JA SELLE TOOTJA KOHTA 1.1 Andmed aine või toote kohta Toote nimi KESTO VEDELDI NR
1 / 7 KESTO VEDELDI NR 3 Koostamise kuupäev 07.08.2000 TOOTE OHUTUSKAART Eelmine kuupäev 15.10.1998 1. ANDMED KEMIKAALI JA SELLE TOOTJA KOHTA 1.1 Andmed aine või toote kohta Toote nimi KESTO VEDELDI NR
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Topotecan Actavis 1 mg pulver til konsentrat til infusjonsvæske Topotecan Actavis 4 mg pulver til konsentrat til infusjonsvæske topotekan Les nøye gjennom dette
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Topotecan Actavis 1 mg pulver til konsentrat til infusjonsvæske Topotecan Actavis 4 mg pulver til konsentrat til infusjonsvæske topotekan Les nøye gjennom dette
Pakningsvedlegg: Informasjon til brukeren
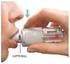 Pakningsvedlegg: Informasjon til brukeren EXJADE 125 mg dispergerbare tabletter EXJADE 250 mg dispergerbare tabletter EXJADE 500 mg dispergerbare tabletter deferasiroks Dette legemidlet er underlagt særlig
Pakningsvedlegg: Informasjon til brukeren EXJADE 125 mg dispergerbare tabletter EXJADE 250 mg dispergerbare tabletter EXJADE 500 mg dispergerbare tabletter deferasiroks Dette legemidlet er underlagt særlig
B. PAKNINGSVEDLEGG 1
 B. PAKNINGSVEDLEGG 1 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Pandemrix, suspensjon og emulsjon til injeksjonsvæske, emulsjon. Vaksine mot pandemisk influensa (H1N1) (inaktivert, splittvirus, med adjuvans)
B. PAKNINGSVEDLEGG 1 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Pandemrix, suspensjon og emulsjon til injeksjonsvæske, emulsjon. Vaksine mot pandemisk influensa (H1N1) (inaktivert, splittvirus, med adjuvans)
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Suvaxyn CSF Marker lyofilisat og væske til injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose med 1 ml inneholder:
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Suvaxyn CSF Marker lyofilisat og væske til injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose med 1 ml inneholder:
Unlocking innovation in education in prison. Töövarjuna Belgias
 Unlocking innovation in education in prison Töövarjuna Belgias Tallinna Ehituskooli projekt Innovaatilised praktikad ja järjepidevus vanglahariduse edendamisel hõlmas 2 õpirände meedet kinnipeetavate koolituse
Unlocking innovation in education in prison Töövarjuna Belgias Tallinna Ehituskooli projekt Innovaatilised praktikad ja järjepidevus vanglahariduse edendamisel hõlmas 2 õpirände meedet kinnipeetavate koolituse
PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt
 PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
Uus töötaja - olete teretulnud Norrasse!
 Uus töötaja - olete teretulnud Norrasse! Estisk versjon Sissejuhatus Teretulemast töövõtjana Norrasse. Siin on kindlasti paljud asjad teistmoodi, kui teie kodumaal. Võibolla olete juba natuke Norra ehitusalal
Uus töötaja - olete teretulnud Norrasse! Estisk versjon Sissejuhatus Teretulemast töövõtjana Norrasse. Siin on kindlasti paljud asjad teistmoodi, kui teie kodumaal. Võibolla olete juba natuke Norra ehitusalal
FEI Rakendispordi määrustik ja pararakendispordi
 FEI Rakendispordi määrustik ja pararakendispordi määrustik 11. väljaanne, kehtiv alates 1. jaanuarist 2014 Muudatused kehtivad alates 1. jaanuarist 2017 Printed in Switzerland Copyright 2017 Fédération
FEI Rakendispordi määrustik ja pararakendispordi määrustik 11. väljaanne, kehtiv alates 1. jaanuarist 2014 Muudatused kehtivad alates 1. jaanuarist 2017 Printed in Switzerland Copyright 2017 Fédération
B. PAKNINGSVEDLEGG 36
 B. PAKNINGSVEDLEGG 36 Pakningsvedlegg: Informasjon til brukeren Clopidogrel ratiopharm 75 mg filmdrasjerte tabletter klopidogrel Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
B. PAKNINGSVEDLEGG 36 Pakningsvedlegg: Informasjon til brukeren Clopidogrel ratiopharm 75 mg filmdrasjerte tabletter klopidogrel Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
EKSPERTHINNANG. Kinnistu nr , aadressil Smuuli 9, Lasnamäe linnaosa, Tallinn. Töö nr /M Tallinn Tellija: Tallinna Maa-amet
 EKSPERTHINNANG Kinnistu nr 377201, aadressil Smuuli 9, Töö nr 0601-3208/M Tallinn 2006 Tellija: Tallinna Maa-amet 2 SISUKORD Lk. 1. HINDAMISE OBJEKT 3 2. EKSPERTHINNANGU TELLIJA 3 3. HINDAMISE EESMÄRK
EKSPERTHINNANG Kinnistu nr 377201, aadressil Smuuli 9, Töö nr 0601-3208/M Tallinn 2006 Tellija: Tallinna Maa-amet 2 SISUKORD Lk. 1. HINDAMISE OBJEKT 3 2. EKSPERTHINNANGU TELLIJA 3 3. HINDAMISE EESMÄRK
Pakningsvedlegg: Informasjon til brukeren. INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem
 Pakningsvedlegg: Informasjon til brukeren INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det
Pakningsvedlegg: Informasjon til brukeren INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Quadrisol 100 mg/ml oralgel til hester 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Quadrisol oralgel inneholder: Virkestoff(er): Vedaprofen:
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Quadrisol 100 mg/ml oralgel til hester 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Quadrisol oralgel inneholder: Virkestoff(er): Vedaprofen:
Pakningsvedlegg: Informasjon til brukeren. EPIVIR 150 mg tabletter, filmdrasjerte lamivudin
 Pakningsvedlegg: Informasjon til brukeren EPIVIR 150 mg tabletter, filmdrasjerte lamivudin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon som er
Pakningsvedlegg: Informasjon til brukeren EPIVIR 150 mg tabletter, filmdrasjerte lamivudin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder informasjon som er
Tariifikvootide ja seire statistika 2008
 Tariifikvootide ja seire statistika 2008 1. Edastatud tariifikvoodi taotluste arv kuude lõikes Jaan. Veebr. Märts Aprill Mai Juuni Juuli Aug. Sept. Okt. Nov. Dets. 64 59 63 59 34 39 38 35 32 57 30 37 Kokku:
Tariifikvootide ja seire statistika 2008 1. Edastatud tariifikvoodi taotluste arv kuude lõikes Jaan. Veebr. Märts Aprill Mai Juuni Juuli Aug. Sept. Okt. Nov. Dets. 64 59 63 59 34 39 38 35 32 57 30 37 Kokku:
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Ipreziv 20 mg tabletter Ipreziv 40 mg tabletter Ipreziv 80 mg tabletter azilsartanmedoksomil
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ipreziv 20 mg tabletter Ipreziv 40 mg tabletter Ipreziv 80 mg tabletter azilsartanmedoksomil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet.
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ipreziv 20 mg tabletter Ipreziv 40 mg tabletter Ipreziv 80 mg tabletter azilsartanmedoksomil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet.
KEMIKAALI OHUTUSKAART
 Vastab määrusele (EÜ) nr 1907/2006 (REACH), Lisa II, mida muudeti määrusega (EL) nr 453/2010 - Euroopa Toote nimetus KEMIKAALI OHUTUSKAART 1. JAGU Aine/segu ning äriühingu/ettevõtja identifitseerimine
Vastab määrusele (EÜ) nr 1907/2006 (REACH), Lisa II, mida muudeti määrusega (EL) nr 453/2010 - Euroopa Toote nimetus KEMIKAALI OHUTUSKAART 1. JAGU Aine/segu ning äriühingu/ettevõtja identifitseerimine
Pakningsvedlegg: Informasjon til brukeren. Iasibon 50 mg tabletter, filmdrasjerte ibandronsyre
 Pakningsvedlegg: Informasjon til brukeren Iasibon 50 mg tabletter, filmdrasjerte ibandronsyre Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Ta vare på dette pakningsvedlegget.
Pakningsvedlegg: Informasjon til brukeren Iasibon 50 mg tabletter, filmdrasjerte ibandronsyre Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Ta vare på dette pakningsvedlegget.
Pakningsvedlegg: Informasjon til pasienten. Tredaptive 1000 mg/20 mg tabletter med modifisert frisetting nikotinsyre/laropiprant
 Pakningsvedlegg: Informasjon til pasienten Tredaptive 1000 mg/20 mg tabletter med modifisert frisetting nikotinsyre/laropiprant Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: Informasjon til pasienten Tredaptive 1000 mg/20 mg tabletter med modifisert frisetting nikotinsyre/laropiprant Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN INVANZ 1 g pulver til konsentrat til infusjonsvæske, oppløsning ertapenem Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. Det inneholder
Pakningsvedlegg: Informasjon til brukeren. Beromun 1 mg/5 ml pulver og væske til infusjonsvæske, oppløsning tasonermin
 Pakningsvedlegg: Informasjon til brukeren Beromun 1 mg/5 ml pulver og væske til infusjonsvæske, oppløsning tasonermin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: Informasjon til brukeren Beromun 1 mg/5 ml pulver og væske til infusjonsvæske, oppløsning tasonermin Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet.
Pakningsvedlegg: Informasjon til brukeren. FOSAVANCE 70 mg/2800 IE tabletter alendronsyre/kolekalsiferol
 Pakningsvedlegg: Informasjon til brukeren FOSAVANCE 70 mg/2800 IE tabletter alendronsyre/kolekalsiferol Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet, selv om du har
Pakningsvedlegg: Informasjon til brukeren FOSAVANCE 70 mg/2800 IE tabletter alendronsyre/kolekalsiferol Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet, selv om du har
Pakningsvedlegg: Informasjon til brukeren. CIALIS 5 mg tabletter, filmdrasjerte tadalafil
 Pakningsvedlegg: Informasjon til brukeren CIALIS 5 mg tabletter, filmdrasjerte tadalafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som
Pakningsvedlegg: Informasjon til brukeren CIALIS 5 mg tabletter, filmdrasjerte tadalafil Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som
KEMIKAALI OHUTUSKAART
 1.1 Tootetähis Vastab määrusele (EÜ) nr 1907/2006 (REACH), Lisa II, mida muudeti määrusega (EL) nr 2015/830 - Eesti 1. JAGU. Aine/segu ning äriühingu/ettevõtja identifitseerimine Toote nimetus Toote kood
1.1 Tootetähis Vastab määrusele (EÜ) nr 1907/2006 (REACH), Lisa II, mida muudeti määrusega (EL) nr 2015/830 - Eesti 1. JAGU. Aine/segu ning äriühingu/ettevõtja identifitseerimine Toote nimetus Toote kood
