Hovedoppgave for cand.scient.-graden. Christian Kjølseth. Hydrogen og ammoniakk som brensel i en høytemperaturbrenselcelle. protonledende elektrolytt
|
|
|
- Baard Kristensen
- 7 år siden
- Visninger:
Transkript
1 Hovedoppgave for cand.scent.-graden Chrstan Kjølseth Hydrogen og ammonakk som brensel en høytemperaturbrenselcelle med protonledende elektrolytt KJEMISK INSTITUTT Det matematsk-naturvtenskapelge fakultet UNIVERSITETET I OSLO 2/25
2 Forord Denne hovedfagsoppgaven representerer en del av Cand. Scent. studet ved Kjemsk Insttutt, Unverstetet Oslo. Arbedet ble utført ved Senter for Materalvtenskap og Nanoteknolog peroden august 23 tl februar 25. Jeg ønsker speselt å takke mn veleder professor Truls Norby for nsprasjon og hjelp under hele arbedet, særlg gjennom nteressante og engasjerende samtaler. Jeg ønsker også å takke alle ansatte og studenter ved Senter for Materalvtenskap og Nanoteknolog for stor hjelp, praktsk og teoretsk, speselt doktor Redar Haugsrud. For gvende samtaler og dskusjoner ønsker jeg særlg og å takke kontorkomps Harald Fjeld. Sst, men vktgst, takker jeg mn samboer, Stne Aule, for moralsk støtte og for å ha holdt ut med meg de sste månedene. Unverstetet Oslo, februar 25. Chrstan Kjølseth I
3 II
4 Sammendrag Dette arbedet har hovedsak tatt for seg studet av en høytemperatur brenselcelle med protonledende elektrolytt for hydrogen og ammonakk temperaturntervallet 6-9ºC. BaCe,9 Y,1 O 2,95 (BCY) ble benyttet som elektrolytt og platna som elektrodematerale en hydrogen/oksygen- og en ammonakk/oksygen-brenselcelle. SrCe,95 Yb,5 O 2,975 (SCYb) ble benyttet som elektrolytt og platna som elektrodematerale en hydrogen/oksygenbrenselcelle. SCYb ble også benyttet som elektrolytt et 3-elektrodestudet av en N-SCYb cermetelektrode. BCY ble syntetsert ved stratmetoden, og vste enfase ved XRD. Et dlatometer ble benyttet for å fnne den egnede sntrngstemperaturen tl BCY og SCYb. Gasssammensetnngene ble kontrollert med en gassmkserenhet, en for hydrogen/oksygen og en for ammonakk/oksygen. Ikke reagert ammonakk ble destruert en ammonakkfelle med melkesyre. Brenselcellene ble karaktersert ved AC-mpedansspektroskop og strømtetthet/spennngsmålnger (I-V målnger) galvanostatsk modus. I-V målngene og AC-mpedansspektroskop vste at aktverngsenergen tl bulklednngsevnen var relatvt lk for hydrogen- og ammonakkbrenselcellen med BCYelektrolytt og Pt-elektroder. SCYb-elektrolytt med Pt-elektroder hydrogen/oksygenbrenselcellen og SCYb-elektrolytt 3-elektrodemålnger vste tlsvarende lk aktverngsenerg for bulklednngsevnen ved AC-mpedansspektroskop. Bulklednngsevnene var sammenlknbare med ltteratur. En lav OCV forhold tl teoretsk for BCY og SCYb hydrogen/oksygen-brenselcellen med Ptelektroder skyldes gasslekkasje og elektronsk lednngsevne elektrolytten. Ved stgende temperatur øker den elektronske lednngsevnen BCY og SCYb. Dette førte tl at forskjellen mellom teoretsk og ekspermentell OCV økte. Domnerende elektrodempedans Pt-anoden førte antagelgvs tl en lav OCV for ammonakk/oksygen-brenselcellen, en relatvt stor andel av den elektronske strømmen gkk gjennom elektrolytten. Et tydelg massetransportoverpotensal hydrogen/oksygen-brenselcellen ved lavt hydrogennnhold vste at den høye elektrodempedansen hovedsakelg kom fra en dårlg Pt-anode. Pt-anoden degraderte antagelgvs ammonakk, sden dette massetransportoverpotensalet kom tdlgere ammonakk/oksygen-brenselcellen. En alternatv anode, bestående av en blandng metall og keram, N-SCYb, ble syntetsert og karaktersert ved 3-elektrode AC-mpedansspektroskop temperaturntervallet 5-9ºC. Cermetelektroden vste en arealspesfkk motstand hydrogen på ~ 1,5 Ω cm 2 og ~ 2,2 Ω cm 2 ammonakk ved 7ºC. Pt-elektroden hydrogen/oksygen brenselcellen vste tl sammenlknng ~ 7,6 Ω cm 2. Ved temperaturer over 7ºC var den arealspesfkke motstanden for cermetelektroden hydrogen og ammonakk tlnærmet lk. III
5 IV
6 Innholdsfortegnelse: FORORD I SAMMENDRAG... III 1 INNLEDNING BRENSELCELLER AMMONIAKK ELEKTROLYTT OG ELEKTRODER MÅLET MED OPPGAVEN TEORI DEFEKTKJEMI Defekter krystallnske materaler Kröger-Vnk notasjon Termodynamkk for defekter Termodynamkk for reaksjoner Temperaturavhenggheten tl defekter Elektronske defekter Akseptor- og donordopng DEFEKTER I BaCeO 3 OG SrCeO Intrnsk defektstuasjon Støkometrske oksder Katon kke-støkometr Lkevekter med hydrogen Dopng Konsentrasjon av defekter som funksjon av oksygenpartaltrykk Konsentrasjon av defekter som funksjon av vanndamppartalttrykk Defektkonsentrasjonen som funksjon av temperatur DIFFUSJON Fcks lover Dffusjonsmekansmer Dffusjon av protoner oksder ELEKTRISK LEDNINGSEVNE Transport en elektrsk potensalgradent Ladnngsbærere oksder Nernst-Ensten lknngen ELEKTROKJEMISK TRANSPORT Elektrokjemsk potensal Flukslknnger Wagner teor Spennngen over en prøve.. 29 V
7 2.6 ELEKTROKJEMISK CELLE Målng av en celles elektromotorske spennng (EMF eller OCV) Strøm/spennngsmålnger Overpotensaler IMPEDANSSPEKTROSKOPI Egenskaper tl vekselstrøm Passve elektronske kretselementer AC-mpedans Målng av mpedansdata elektrodemålnger ELEKTRODER Metallelektroder Cermetelektroder 44 3 LITTERATUR STRUKTUR STABILITET EFFEKTEN AV IKKE-STØKIOMETRI Barumunderskudd Barumoverskudd ELEKTRISKE EGENSKAPER Proton- vs. oksygenonelednngsevne BRENSELCELLEFORSØK H 2 /O 2 brenselcelle; arbed av Bonanos et al NH 3 /O 2 brenselcelle; arbed av McFarlan et al CERMETELEKTRODER; ARBEID AV MATHER ET AL EKSPERIMENTELT SYNTESE OG PRØVEPREPARERING Prøvekarakterserng Syntese av BaCe,9 Y,1 O 2,95 ved stratmetoden Sntrng Elektroder MÅLECELLE GASSMIKSERENHETEN Varant A; gassmkser for H 2 /O 2 brenselcellen Varant B; gassmkser for NH 3 /O 2 brenselcellen Målng av mengden ammonakk STRØM/SPENNINGSMÅLINGER AC-IMPEDANSSPEKTROSKOPI Topunktsmålnger Trepunktsmålnger. 75 VI
8 4.6 PRODUKSJON AV AMMONIAKK TIL BRUK I LABORATORIET AMMONIAKKFELLE RESULTATER PRØVEKARAKTERISERING Røntgendffrakson SEM I-V KARAKTERISERING Hydrogen/oksygen-brenselcelle Ammonakk/oksygen-brenselcelle ÅPEN CELLESPENNING Hydrogen/oksygen-brenselcelle Ammonakk/oksygen-brenselcelle LEDNINGSEVNE FRA I-V MÅLINGER AC-IMPEDANSSPEKTROSKOPI Hydrogen/oksygen-brenselcelle Ammonakk/oksygen-brenselcelle elektrodemålnger 96 6 DISKUSJON PROTONLEDNINGSEVNEN FOR BCY OG SCYb OCV FOR HYDROGEN/OKSYGEN OG AMMONIAKK/OKSYGEN MED BCY ELEKTRODEIMPEDANS FOR Pt-ELEKTRODE MED SCYb OG BCY MASSETRANSPORTOVERPOTENSIAL I Pt-ELEKTRODE I-V KURVE; MODELL OG SAMMENLIKNING MED LITTERATUR CERMETELEKTRODE 17 7 KONKLUSJON OG FREMTIDIG ARBEID REFERANSER VII
9 VIII
10 1 Innlednng 1.1 Brenselceller En brenselcelle er, lkhet med et batter, en nnretnng som forandrer kjemsk energ tl elektrstet. På denne måten skller brenselcella seg fra en konvensjonell forbrennngsmotor som konverterer den kjemske energen tl mekansk arbed. Det fnnes en rekke forskjellge brenselceller som det dag benyttes store forskerressurser på å utvkle. En av dsse brenselcellene er faststoffoksd brenselceller, SOFC (sold oxde fuel cell). Denne brenselcelle består av et fast oksd som elektrolytt. Det fnnes to typer elektrolytter SOFC, en som leder protoner og en som leder oksygenoner. I denne oppgaven benyttes en protonledende elektrolytt. Prnsppsksse av en fastoksd protonledende brenselcelle er vst fgur 1.1. Anode Elektrolytt Katode H 2 H + O 2 H 2 O e - Fgur 1.1 Prnsppsksse av en protonledende brenselcelle. En protonledende brenselcelle fungerer ved at hydrogengass oksderes tl protoner og elektroner på anoden, protonene går gjennom elektrolytten og elektronene går en ekstern krets. Det er denne eksterne kretsen elektronene kan benyttes tl elektrsk arbed. På katoden reduseres oksygengass av elektronene som kommer fra den eksterne kretsen. Tl slutt reagerer protonene med oksygenoner og danner vann. Den totale reaksjonen en hydrogen/oksygen brenselcelle vl være H 2 (g) + ½O 2 (g) = H 2 O(g) (1.1) 1.2 Ammonakk Hydrogen benyttes som brensel de fleste brenselcellene, men hydrogenproduksjon, lagrng og opprettelsen av en nfrastruktur utgjør store utfordrnger det kommende hydrogensamfunnet. Mye av brenselcelleforsknngen dag er derfor rettet mot bruken av naturgass som hydrogenbærer for å unngå de nevnte problemene med rent hydrogen. Med tanke på mljøet vl kke denne løsnngen være den deelle, speselt for drvhusproblematkken. 1
11 En annen løsnng kan være å benytte ammonakk som brensel. Ammonakk vl, ved relatv høy temperatur, dekomponere ved følgende reaksjonslknng 2NH 3 (g) = 3H 2 (g) + N 2 (g) (1.2) Denne reaksjonen, sammen med reaksjonen lknng (1.1) vl g totalreaksjonen for bruken av ammonakk og oksygen som brensel en brenselcelle 2NH 3 (g) + 3/2O 2 = N 2 (g) + 3H 2 O(g) (1.3) Ved å forbrenne ammonakk en protonledende brenselcelle vl avgassene bestå av N 2 og H 2 O, og mulgheten for dannelsen av NO x mnskes. Ren ammonakk kan, ved et beskjedent trykk, enkelt kondenseres ved romtemperatur og er derfor enkelt å transportere og lagre sammenlknet med hydrogen. En relatv nylg evaluerng av hydrogen fra ammonakk tl bruk brenselcelle er rapportert [1, 2]. Det er relatvt få studer av høytemperatur brenselceller der ammonakk er brukt som brensel. Farr og Vayenas rapporterte 198 bruken av ammonakk en oksygenoneledende brenselcelle med YSZ (yttrum-stablsert zrkona) som elektrolytt hvor de fkk NO som det prmære oksdasjonsproduktet [3]. Nylg rapporterte McFarlan et al. [4] en relatvt høy ytelse for en protonledende brenselcelle med Gd-dopet BaCeO 3 som elektrolytt og ammonakk som brensel. 1.3 Elektrolytt- og elektrodematerale Oksder er det aktuelle elektrolyttmaterale SOFC. Mange av dsse oksdene er nokså basske forbndelser, for eksempel BaCeO 3 og SrCeO 3. Denne basske karakteren gjør at slke oksder vanskelg kan benyttes for fossle brensel der CO 2 er et av reaksjonsproduktene. For den basske gassen ammonakk, kan slke elektrolytter ha et stort brukspotensal. BaCeO 3 og SrCeO 3 har på grunn av deres høye protonlednngsevne temperaturntervallet 6-1ºC, bltt relatvt grundg studert. Mekansmen for nkorporerng og transport av protoner gjennom oksdene er avhengg av blant annet temperatur og atmosfære, og kan beskrves ved deres defektkjem. For elektrodene en brenselcelle er det flere krav, de må være, ) elektronsk ledende, ) porøse slk at reaktanter og produkter kan transporteres tl og fra elektrolytten og ) termsk og kjemsk kompatble med elektrolytten. Kravene gjør at valget av elektrodematerale ofte er vesentlg for ytelsen tl brenselcellen. Et mye benyttet anodematerale oksygenoneledende brenselceller er cermetelektroder (cer-met; keram-metall). For protonledende høytemperatur brenselceller er bruken av slke cermetelektroder studert av blant annet Mather et al. [5]. For ammonakkbrenselceller vl en slk cermetelektrode med N også fungere katalytsk mot dekomponerngen av ammonakk. Studer av cermetelektrode mot ammonakkbrenselceller er ukjent. 2
12 1.4 Målet med oppgaven Målet med denne oppgaven var å se hvordan en høytemperatur protonledende brenselcelle fungerer hydrogen og ammonakk. Hydrogenbrenselcellen ble studert for å sammenlkne resultater fra ltteratur og resultater fra ammonakkbrenselcellen. AC-mpedansspektroskop ble benyttet for stude av elektrolytt og elektrodene ved åpen cellespennng (OCV). Sammen med strømtetthet/spennngsmålnger, gjorde karakterserngen det mulg å s noe om hvordan brenselcellen fungerer ved varere temperatur og atmosfære. Det ble benyttet to elektrolyttmateraler 1 % Y-dopet BaCeO 3 (BCY) og 5 % Yb-dopet SrCeO 3 (SCYb) hydrogenbrenselcellen for å se på forskjellen mellom dem. I tllegg ble det studert elektrodempedansen tl en N-SCYb cermetelektrode hydrogen og ammonakk, for å se på hvordan motstanden en slk elektrode er forhold tl Pt-elektroden som ble benyttet brenselcellene. Det var tenkt at en brenselcelle med en cermetelektrode skulle karakterseres, men et vdere arbed er nødvendg for å tlpasse en slk elektrode tl brenselcellebruk. 3
13 2 Teor Høytemperaturbrenselceller har de sste 2 årene vært av høy nteresse. Dsse brenselcellene opereres ved 6-1 ºC, hovedsaklg for å oppnå en høy lednngsevne fra elektrolytten og delvs for å øke elektrodeknetkken. Keramer basert på SrCeO 3 og BaCeO 3 har en betydelg protonlednngsevne en atmosfære som nneholder hydrogen ved høy temperatur. Denne lednngsevnen kommer fra en transport av protoner gjennom elektrolytten som vesentlg er avhengg av defektstuasjonen og strukturen tl det aktuelle materalet. Et kjemsk potensal, som kommer fra oksdasjonen av hydrogen og reduksjonen av oksygen, er den drvende kraften for protontransport gjennom elektrolytten. Det er dette potensalet som gr cellespennngen tl brenselcellen. Sden defekter er avgjørende for protontransporten er kunnskap om defektkjemen tl materalet vktg. 2.1 Defektkjem Defekter krystallnske materaler En perfekt krystall kan defneres som en krystall der alle atomene er ro ved deres gtterpossjoner krystallstrukturen. En krystall kan bare oppnå denne tlstanden, hypotetsk, ved K. Ved alle andre temperaturer har krystaller defekter. Defekter kan hovedsak deles nn to grupper: støkometrske defekter der sammensetnngen krystallen er konstant, og kke-støkometrske defekter, der defektene kommer fra en endrng sammensetnngen. Alternatvt kan størrelsen og formen på defekten brukes tl å klassfsere defektene. Dersom defekten er begrenset tl en strukturell- eller gtterplass, kalles defekten en punktdefekt. En punktdefekt kan være en vakans, et ntersttelt atom eller et fremmedatom. Vdere fnnes det lnjedefekter, dslokasjoner, som er punktdefekter en dmensjon og plandefekter som kan gå over hele lag en krystall. De tl nå nevnte defektene er strukturelle defekter. En krystall kan også nneholde elektronske defekter, det vl s elektroner og hull som relatvt frtt kan bevege seg nne krystallen. Elektronske defekter kan enten dannes gjennom en ntern ekstasjon av valenselektroner eller de kan dannes assosasjon med punktdefekter. Gjennom å beskrve punktdefektene og de elektronske defektene en krystall, som en funksjon av aktvteter tl komponentene og temperatur, er det mulg å s noe om defektstrukturen tl komponenten. Denne beskrvelsen er nyttg det at den kan redegjøre for en rekke egenskaper tl forskjellge materaler. For å øke mengden defekter, eller tvnge frem en bestemt defekt et materale, tlsettes små mengder av andre grunnstoffer. Dsse grunnstoffene må ha en annen oksdasjonstlstand enn de som er der fra før av. Defekter må dermed dannes for å opprettholde ladnngsnøytralteten. Denne metoden for å danne defekter kalles dopng. 4
14 2.1.2 Kröger-Vnk notasjon For å kunne s noe om egenskaper, som er avhengg av forekomsten defekter tl uorganske materaler, er det bltt utvklet systemer for å beskrve konsentrasjonene av de forskjellge defektene ved forskjellge tlstander. Den dag mest benyttede notasjonen er utvklet av Kröger og Vnk, og beskrver systemet ved å se på ladnngen tl defekten relatvt tl den perfekte krystallen. Et eksempel kan være dannelsen av en oksygenvakans. Dette skjer ved at et oksygenatom fra en normal plass blr tatt ut av krystallen. Ved denne prosessen vl det bl to negatve ladnnger, to elektroner fra oksygenet, gjen nne krystallen. Dersom begge dsse elektronene er lokalserte ved oksygenvakansen, vl ladnngen være den samme som en perfekt krystall. En nøytral oksygenvakans skrves. Her betyr V vakans, O på oksygenplass og X effektvt nøytralt ( forhold tl den perfekte krystallen). Dersom de to elektronene blr med oksygenet ut av krystallen vl vakansen få dobbel postv effektv ladnng, og skrves V O X V O. Her betyr V og O det samme som forrge eksempelet, mens forteller at defekten har to postve effektve ladnnger. Notasjonen ved en negatv effektv ladnng betegnes med en strek, /. Tabell 2.1 Kröger-Vnk notasjon for noen utvalgte defekter. Defekt Kröger-Vnk notasjon Elektron / e Elektronhull Oksygenvakans h Oksygen ntersttelt // O Yttrum på cerumplass / Y Ce Cerum på barumplass V O Ce Ba Konsentrasjon av defekter betegnes ved bruk av klammeparenteser rundt symbolet bortsett fra for elektroner og hull, der konsentrasjonen betegnes ved n (elektroner) og p (hull). Ved beskrvelsen av et perfekt gtter defektlkevekter blr det noen ganger benyttet eller nl. Dannelsen av defekter kan enten skje nternt materalet eller gjennom en reaksjon med omgvelsene. For defektreaksjoner må det som en vanlg kjemsk reaksjon taes hensyn tl at en del forhold må opprettholdes, som massebalanse og elektronøytraltet. I tllegg må det for en defektreaksjon også taes betraktnng at forholdet mellom antall regulære gtterplasser opprettholdes. Dsse reglene kan summeres som følger: Massebalanse: Defektreaksjonen må balanseres med hensyn på masse, dvs. antall atomer som er nvolvert reaksjonen må være det samme før og etter dannelsen av defekter. Vakanser og elektronske defekter regnes som masseløse og taes kke med massebalansen. 5
15 Elektronøytraltet: Den totale effektve ladnngen må være den samme før og etter dannelsen av defekter, med en perfekt krystall som referanse. Forholdet mellom antall regulære gtterplasser: Antallet regulære katon- og anonplasser et krystallnsk materale er konstant, dvs. hvs det dannes eller fjernes 3 anonplasser oksdet M 2 O 3 må det dannes eller fjernes 2 katonplasser tllegg. Intersttelle plasser regnes kke som gtterplasser Termodynamkk for defekter Krystaller er kke perfekte ford tlstedeværelsen av defekter opp tl en vss konsentrasjon gr en reduksjon Gbbs energ. For at en defekt skal dannes kreves det en bestemt mengde energ, entalp, H. Dannelsen av den samme defekten gr en betydelg øknng entrop, S, dersom antall possjoner som defekten kan okkupere er mange. I en krystall som nneholder 1 mol katoner, vl det være ~ 1 23 mulge possjoner. Entropen som kommer fra dette antallet av valgbare possjoner kalles konfgurasjonell entrop, S konf, og er gtt ved Boltzmanns formel S konf = k ln W (2.1) hvor sannsynlgheten, W, er proporsjonal med ~ Entalpen for å danne defekten gr et mndre postvt bdrag tl Gbbs energ enn det negatve bdraget fra entropen. Konsekvensen av dette er at Gbbs energ mnker gjennom lknngen G = H T S (2.2) G er forandrng Gbbs energ, H er forandrng entalp og S er forandrng entrop, for en reaksjon. Entalpendrngen kommer fra to bdrag: den allerede nevnte konfgurasjonelle entropen S konf, og en vbrasjonell entrop, S vb, som kommer fra endrngen vbrerngsmodusen tl atomene som lgger rundt vakansen. Dersom v tar utgangspunkt en perfekt krystall med N atomer og lar det bl dannet n v vakanser, ved at atomer på gtterplassene bulk dffunderer tl overflaten av krystallen, blr det totale antall plasser N + n v. Forandrngen Gbbs energ kan nå uttrykkes v ( H T Svb ) T Skonf G = n (2.3) I henhold tl statstsk termodynamkk kan det vses at W fra lknng (2.1), som representerer antall forskjellge måter n v vakanser kan fordeles på N + n v gtterplasser, gr S konf N + n v = k ln (2.4) N!n! v 6
16 For store N og n v kan en benytte seg av Strlngs approksmasjon (ln x! = x ln x x for x>>1) og lknng (2.4) blr da N + n v N + n v S = + konf k N ln n v ln (2.5) N n v G Ved lkevekt vl G være ved mnmum med hensyn tl n v, dvs. =. Ved å sette lknng n (2.5) nn lknng (2.3), derverer og la den være lk null får v v G = H T S n v vb n v + kt ln N + n v = (2.6) der n v N + n uttrykkes v representerer andelen tomme plasser blant N + n v, gtterplasser. Andelen kan nå n v Svb H = exp exp N + n k kt v (2.7) Sden dannelsen av vakanser kan skrves E E = v E + E E, hvor E E er et atom E på en E plass og v E er en vakans på E plass, kan lkevektskonstanten, følge massevrknngsloven, uttrykkes n v Svb H K v = [ v E ] = = exp exp (2.8) N + n k kt v der [v E ] er vakanskonsentrasjonen. Ved enhver temperatur T > vl alle faste stoffer følge lknng (2.8) nneholde punktdefekter. Fgur 2.1 vser endrngen entalp, entrop og Gbbs energ mot konsentrasjonen av vakanser et fast stoff. 7
17 Energ n H G -nt S vb -T S konf n Fgur 2.1 Skjematsk llustrasjon som vser varasjon entalp, vbrasjonell og konfgurasjonell entrop samt Gbbs energ som funksjon av vakanskonsentrasjonen. Lkevekt oppnåes når Gbbs energ er ved et mnmum med hensyn på antall vakanser Termodynamkk for reaksjoner I kjemske reaksjoner ved lkevekt, som nneholder to eller flere bestanddeler, er det praktsk å ntrodusere begrepet partell molar Gbbs energ. Dersom et system nneholder n 1 + n n mol av bestanddelene 1, 2,.og, vl den partelle molare Gbbs energ for den bestanddel være gtt ved G µ = n (2.9) p, T, n, n der µ er det kjemske potensalet. Gbbs energ for et system er gtt ved G = n µ (2.1) 1µ 1 + n 2µ n Ved en kjemsk reaksjon, vl G endre seg tlsvarende tl forandrngen av bestanddelene. For et system med konstant temperatur og trykk, kan forandrngen Gbbs energ ved lkevekt uttrykkes dg T, p = µ dn = (2.11) 8
18 I en kjemsk reaksjon, for eksempel, aa + bb = cc + dd (2.12) vl endrngen Gbbs energ være gtt ved den totale energen av produktene subtrahert reaktantene G = cµ + dµ (aµ + b ) (2.13) C D A µ B I en blandng kan det kjemske potensalet tl en bestanddel, skrves µ =µ + RT ln a (2.14) hvor a er aktvteten tl en bestanddel blandngen og µ er det kjemske potensalet av bestanddelen ved en valgt standardtlstand. Ved å sette lknng (2.14) nn lknng (2.13) gr det a a c d C D G = G + RT ln (2.15) a b a A a B der G er standard fr energ. Ved lkevekt er G = og RT ln K = G = H T S (2.16) der K er en konstant gtt ved c d a C a D K = a b a A a (2.17) B lkevekt K er lkevektskonstanten og relaterer aktvtetene av produktene og reaktantene når lkevekt er nådd ved en gtt temperatur. Lknng (2.16) kan uttrykkes på formen G K = exp RT = S exp R H exp RT (2.18) Dette gjelder for alle systemer lkevekt uavhengg av aggregattlstanden tl komponentene. I et deelt system kan konsentrasjoner benyttes stedet for aktvteter. For punktdefekter defektkjemen er det vanlg å anta at stuasjonen er deell. 9
19 2.1.5 Temperaturavhenggheten tl defekter På samme måte som andre lkevekter, vl defektlkevekter ha en lkevektskonstant som forandrer seg med temperatur, lknng (2.18). Denne lknngen kan uttrykkes H K = K exp (2.19) RT S hvor K = exp. Ved å skrve om lknng (2.19) kan lkevektskonstanten beskrves som R funksjon av nvers temperatur d ln K d 1 T H = R (2.2) Denne lknngen kalles Van t Hoffs lknng. Dersom ln K plottes mot nvers temperatur er H stgnngstallet tl kurven. På samme måte som varasjoner oksygenpartaltrykket gr R overganger mellom forskjellge defektstrukturer, kan varasjoner temperatur også føre tl en overgang fra en defektstruktur tl en annen Elektronske defekter Ved romtemperatur er mange uorganske forbndelser solatorer, dvs. materaler med stor elektrsk motstand. Noen av de samme forbndelsene blr halvledende ved 3-5ºC og oppover. I dsse forbndelsene er det et forbudt energgap mellom valensbåndet og lednngsevnebåndet, båndgapet E g. Størrelsen på båndgapet varerer med forbndelsene. Båndgapet er forbudt på grunn av at et enkelt atom vl elektronene bare kunne okkupere dskrete energnvåer, de vl kke kunne eksstere samme energtlstand (Ferm-Drac statstkk). Et energnvå kan bare okkuperes av to elektroner som har motsatt spnn om elektronaksen (Pauls eksklusjonsprnspp). Når de enkelte atomene brnges sammen et fast stoff, vl det skje en splttng av energnvåene, dsse nvåene danner energbånd det faste stoffet. Energbåndene kan overlappe eller være avgrenset ved et energgap. Elektronene vl alltd fylle nvåer med lavest energ først. Ved K kalles det høyeste fylte nvået Fermnvået. Når et elektron eksteres fra valensbåndet en halvleder over det forbudte båndgapet tl lednngsevnebåndet kalles det ntern ekstasjon. Elektronene lednngsevnebåndene og elektronhullene (de kke-okkuperte elektronplassene valensbåndene) vl kunne bevege seg et elektrsk felt. Elektronhullene vl bevege seg motsatt retnng av elektronene som om de hadde èn postv elementærladnng. Fordelngen av elektroner og elektronhull mellom vakansog lednngsevenbåndet er gtt ved klasssk statstkk (Boltzmann approksmasjonen) 1
20 E C E F n = N C exp (2.21) kt E F E V p = N V exp (2.22) kt N C og N V representerer antall tlstander henholdsvs lednngsevnebåndet og valensbåndet, E F er Fermenergen. E C og E V er henholdsvs laveste energnvået lednngsbåndet og høyeste energnvået valensbåndet. Intrnsk onsasjon vl domnere et støkometrsk oksd og kan sammen med lknng (2.27) beskrves ved E g K = = n p N C N V exp (2.23) kt der E g = E C E V. E g kan sees på å være entalpen tl den ntrnskke onsasjonen Akseptor- og donordopng Under syntese av et materale er det svært vanskelg å unngå at den endelge sammensetnngen kke vl nneholde fremmede oner. Ofte blr fremmede oner ntrodusert et materale med vlje, for eksempel for å styrke de elektrske egenskapene tl materalet. Alovalente fremmede oner kan avhengg av ladnngen, enten ta elektroner fra valensbåndet eller donere elektroner tl lednngsbåndet. Laverevalente oner tar som regel lett opp elektroner fra valensbåndet og kalles derfor akseptorer A / = A + h (2.24) Energen som skal tl for at en akseptor skal ta opp et elektron er mye mndre enn energen som tlsvarer båndgapet mellom valensbåndet og lednngsevnebåndet. Dermed trenger elektronene valensbåndet mndre energ for å onsere de laverervalente katonene enn de trenger for å hoppe opp lednngsbåndet (se fgur 2.2). Elektronene som blr tatt opp av akseptoren er lokalsert og vl dermed kke bdra tl lednngsevnen, men vl få en lednngsevne gjennom hullene som har bltt dannet valensbåndet. De oksdene som er domnert av elektronhull valensbåndet kalles p-ledere. Høyerevalente oner vl som regel lett g fra seg elektroner tl lednngsevnebåndet og blr dermed kalt donorer X D = D + e / (2.25) Dsse oksdene får et overskudd av elektroner lednngsbåndet og blr derfor kalt n-ledere (se fgur 2.2). 11
21 Lednngsbåndet (tomt) E C e - e - e - e - e - e - e e - Donornvå, E D E g = E C - E V Akseptornvå, E A e - e - e - E V Valensbåndet (fullt) Fgur 2.2 Båndmodell for akseptor- og donordopete materaler 2.2 Defekter BaCeO 3 og SrCeO 3 For de to materalene som benyttes denne oppgaven er det antatt at de har den samme typen domnerende defekter. De vktgste defektene for dsse materalene er oksygenvakanser ' ' ( V O ), protoner ( OH O ) og treverdg dopng på B plass ( Ce og YbCe for henholdsvs BaCeO Y 3 og SrCeO 3 ). På grunn av lkheten mellom de to materalene vl derfor bare defektkjemen for et av materalene behandles. Der det er ulkheter, vl begge materaler omtales Intrnsk defektstuasjon. I rent BaCeO 3 og SrCeO 3 vl det bare være ntrnskke defekter. Slke tertære oksder vl ha en rekke mulge ntrnskke defekter. De vanlgste og mest sannsynlge strukturelle defektene vl bl forklart senere kaptler. Dannelsen av elektronske defekter kan skje ved ntrnsk ekstasjon av elektroner. Denne ekstasjonen fører også tl at det blr dannet elektronhull valensbåndet. Totalt kan dette uttrykkes / = e + h K = n p (2.26) (2.27) 12
22 2.2.2 Støkometrske oksder En defektstruktur vl nneholde ekvvalente konsentrasjoner av negatvt og postvt ladede punktdefekter. Punktdefektene dannes på grunn av en ndre lkevekt krystallen og nvolverer derfor kke reaksjoner med omgvelsen. De to vktgste defektstuasjonene for punktdefekter støkometrske oksder er Schottky- og Frenkeluorden. Uorden tlsvarer at defekter er tlstedet. Et Schottky defektpar nvolverer en transport av katoner og anoner fra en regulær gtterplass bulk tl overflaten. I realteten har defektene bltt dannet ved eksterne og nterne overflater eller dslokasjoner ved så å dffundere nn krystallen tl de er vlkårlg fordelt. For BaCeO 3 vl det bl dannet to katonvakanser og tre anonvakanser // //// = VBa + VCe + 3VO (2.28) For Frenkeluorden er de domnerende defektene enten begrenset tl katoner eller anoner. Uordenen nvolverer tlstedeværelse av et lkt antall vakanser og ntersttelle oner undergtteret en krystall. Slke defekter kan dannes drekte nne krystallen. Dersom defekten nvolverer et katon kalles det katon Frenkeluorden, ved anon, anon Frenkeluorden. I BaCeO 3 vl det være tre mulge Frenkeluordner. Ba Frenkel (katon Frenkeluorden) Ba x // Ba = VBa + Ba (2.29) Ce Frenkel (katon Frenkeluorden) Ce x //// Ce = VCe + Ce (2.3) og O Frenkel (anon Frenkeluorden) O = V + O x O O // (2.31) Det vl SrCeO 3 og BaCeO 3 alltd fnnes både Schottky- og Frenkeluorden. Sden det for perovskttstrukturen er svært usannsynlg at det dannes ntersttelle oner, de trenger en mer åpen struktur, er det Schottkyuordenen som er den mest domnerende defekten de to ceratene Katon kke-støkometr For ternære oksder er det mulg med en kke-støkometr mellom de to katonene. Dersom det er energsk gunstg at det er et underskudd på A-plass forhold tl et overskudd på B-plass en forbndelse ABO 3, kan det ved høye temperaturer skje en avdampnng av A komponenten. For BaCeO 3 vl dette skje på følgende måte 13
23 Ba + O = V + V x x // Ba O Ba O + BaO(g) (2.32) I følge Glöckner et al. [6] er reaksjonen over den mest energsk gunstge ntrnskke defektstuasjonen BaCeO 3 ved høye temperaturer. Et overskudd på A-plass kan komme som følge av følgende reaksjon Ce + 2O = V + 2V + CeO x Ce x O //// Ce O 2 (2.33) Lkevekter med hydrogen BaCeO 3 og SrCeO 3 er rapportert å være protonledende ved hydrogenholdge atmosfærer et temperaturntervall fra 6-9ºC. Sden oksdene kke nneholder hydrogen støkometrsk, må hydrogen løse seg materalet. Mengden hydrogen som løser seg er generelt avhengg av defektstrukturen av oksdet og oksygen/hydrogen aktvtetene. Hydrogenet kan komme fra vanndamp, hydrogengass eller andre forbndelser som nneholder hydrogen, som for eksempel ammonakk. Dersom man ønsker å studere løselgheten av hydrogen er det derfor nødvendg å kontrollere både hydrogen (eller vanndamp) og oksygen aktvtetene. I oksder er det vanlgste observerte hydrogenet form av protoner, ofte kalt ntersttelle protoner, realteten er protonene alltd tlknyttet tl oksygenoner som hydroksdgrupper. Dersom oksygenonet stter på en regulær gtterplass, får v en substtusjonell hydroksddefekt, OH O. Løselgheten av protoner oksder skrves H. I H + x / 2 (g) + 2OO = 2OH O 2e (2.34) Dersom man antar at vann og hydrogen er lkevekt gjennom H 2 + ½ O 2 = H 2 O, kan defektreaksjonen skrves med vann som klden av protoner x / H 2 O(g) + 2OO = 2OH O + 2e + 1 2O 2 (g) (2.35) Den korresponderende defektlkevekten blr K [ OH ] n p 1 p = (2.36) OH O O2 H2O O Konsentrasjonen av protoner metalloksder er avhengg av partaltrykkene tl oksygen, vanndamp og konsentrasjonen av elektronske defekter. 14
24 2.2.5 Dopng Som tdlgere nevnt, blr ofte fremmedoner tlsatt for å fremme ønskede egenskaper tl materalet. Denne bevste dopngen skjer ved at et on med omtrent samme onske radus og forskjellg ladnng byttes ut. Perovsktter har en struktur som lett substtuerer oner da krystallgtteret er svært stablt. I BaCeO 3 kan Ba eller Ce atomene substtueres med enten høyerevalente eller laverevalente oner og danne en fast oppløselghet. I denne oppgaven er det både for BaCeO 3 og SrCeO 3 benyttet akseptordopng på Ce plass: 1 % Y BaCeO 3 og 5 % Yb SrCeO 3. Sden Ce er IV-verdg og de to dopantene er III-verdg, vl dopngen føre tl en øknng av specer med effektv negatv ladnng. Dsse ladnngene kan blant annet kompenseres med oksygenvakanser 1 2Y O (2.37) X / X BaO= Ba Ba + YCe + 5 2OO + 1 2VO 1 2Yb (2.38) X / X 2O3 + SrO = Sr Sr + YbCe + 5 2OO + 1 2VO Ved en donordopng, vl kompenserngen kunne skje ved dannelsen av metallvakanser, for eksempel La på Sr plass 2 La + X X //// 2O3 + 3CeO 2 = 4La Sr + 3CeCe + 12O O VCe (2.39) eller ved elektroner, for eksempel Nb på Ce plass X X / Nb 2 O3 + 2BaO= 2NbCe + 2Ba Ba + 6OO + 2e + 1 2O 2 (g) (2.4) Konsentrasjon av defekter som funksjon av oksygenpartaltrykk Konsentrasjon og type defekter vl som tdlgere nevnt være avhengg av betngelser omgvelsene, som temperatur og gass-sammensetnng. For å beskrve defektstuasjonen et materale er det derfor vanlg å plotte konsentrasjoner av defekter mot en betngelse. Et slkt dagram kalles et Brouwer-dagram. Konsentrasjonen av defekter vl varere som funksjon av oksygenpartaltrykk. Denne avhenggheten kan plottes Brouwer-dagrammet ved å løse defektlkevektene de forskjellge oksygenpartaltrykkområdene. Dagrammet kan deles opp tre områder. Ved tlstrekkelg lave oksygenpartaltrykk vl kke konsentrasjonen av dopngen være bestemmende for konsentrasjonen av de ulke defektene materalet. I dette ntrnskke området beregnes konsentrasjonen av de ulke defektene som om materalet var udopet. Den totale elektronøytralteten for defekter med hensyn på økende oksygenpartaltrykk vl være 15
25 / [ Y ] = p + 2[ V ] n (2.41) + Ce O Dannelsen av en oksygenvakans skjer ved at et oksygenatom på en regulær gtterpossjon går over gassfase X / OO = VO + 2e + 1 2O 2 (g) K [ V ] n P O O VO 2 (2.42) = (2.43) Ved lave oksygenpartaltrykk kan man anta at defektstrukturen er domnert av de to defektene lknngen over, elektronøytralteten kan dermed forenkles [ V ] n 2 O = (2.44) Settes denne lknngen nn lknng (2.43) vl oksygenavhenggheten tl dsse to defektene være gtt ved 1 6 [ ] = K p n = 2 V (2.45) O V O2 O Dannelsen av elektronske defekter er gtt ved lknng (2.27) og kombneres denne lknngen med lknng (2.44), vl oksygenavhenggheten tl konsentrasjonen av hull være gtt ved p K n K K 1 6 = = p O (2.46) V O 2 I det ekstrnsske området er det konsentrasjonen av dopngen som angr størrelsen på de ulke konsentrasjonene. Dopngen av BaCeO 3 med det laverevalente katonet yttrum (Y) form av oksdet Y 2 O 3 er gtt lknng (2.37). Lknngen vser at oksygenvakanser er den kompenserende defekten. Den forenklede elektronøytralteten kan skrves / [ ] = 2[ V ]= Y konstant (2.47) Ce O Kombnert med lknng (2.44) blr oksygenavhenggheten av elektronene 1/ 2 V K n = 2 p (2.48) O / [ Y ] Ce 1/ O2 Konsentrasjonen av elektronhull under dsse betngelsene vl være gtt ved kombnasjonen av lknng (2.27) og (2.48) 16
26 / 2 [ Y ] 1/ 1 4 p = K 2 p (2.49) Ce 1 2 O2 K VO Ved et økende oksygenpartaltrykk vl konsentrasjonen av elektronhull øke med 1/ 4. Elektronøytralteten kan dermed etter hvert forenkles tl [ Y ] / Ce = p = konstant (2.5) p O2 Ved å kombnere lknngen over med lknng (2.27) får man K K = (2.51) p n = / [ Y ] Ce der konsentrasjonen av de elektronske defektene vl være uavhengg av oksygenpartaltrykket. Konsentrasjonen av oksygenvakanser får man ved å løse lknng (2.27) med hensyn på konsentrasjonen av oksygenvakanser, lknng (2.43) og å benytte den forenklede elektronnøytralteten fra lknng (2.5) K = (2.52) V 2 O / 1/ 2 [ V ] [ Y ] p O 2 Ce O2 K Defektstuasjonen med hensyn på varerende oksygenpartaltrykk kan ved lknngene over nå beskrves et Brouwer-dagram, fgur
27 n= 2[V O ] / [ YCe ] = 2[VO ] p = [Y / Ce ] n 1 / 6 p O 2 / [ Y Ce ] log [defekter] 1 / 6 1 / 2 [ V ] p [ V ] p O O 2 1 / 6 p p O 2 1 / 4 p n 1 / 4 p O 2 p O 2 O O 2 log p O2 Fgur 2.3 Brouwer-dagram for konsentrasjonen av defekter med hensyn på oksygenpartaltrykket Konsentrasjon av defekter som funksjon av vanndamppartaltrykket Type og mengden av defekter vl som vst foregående kapttel være avhengg av oksygenpartaltrykket. På samme måten vl defektstuasjonen endre seg ved en forandrng vanndamppartaltrykket. For enkelthetens skyld holdes partaltrykket av oksygen konstant, mens vanndamppartaltrykket økes. Protoner løses oksder ved lknng (2.34) og (2.35). Lknngen for løselgheten av protoner de aktuelle oksdene kan skrves ved et forbruk av oksygenvakanser, gjennom en kombnasjon av lknng (2.35) og lknng (2.42) H 2O(g) OH X + VO + OO = 2 O (2.53) Den korresponderende defektlkevekten blr da K 2 [ OH O ] [ V ] = p (2.54) 1 hydr H2O O der K hydr er lkevektskonstanten for hydratserngen. Den totale elektronøytralteten for defekter med hensyn på økende vanndamppartaltrykk vl være ' [ Y ] + n = [ OH ] + 2[ V ] p Ce O O + (2.55) 18
28 I en tørr atmosfære antas det at dopanten prmært blr kompensert ved dannelsen av oksygenvakanser gjennom lknng (2.47). Vanndamptrykk-avhenggheten tl hydroksddefekter [ ] OH fåes ved å kombnere lknng (2.47) med (2.54) O 2 2 / 2 2 [ OH ] = 2 [ ] 1/ K 1/ Y 1/ p 1/ (2.56) O hydr Ce H2O I dette partaltrykkområdet vl både konsentrasjonen av hull og elektroner være uavhengge av vanndamppartaltrykket sett fra lknng (2.48) og (2.49). Konsentrasjonen av hydroksddefekter vl øke med økende dermed etter hvert forenkles / [ OH ] = [ ] O Y Ce p H2 O. Elektronøytralteten kan (2.57) Ved høye vanndamppartaltrykk vl defektstuasjonen være domnert av dsse to defektene. Settes lknng (2.57) nn lknng (2.54) vl oksygenvakansavhenggheten være gtt ved [ V ] / 2 [ Y ] 1 Ce = p H O (2.58) K hydr O 2 En kombnasjon mellom lknng (2.43) og (2.57), vl g avhenggheten av vanndamppartaltrykket tl elektronkonsentrasjonen 1/ 2 1/ 2 K K V hydr n = p p (2.59) O / [ Y ] Ce 1/ 4 O 2 1/ 2 H O 2 Konsentrasjonen av elektronhull vl da være gtt ved lknng (2.27) kombnasjon med lknngen over p K K / [ Y ] 1/ 4 1/ 2 Ce = = p 1/ 2 1/ 2 O p 2 H2O (2.6) n K K V hydr O Lknngene (2.53) tl (2.6) vl nå kunne benyttes tl å konstruere et Brouwer-dagram (fgur 2.4) med et økende nnhold vanndamppartaltrykk mot konsentrasjonen av defekter. 19
29 / / [ YCe ] = 2[VO ] [ YCe ] = [ OH O ] / [ Y Ce ] log [defekter] 1 / 2 [ OH ] p O H 2O 1 [ V ] p O H 2O 1 / 2 n p H 2 O p 1 / 2 p H 2 O log p H2 O Fgur 2.4 Brouwer-dagram med konsentrasjonen av defekter med hensyn på vanndamppartaltrykket Defektkonsentrasjonen som funksjon av temperatur På samme måte som man kunne få overgang fra en defektstruktur tl en annen ved å varere partaltrykket av H 2 O og O 2, kan en slk overgang forekomme som funksjon av temperatur. Konsentrasjonen tl den domnerende defekten som funksjon av temperaturen fnnes ved nnsettng av den respektrve lkevektskonstanten lknng (2.19) og å holde andre varabler konstante. Ved høye temperaturer vl den domnerende defektstrukturen kunne beskrves av lknng (2.56). Fra denne lknngen ser v at konsentrasjonen av protoner er proporsjonal med 1/ 2 K hydr. Temperaturavhenggheten er da gtt ved H 1/ 2 1/ 2 hydr [ ] OH K = (K ) exp hydr hydr 2RT O (2.61) der (K ) 1/ 2 hydr nneholder entropleddet. Entalpen for nkorporerngen av protoner er negatvt og fører tl at protonkonsentrasjonen vl avta dette området. Ved lavere temperatur vl protonkonsentrasjonen nå dopngnvået og bl den domnerende landngskompenserende defekten. Defektstrukturen kan da beskrves ved lknngene (2.58) tl (2.6). Mens konsentrasjonen av protoner er konstant dette området vl konsentrasjonen av oksygenvakanser avta med 1 K hydr. Dette gr følgende temperaturavhengghet H 1 1 hydr [ ] V K = (K ) exp hydr hydr RT O (2.62) 2
30 De to nevnte temperaturavhengghetene er vst fgur 2.5. Skfte av defektstruktur er en drekte konsekvens av forandrngen lkevektskonstanten. Lkevekten lknng (2.53) K hydr vl være forskjøvet mot høyre ved lave temperaturer, oksygenvakansene vl fylles gjennom lkevekten med vanndamp atmosfæren. / / [ YCe ] = 2[VO ] [ YCe ] = [ OH O ] / [ Y Ce ] log [defekter] 1/ 2 H hydr [ OH O] H hydr [ V O ] T -1 / K -1 Fgur 2.5 Temperaturavhenggheten tl konsentrasjonen for noen utvalgte defekter 2.3 Dffusjon Dffusjon vl foregå på grunn av tlstedeværelsen av defekter et fast materale, hvor punktdefekter fører tl gtterdffusjon. En stort sett raskere dffusjon enn dffusjonen gtteret vl foregå langs lneære-, planare- og overflatedefekter, som for eksempel korngrenser og dslokasjoner. Det relatve bdraget fra forskjellge typer dffusjon oksder vl være avhengg av temperatur, partaltrykk og/eller aktvteter, mkrostrukturen, kornstørrelsen, porøsteten osv. Dffusjon er vktg med tanke på hvordan og hvor raskt oner beveger seg gjennom et materale. Fluksen ser noe om hastgheten for dffusjonen og kan teoretsk forklares ved Fcks lover Fcks lover Denne første loven fra Fck beskrver fluksen som proporsjonal med en konsentrasjonsgradent planet. 21
31 Fgur 2.6 vser en skjematsk llustrasjon av Fcks 1. lov, hvor det er en konsentrasjonsgradent som er den drvende kraften. c Gradent: dc dx x Fgur 2.6 Skjematsk llustrasjon av Fcks første lov. Fcks 1. lov uttrykkes matematsk ved dc J Partkkel = D (2.63) dx dc der J er fluksen tl partklene, D er dffusjonskoeffsenten og er konsentrasjonsgradenten dx tl partklene. Det negatve fortegnet forteller at partklene beveger seg fra høy tl lav konsentrasjon. Fcks første lov kan utledes ved å se på parallelle plan som er separert ved en avstand s. Konsentrasjonen av partkler hvert plan kan betegnes c 1, c 2 osv. En partkkel et plan kan hoppe tl neste plan med en hoppefrekvens kalt Г. Dersom konsentrasjonen plan 2 er større enn konsentrasjonen plan 1, vl partkkelfluksen kunne uttrykkes ved 1 = (c1 c ) sγ 2 J Partkkel 2 (2.64) Sammenhengen mellom c 1 og c 2 kan ved hjelp av konsentrasjonsgradenten normalt på planet uttrykkes ved dc = c s (2.65) dx c1 2 Den totale strømmen av partkler vl nå bl 22
32 J Partkler 1 2 dc = s Γ (2.66) 2 dx Fra lknng (2.63) er det nå mulg å se at dffusjonskoeffsenten er gtt ved D = ½ s 2 Г. Dette gjelder bare for dffusjon av partkler en dmensjon. Fcks første lov gjelder kun for deelle tlfeller med dffusjon av nøytrale partkler og med en konstant kjemsk konsentrasjonsgradent som eneste drvkraft. I mange praktske tlfeller vl konsentrasjonen og konsentrasjonsgradenten endres over td. Endrngen konsentrasjon per tdsenhet ved en possjon er proporsjonal med gradenten fluks ved den samme possjonen c j = t x (2.67) Selv om konsentrasjonen og konsentrasjonsgradenten endres over td, vl Fcks første lov være gyldg ved én td og possjon. V vl derfor kunne s at c = t j x c = D x x (2.68) Dersom dffusjonskonstanten er uavhengg av konsentrasjonen blr lknng (2.68) c = t j x 2 c = D 2 x (2.69) Lknng (2.68) og (2.69) kalles Fcks andre lov Dffusjonsmekansmer Gtterdffusjon skjer som tdlgere nevnt ved bevegelse av punktdefekter. Type defekt avgjør type dffusjonsmekansme. Vakans Denne typen dffusjon skjer ved at et atom på en normal gtterplass hopper tl en nabolggende vakans. Atomene vl bevege seg motsatt retnng av vakansene. Intersttelt Et atom på en ntersttell plass beveger seg tl en nabolggende ntersttell plass. Denne mekansmen nvolverer en relatvt stor deformasjon av gtteret. Mekansmen er derfor bare sannsynelg når det ntersttelle atomet er lte. En annen mulghet for ntersttell dffusjon skjer dersom forvrdnngen blr for stor, på grunn av for stort atom. Et ntersttelt atom kan 23
33 dytte et av sne nærmeste atomer på normal plass tl en annen ntersttell plass, og selv okkupere den normale plassen Dffusjon av protoner oksder Protoner som løses oksder danner sammen med oksygenoner, hydroksdoner. Protonet har kke elektroner og vl dermed føle en sterk påvrknng av elektronskyen tl oksygenonet. Protonets lkevektspossjon hydroksdonet vl dermed være nne valenselektronskyen. Transportmekansmen for protoner metalloksder er fr proton mekansmen (Grotthuss mekansmen). Denne mekansmen nvolverer en protontransport mellom nærlggende OH - og O 2- orenternger. En mekansme ved OH - dffusjon har tdlgere vært den gjeldende mekansmen. I Grotthuss mekansmen beveger protonet seg ved å strekke oksygen/hydrogenbndngen så mye at det danner en bndng tl et oksygen på en nabogtterpossjon. Sden det er vanskelg for protonet å bryte O-H bndngen på egenhand, trenger det dynamkken tl nabo-oksygenongtteret, slk at hoppet kan skje når OH-O avstanden er på det korteste. Store katoner og et åpent gtter gr oksygenon med stor dynamkk, som perovskttene BaCeO 3 og SrCeO 3, og fører tl at brytngen av O-H bndngen kan skje. En vdere dffusjon krever en rotasjon av protonet rundt oksygenonet, slk at protonet kommer possjon tl å hoppe tl et tredje oksygenon. 2.4 Elektrsk lednngsevne I metalloksder er de elektrsk ladede partklene oner og elektroner. De onske ladnngsbærerne nnebefatter katoner, anoner, og fremmede oner fra forurensnnger og/eller dopng. De elektronske ladnngsbærerne nnebefatter elektroner og hull. Konsentrasjonen av ladnngsbærerne er drekte relatert tl defektstrukturen av oksdet. De fleste oksder er elektronsk ledende, sden moblteten av elektroner og elektronhull normalt er mye høyere enn for oner. Lkevel kan noen oksder bl onsk ledende eller blandet onsk/elektronsk ledende ved vsse temperaturer og oksygentrykk. Ofte er denne lednngsevnen et resultat av dopng med alovalente oner. Noen oksder kan også vse protonlednngsevne hydrogeneller vanndampnneholdende atmosfærer, som for eksempel dopet barumcerat og dopet strontumcerat Transport en elektrsk potensalgradent Kraften som utøves på en ladet partkkel av type, med ladnng z e er gtt ved dφ F= z e = z e E (2.7) dx dφ hvor φ er det elektrske potensal og E = er det elektrske feltet. Fluksen tl en partkkel dx av type er produktet av konsentrasjonen c, moblteten tl partkkelen B og kraften F 24
34 j = c B F= z ec B E (2.71) Strømtettheten er gtt ved produktet av flux og ladnng = z e j = (z e) 2 B c E (2.72) Produktet av moblteten B og ladnngen på hver partkkel, z e, kalles ladnngsbærermoblteten u u = z e B (2.73) Lknng (2.72) kan nå skrves = z ec u E = σ E (2.74) hvor σ = z ec u er den elektrske lednngsevnen fra ladnngsbærere av type. Den totale elektrske lednngsevnen σ total for et stoff er lk summen av de partelle lednngsevnene σ for de forskjellge ladnngsbærerne σ total = σ (2.75) Transporttallet for specet er defnert som forholdet mellom den partelle lednngsevnen σ og totallednngsevnen σ σ t = (2.76) total Ladnngsbærere oksder I bnære og ternære oksder er de vanlge ladnngsbærerne katoner, anoner, elektroner og elektronhull. Den totale lednngsevnen er summen av alle de ndvduelle lednngsevnene σ =σ + σ + σ + σ (2.77) total k a n p Ved bruk av lknng (2.76) kan alle de ndvduelle lednngsevnene uttrykkes ved transporttall σ = t σ σ = t σ σ = t σ σ = t σ (2.78) k k total a a total n n total p p total 25
35 Den totale lednngsevnen kan nå uttrykkes ved transporttallene tl de ndvduelle lednngsevnene σ =σ t + t + t t ) (2.79) total total ( k v n + p Fra lknngen over følger t + t + t + t 1 (2.8) k v n p = Ofte blr den totale lednngsevnen delt opp et elektronsk og onsk bdrag, der og σ on =σ k + σ v. Den totale lednngsevnen blr da σ = σ + σ, el n p σ =σ + σ (2.81) total el on Nernst-Ensten lknngen Nernst-Ensten lknngen vser en sammenheng mellom mobltet og dffusjonskoeffsenten. Under vses noen former av lknngen, kt kt D = B kt = u = σ (2.82) 2 z e c z e 2 og forutsetter vlkårlg dffusjon. Relasjonen gr menng for dffusjon av atomer og oner, men er kun gjeldende for elektronske defekter der transporten er en aktvert hoppeprosess. Det er også forutsatt at oner og elektronske defekter beveger seg uavhengg av hverandre. 2.5 Elektrokjemsk transport Elektrokjemsk potensal I onske meder vl kjemske og elektrske potensaler vrke samtdg. Det er derfor nyttg å kombnere dem tl et elektrokjemsk potensal. For specet vl det elektrokjemske potensalet være η =µ + z eφ (2.83) Den elektrokjemske potensalgradenten blr da dη dx dµ = dx dφ + z e dx (2.84) 26
36 Denne kombnasjonen mellom kjemsk og elektrsk potensal og potensalgradenter danner bassen for teoren av massetransportprosesser som nvolverer ladede specer faste onske materaler. Teoren ble først beskrevet av Carl Wagner, og kalles derfor Wagner-teoren. Teoren kan blant annet s noe om den elektrske spennngen tl en brenselcelle fra partaltrykkene tl brenselet Flukslknnger Wagner teor Denne teoren vl vse hvordan de elektrske potensalene for en brenselcelle har en sammenheng med de kjemske potensalene. En kraft, uttrykt som en gradent et potensal P som vrker på et spece, gr opphav tl en flukstetthet som er proporsjonal tl specets dffusjonskoeffsent D. Ved å anta at potensalet er det elektrokjemske potensalet får v D c dp Dc dη D c dµ dφ j = = = + z e kt dx kt dx kt (2.85) dx dx I lknngen over sees benyttelsen av Fcks første lov, lknng (2.63). Ved å benytte Nernst- Enstens lknng (2.82) er det mulg å bytte ut den vlkårlge dffusjonen med lednngsevnen og få et alternatvt uttrykk for flukstettheten σ dµ dφ j = (2.86) ( ) + z e 2 z e dx dx Dersom specet har en ladnng vl flukstettheten for g opphav tl en partell strømtetthet ved σ dµ dφ = z ej = + z e z e (2.87) dx dx Den totale strømtettheten prøven fåes ved å summere alle de partelle strømtetthetene over alle specene g σg dµ g dφ total = z g ejg = + z ge (2.88) g g z g e dx dx Prøven en brenselcelle vl være koblet tl en ekstern elektrsk krets. For en brenselcelle ved åpen cellespennng vl den totale strømmen være null. For en brenselcelle under belastnng vl dermot strømmen kke være lk null. 27
37 Dersom den totale lednngsevnen (2.75) og defnsjonen av transporttallet (2.76) benyttes kan følgende lknng uttrykkes dφ = dx σ total total g z t g g e dµ dx g (2.89) Denne lknngen relaterer den elektrske potensalgradenten tl den totale strømtettheten og den totale lednngsevnen tllegg tl summen av transporttallet og den kjemske potensalgradenten tl alle ladnngsbærere. Sden det kjemske potensalet for ladede specer kke er godt defnert, må det kjemske potensalet representeres av nøytrale specer. Det antaes derfor en lkevekt mellom de nøytrale og ladede specene og elektronene, det vl s en elektrokjemsk redoks reaksjon z S= S + ze (2.9) S er det nøytrale specet og z kan ha postv og negatv ladnng. Lkevekten for denne reaksjonslknngen kan uttrykkes fra kjemske potensaler for produkter og reaktanter, se lknng (2.13) d µ + zdµ dµ S = S z e (2.91) som vdere kan uttrykkes d µ = dµ S zdµ e S z (2.92) Dette uttrykket settes nn for alle onske specer n lknng (2.89). Ved å benytte får v t = k k 1 dφ = dx σ total total n t n dµ n z e dx n 1 dµ e + e dx (2.93) Det kjemske potensalet refererer nå tl den nøytrale formen for hver bærer. 28
38 2.5.3 Spennngen over en prøve For å fnne spennngen over en prøve, må den elektrske potensalgradenten ntegreres over tykkelsen av prøven II II II II t 1 d e (2.94) σ z e e total n φ= dx dµ n + dµ I I total n I n I φ II II total t n 1 φi = dx dµ n + ( µ e,ii µ σ z e e II e,i ) I total n I n (2.95) Dersom spennngen måles på hver sde ved bruk av det samme nerte materalet, for eksempel platna, vl forskjellen kjemsk potensal for elektronene på de to sdene bl elmnert. Spennngen som måles mellom de to sdene blr dermed II II total t n U II I =φii φi = dx dµ n (2.96) σ z e I total n I n Ved åpen cellespennng vl total =, og v får t = (2.97) n U II I dµ n n z n e Dette uttrykket kan benyttes tl å beregne transporttall basert på åpen cellespennngsmålnger tl en elektrokjemsk celle som eksponeres for veldefnerte gradenter kjemske aktvteter. For brenselceller, der transporttallet for elektrolyttmateralet er kjent, og ofte er én for den onske ladnngsbæreren, kan uttrykket brukes tl å fnne den åpne cellespennngen. Dersom det blr dratt strøm fra en brenselcelle må v vte hvordan total varerer med X. Hvs denne varasjonen er konstant får v II II totalx t n t n U II I = dµ n = total rtotal dµ n (2.98) σ z e z e total n I n n I n hvor X er tykkelsen av prøven og r total er den arealspesfkke motstanden over prøven. total r total kan byttes ut med IR, strøm og prøvemotstanden II t n U II I = I R dµ n (2.99) z e n I n 29
39 Spennngen for en brenselcelle vl dermed nneholde en termodynamsk del, som kommer fra den kjemske gradenten, og en IR del, som kommer fra den elektrske motstanden prøven. For en ren protonleder vl lknng (2.99) bl II =φ φ = 1 U µ II I II I IR d H2 (g) (2.1) 2e I Det kjemske potensalet for H 2 (g) kan uttrykkes µ =µ + kt ln p H2 (g) H2 (g) H2 (2.11) Den derverte av det kjemske potensalet blr d µ = kt d ln (2.12) H (g) p 2 H2 (g) Uttrykket for den rene protonlederen blr nå, ved å ntegrere over tykkelsen av prøven for å oppta spennngen over den, og sette nn uttrykket for det kjemske potensalet II kt U II I = IR d ln p H (2.13) 2 2e I Ved å ntegrere det sste leddet lknngen får v U II kt p I = IR ln (2.14) 2e p II H2 I H2 Ved åpen cellespennng er total =. Lknngen over vl da g den åpne cellespennngen for brenselcellen ved kt p U II I = ln (2.15) 2e p II H2 I H2 3
40 2.6 Elektrokjemsk celle En elektrokjemsk celle består av to elektroder, eller en metallsk leder, kontakt med en elektrolytt. Elektrolytten er oneledende og kan være en løsnng, en væske eller ett fast stoff. En galvansk celle er en elektrokjemsk celle som produserer elektrstet som et resultat av en spontan reaksjon som skjer nne cella. Redoks reaksjoner kan beskrves ved hjelp av to halvcellereaksjoner. Den ene reaksjonen beskrver oksdasjonen, der et eller flere elektroner blr donert av det reduserende specet. Den andre reaksjonen beskrver reduksjonen, hvor et eller flere elektroner blr akseptert av det oksderende specet. H 2 (g) 2e - + 2H + (g) Oksdasjonsreaksjon (2.16) O 2 (g) + 4e - 2O 2- (g) Reduksjonsreaksjon (2.17) Reduksjons- og oksdasjonsreaksjonen danner tl sammen den totale elektrokjemske reaksjonen en celle (lknng (1.1)). De to reaksjonene skjer ved hver sn elektrode. Hydrogenet oksderes på anoden tl protoner og elektroner. Elektronene går gjennom en ekstern krets. Ved katoden vl oksygen reduseres og danne sammen med protoner, vann. I en galvansk celle har katoden et høyere potensal enn anoden. Specet som undergår reduksjonen tar opp elektroner fra elektroden, og står tlbake gjen med en relatv postv ladnng, som korresponderer tl et høyt potensal. Ved anoden fører oksdasjonen tl en frgjørng av elektroner tl elektroden, som gjør at anoden får en relatv negatv ladnng, som korresponderer tl et lavt potensal. En celle, hvor den totale reaksjonen kke er kjemsk lkevekt, kan gjøre elektrsk arbed hvor reaksjonen drver elektroner gjennom en ekstern krets. Det arbedet en gtt mengde av transporterte elektroner kan g er avhengg av potensalforskjellen mellom de to elektrodene. Dette potensalet kalles cellepotensalet og er målt volt. Den maksmale mengden elektrsk arbed et system kan g er gtt ved verden av G. w e,maks = G (2.18) w e blr brukt for elektrsk arbed. For å kunne dra termodynamske konklusjoner fra målnger av det arbedet en celle kan g, er det vktg at cellen opererer reversbelt (se kapttel 2.6.1). Den resulterende potensalforskjellen kalles den elektromotorske kraften (emf) av cellen. Relasjonen mellom Gbbs reaksjonsenerg og emf er -vfe = r G (2.19) Her er F Faradays konstant (F = en A, dvs. mengden av ladnng per mol elektroner). 31
41 Relasjonen mellom emf og aktvteten av de deltakende specene cellereaksjonen er gtt ved Nernstlknngen. For å komme frem tl lknngen må man først se på hvordan Gbbs reaksjonsenerg er relatert tl reaksjonsblandngen G = rg θ r + RT ln Q (2.11) hvor Q er reaksjonskvotenten. Ved en kombnasjon med lknng (2.19) og en dvsjon på begge sder med vf følger rg E = vf θ RT vf ln Q (2.111) Den første delen av lknngen over skrves E θ θ rg = (2.112) vf og kalles standard emf for cellen. Det vl s at standard emf er standard Gbbs reaksjonsenerg uttrykt som potensal, volt. Det følger at RT E = E θ ln Q (2.113) vf Denne lknngen kalles Nernstlknngen. For en hydrogen/oksygen brenselcelle, vl reaksjonslknngen være H 2 (g) + ½ O 2 (g) = H 2 O(g) (2.114) To elektroner blr transportert reaksjonen, v = 2. Partaltrykket tl hydrogen, oksygen og vann nkluderes reaksjonskvotenten. Nernstlknngen for denne reaksjonen blr da RT P E = E θ ln (2.115) 2F P H2O 1 2 H P 2 O2 Cellepotensalet man får av lknngen over kalles åpen cellespennng (OCV), og har samme form som lknng (2.15). Gbbs energ er avhengg av temperaturen ved G = H T S (2.116) 32
42 hvor H er reaksjonsentalpen, T er temperaturen og S er reaksjonsentropen. Entalpen og entropen er også avhengg av temperaturen, men tl en så lten grad at denne avhenggheten ofte neglsjeres. Dersom man setter nn standard verder for hydrogen og oksygen [7] nn lknng (2.112) fåes, 237,3kJ mol C mol 1 θ E H2 / O = = 2 1 1,229 V (2.117) som gr den åpne cellespennngen ved 25 ºC Målng av en celles elektromotorske spennng (EMF eller OCV) Et vktg prnspp ved målng av en celles elektromotorske spennng er at det kke går noen strøm gjennom cellen, på grunn av kravet tl termodynamsk reversbltet cellen [8]. Kravet nnebærer at 1) motsattrettede krefter et system kun er nfntesmalt forskjellge fra hverandre. Og 2) enhver endrng som skjer, kan reverseres ved å pålegge en motkraft som er nfntesmalt større enn den drvende. En elektrokjemsk celle er reversbel når den tlfredsstller dsse to kravene. Dersom kravene kke er oppfylt kalles cellen rreversbel, og termodynamske lknnger som tar utgangspunkt reversbltet vl kke gjelde. Det må eventuelt benyttes komplsert rreversbel termodynamkk. Hvs man kobler en reversbel celle med en ytre strømklde, som har en elektromotorsk spennng som akkurat balanserer cellens egen elektromotorske spennng, vl det kke foregå kjemske prosesser cellen. Det vl kke gå strøm gjennom cellen. Dersom den ytre elektromotorske spennngen mnskes noe, vl cellen begynne å levere strøm. Det skjer en cellereaksjon tlsvarende strømmengden som passerer cellen. Strømmen skal gå den motsatte retnng og cellereaksjonen skal bl eksakt den omvendte dersom den ytre spennngen økes tlsvarende. En celle er kun reversbel når det kke går strøm, eller prakss når strømmen er nfntesmal lten. Ved høyere strøm kan det dannes konsentrasjonsgradenter cellen, noe som fører tl at prosessene cellen kke er reversble Strøm/spennngsmålnger Fluksen av protoner gjennom en brenselcelle er begrenset av motstanden tl elektrolytten, elektrodeknetkken og motstanden fra den eksterne elektronske lasten. Sden strømmen er den samme hele brenselcellekretsen kan denne stuasjonen uttrykkes som et spennngstap, E, rundt kretsen E =E OCV IR (η anode + η katode ) (2.118) hvor I er strømmen, E OCV er den åpne cellespennngen, R er den onske motstanden tl elektrolytten, og η katode og η anode er henholdsvs katode- og anodeoverpotensalene. 33
43 Ved lkevekt vl de kjemske reaksjonene foregå frem og tlbake samme hastghet r på grunn av termsk energ. For grenseflater er det en utvekslngskoeffsent som kan uttrykkes k = r s som ser noe om de termske svngnngene for reaksjonen over grenseflaten med tykkelse s. Dette kan uttrykkes ved en utvekslngsstrømtetthet = k nec = r s nec (2.119) hvor n er antall elektroner som er nvolvert reaksjonen og c er volumkonsentrasjonen av specene grenseflate. Dersom det nå påføres en lten kraft over grenseflaten, vl v få en netto fluks gtt ved dp j= ck (2.12) kt hvor dp er potensalsteget over grenseflaten. Den totale strømtettheten er dp dp = jne = cnek = (2.121) kt kt Dersom dp er potensalsteget fra endrngen det elektrske overpotensalet vl dp = ηn e (2.122) Det totale overpotensalet blr da kt η = (2.123) ne Dette uttrykket gjelder for små krefter. Ved å måle overpotensalet mot strømtetthet ved DCvoltametr eller AC-mpedansspektroskop, kan v bestemme ladnngsoverførngsmotstanden, R lo, η kt kt R lo = = = (2.124) 2 2 ne n e k c Ved større krefter vl en Butler-Volmer logartmsk avhengghet av strømmen og fluksen tl overpotensalene tas tl betraktnng η= kt ne ln (2.125) Denne lknngen gjelder bare dersom > 34
44 2.6.3 Overpotensaler I en brenselcelle skller man mellom tre overpotensaler. - aktverngsoverpotensal - ohmske tap - massetransportoverpotensal Aktverngsoverpotensalet kommer fra ladnngstransportknetkken over elektrode-elektrolytt grensesnttet. Med andre ord tapes en del av elektrodepotensalet ved å drve transporten av elektroner. Aktverngsoverpotensalet er drekte relatert tl egenskapene for de elektrokjemske reaksjonene og representerer størrelsen på aktverngsenergen når reaksjonen foregår hastgheten som er bestemt av strømmen. I en hydrogen/oksygen brenselcelle vl aktverngsoverpotensalet for anoden være neglsjerbar, sden reduksjonen av oksygen er sgnfkant tregere enn oksdasjonen av hydrogen. Aktverngsoverpotensalet kan uttrykkes, ekvvalent tl lknng (2.125), [9] η akt = A ln (2.126) der konstanten A er stor for en treg elektorkjemsk reaksjon, er strømtettheten og er utvekslngsstrømtettheten. Lknngen er kjent som Tafel-lknngen. A er for en hydrogenbrenselcelle med to elektroner transportert per mol RT A = (2.127) 2 α F Konstanten α kalles ladnngsoverførngskoeffsenten og er proporsjonal tl den påførte elektrske energen som benyttes ved å endre hastgheten tl en elektrokjemsk reaksjon. Verden er avhengg av reaksjonen og elektrodemateralet, men må være mellom og 1,. For de fleste hydrogenelektroder er verden ca.,5 [9]. Lknng (2.126) kan ved lknng (2.127) skrves 2α Fηakt = exp (2.128) RT Det totale aktverngsoverpotensalet er summen av potensalet for anoden og katoden η akt + = A anode ln A katode ln (2.129),anode,katode Ohmske tap, også kjent som IR-tap, er et resultat av den elektrske motstanden cella: onsk motstand membranen, onsk og elektronsk motstand elektrodene og metallske ledere. 35
45 Den domnerende delen av det ohmske tapet kommer som oftest fra motstanden elektrolytten. Det ohmske tapet kan uttrykkes η ohmsk = -IR = -r (2.13) Her er I strømmen, R den totale cellemotstanden, strømtettheten og r arealspesfkk motstand. Massetransportoverpotensalet kommer fra en begrensnng av massetransporten tl reaktanter mot elektroden. Elektrodereaksjonen krever en konstant tlgang av reaktanter for å holde en konstant strøm av elektroner. Når begrensnngen dffusjon reduserer tlgangen av reaktant, vl en del av den tlgjenglge energen benyttes tl å drve massetransporten. Tapet energ fører tl et korresponderende tap spennngen. Et lknende problem kan utvkle seg dersom reaksjonsproduktet hoper seg opp nær elektrodeoverflaten og hndrer dffusjonen eller fortynner reaktantene. For å matematsk uttrykke dette overpotensalet kan overpotensalet sees på som følge av en reduksjon partaltrykket tl hydrogen og oksygen når det dras strøm fra brenselcellen [9]. Denne endrngen partaltrykk vl føre tl en endrng OCV. Dersom v bare ser på anoden vl endrngen OCV sees ved bruk av lknng (2.15) η masse,andoe RT p = 2F p II H2 I H2 (2.131) En begrenset strømtetthet l, anode kan antas. Den begrensede strømtettheten fåes når den maksmale mengden hydrogen som kan tlføres benyttes med en gang den elektrokjemske reaksjonen.. Strømtettheten kan kke bl større enn verden tl l, anode sden hydrogenet kke kan føres raskere tl anoden. Der strømtettheten er lk l, anode vl hydrogentrykket på anoden være lk null. Dersom I p H2 er partaltrykket når strømtettheten er null, og v antar at trykket II faller lneært ned tl null ved strømtetthet lk l, vl partaltrykket ved alle strømtettheter være gtt ved p H2 = I p H 1 (2.132) 2 l, anode II p H 2 Lknng (2.131) vl nå kunne uttrykkes η masse,anode = RT 2F ln 1 l, anode (2.133) For katoden vl uttrykket bl ved samme fremgangsmåte som for anoden 36
46 η masse,katode = RT 4F ln 1 l, katode (2.134) Et uttrykk for den totale spennngen en brenselcelle, lknng (2.118) vl nå bl E = E OCV RT 1 r + 2F α + anode RT ln 1 2F ln l,anode,anode α 1 2 katode ln 1 l,katode ln,katode (2.135) En typsk brenselcelles strømtetthet/spennng kurve er vst fgur 2.7. Kurven kan deles nn tre områder, som tldeles hvert stt overpotensal. Aktverngsoverpotensal domnerer ved lave strømtettheter område I. Område II er domnert av det ohmske tapet, mens helnngen av kurven område III skjer på grunn av massetransportoverpotensalet. Fgur 2.7 Klasssk strømtetthet-spennngskurve. 2.7 Impedansspektroskop Impedansspektroskop er en vktg metode for å karaktersere de elektrske egenskapene tl en elektrokjemsk celle. Ved å undersøke grenseflater er det med denne metoden mulg å få nformasjon om elektrodeknetkk og dobbeltlag kondensatorer. Lednngsevne kan også måles, når bulk undersøkes. Det er og mulg å få nformasjon om ndre kondensatorer og motstander korngrenser. Alle dsse karakterstske egenskapene har forskjellg avhengghet av frekvensen. Egenskapene kan dermed separeres ved å påføre vekselstrøm over et bredt frekvensområde. 37
47 2.7.1 Egenskaper tl vekselstrøm Ved vekselstrøm kan spennngen vareres ved snusbølger, som resulterer snusstrøm. Snusspennngen karakterseres ved dens frekvens f, vnkelfrekvens ω = 2πf og ampltude U U = U sn ωt (2.136) hvor ωt kalles fasevnkelen. En snusodal AC-strøm fra den påsatte AC-spennngen vl ha den samme frekvensen som spennngen, men kan ha forskjellge ampltude og fasevnkel I = I sn ( ωt + θ) (2.137) Faseforskyvnngen, θ, kommer fra kapastve elementer kretsen Passve elektrske kretselementer Motstand En motstand er et element med langtrekkende transport av ladnngsbærere. Antall ladnnger, konsentrasjonen og moblteten av ladnngsbærerne gr konduktansen G og motstanden R (R = 1/G). I en deell motstand vl spennngen g en umddelbar stgnng strøm. Det motsatte vl også skje umddelbart, en strøm vl g en stgnng spennng. Sden denne responsen skjer umddelbart, vl en AC-spennng og AC-strøm en motstand være fase. Motstanden AC er gtt ved U U sn ωt U R = I I sn ωt I = = (2.138) og er uavhengg av frekvensen. Kondensator En kondensator nnebefatter en deell solator mellom to ledere. Kondensatoren er vanlgvs konstruert ved to parallelle plater separert ved enten vakuum, en gass eller et delektrsk materale. Platene kan lades opp ved å påføre en spennng over dem. Kapastansen er defnert som C = Q/U. Strømmen tl en kondensator er endrngen dens ladnng Q med td dq du I = = C (2.139) dt dt Med påført AC-spennng får v vdere d(u sn ωt) = C = ωcu cosωt = ωcu sn( ωt + π ) (2.14) dt 2 I 38
48 der strømmen over en kondensator er faseforskjøvet med π/2 foran AC-spennngen over den. Forholdet mellom en spennngstopp og en strømtopp når AC-spennng er påført over en kondensator er R C 1 = (2.141) ωc og kalles den kapastve motstanden. Induktorer En nduktor er en lengde, ofte en spole, som deelt er en leder uten motstand. Dersom en snusodal strøm går gjennom lederen, vl et korresponderende magnetfelt settes opp rundt lederen. Dette magnetfeltet vl så ndusere en AC-spennng U L over lederen. AC-spennngen U, som opprnnelg ble påført for å lede strømmen, må være lke stor og av motsatt retnng som U L di d(i sn ωt) π = U L = L = L =ωli cosωt =ωli sn( ωt + ) (2.142) dt dt 2 U der spennngen er π/2 foran strømmen. L er nduktansen tl en nduktor. Den nduktve resstansen blr R L = ωl (2.143) dvs. proporsjonal med frekvensen AC-mpedans I AC-mpedansmålnger måles strøm og spennng som snusodale spennnger, en over prøven, og en over en referansemotstand. I tllegg tl størrelsen på de to spennngene måles fasevnkelen, θ, mellom dem. Strømmen kan sees å ha to komponenter, en som er fase med spennngen, og en komponent som er 9º ute av fase. Impedansspektrometeret kan arbede slk at det spltter strømmen dsse to komponentene. En mpedans som er spennngen dvdert med -fase komponenten av strømmen, R. Og en mpedans som er spennngen dvdert på 9º ute-av-fase komponenten av strømmen, X. R, -fase komponenten, kalles resstans og representerer den reelle motstanden for transport av ladnngsbærere gjennom mpedanselementet. En motstand er et eksempel på en komponent med reell mpedans. Dette er den reelle delen av mpedansen. X, ute-av-fase komponenten, kalles reaktansen og representerer at ladnngsbærerne kke vrkelgheten transporteres gjennom mpedanselementet eller vrkelgheten kke har noen 39
49 motstand. Det vl s at ladnngsbærerne bare lagres mdlertdg, som en deell kondensator eller kke har noen motstand, som en deell nduktor. Dette er den magnære delen av mpedansen. Den totale mpedansen, Z kan nå representeres som en vektor det komplekse planet, fgur 2.8, og som et komplekst tall. Den komplekse mpedansen Z * er gtt ved Z * = R + X (2.144) Det er nå mulg å tlegne hvor de tdlgere nevnte passve elektrske kretselementene gr sne bdrag den totale mpedansen. Motstanden er reell mens de to andre, kondensatoren og nduktoren, er magnære. Sden den egentlge dvderngen av spennng på strøm en deell kondensator kommer ut som R C, bl mpedansen av en krets sere bestående av en motstand, kondensator og en nduktor Z * 1 = R + + ωl = R + ωl (2.145) ωc ωc Den nverse av mpedansen er admttansen Y * = 1/Z *. Admttansen fåes fra forholdet mellom strømmen og spennngen, og er som mpedansen et komplekst tall. Den reelle delen av admttansen kalles konduktansen, G og den magnære delen kalles suseptansen, B Y * = G + B (2.146) En deell motstand er også en deell leder, derfor er G = 1/R. For en deell kondensator har v B C =-1/X C = ωc, og for en deell nduktor har v B L = -1/X L = -1/(ωL). I en krets der en motstand, en kondensator og en nduktor er koblet parallell får v en reell del og to magnære deler Y * 1 = G + ωc + = G + ωc (2.147) ωl ωl Ved en AC-mpedans eller AC-admttansmålng vl det for målenstrumentet være umulg å vte hvordan det skal tolke resultatene. Instrumentet vet bare forholdet mellom spennngen og strømmen samt fasevnkelen. For å kunne tolke resultatene vdere må nstrumentet få vte om den reelle delen av mpedansen eller admttansen er koblet sere eller parallell med den magnære delen. 4
50 X Z θ R Fgur 2.8 Impedansen plottet som vektor det komplekse planet Målng av mpedansdata. I et mpedansspekter plottes den magnære delen X mot den reelle delen R. For en (RC) krets, det vl s en motstand og en kondensator parallell, vl spekteret vse en typsk halvsrkel llustrert fgur 2.9 ved et Nyqustdagram X /Ω Hz 1-6 Hz R / Ω Fgur 2.9 Smulerng av en (RC) krets med R = 1 Ω og C = 1 µf Et polykrystallnsk fast stoff gr flere forskjellge bdrag tl det totale AC-mpedansspekteret. Motstander bulk, krongrenser og elektrodene, og kapastanser for de samme delene. Kapastansene er vanlgvs uavhengg av temperaturen og verdene lgger for bulk rundt 1-12 F, for korngrensene rundt 1-1 F og for elektrodene 1-6 F. Dsse kapastansene ser noe om avstanden mellom platene kondensatoren og noen tlfeller hvor mange kondensatorer som adderes sammen. En elektrode er en kontakt mellom to forskjellge faser, elektrodemateralet og elektrolytten. Kapastansen mellom dsse to fasene vl bl relatvt stor sden avstanden mellom fasene bare er noen atomlag tykk. Man vl kanskje anta det samme for korngrensene, sden avstanden mellom kornene også er veldg lten. Men sden 41
51 polykrystallnske materaler nneholder mange korn, vl kapastansen for hver korngrense g utslag det samme frekvensområdet. Verden på den totale korngrensekapastansen vl reflektere en sum av alle korngrenseavstandene. Størrelsen på denne verden blr dermed ofte mndre enn kapastansen tl elektroden. Motstanden for korngrensen blr summen av alle de ndvduelle korngrensemotstandene. Korngrensene polykrystallnske materaler vl kke være dentske. Grensene vl blant annet være forskjellg orentert forhold tl strømmen og de vl være av forskjellg tykkelse. Motstanden og kapastansen vl derfor varere for de ndvduelle korngrensene. Den totale korngrensempedansen blr dermed et resultat av den totale fordelngen av de forskjellge parametere og av tdskonstantene. Resultatet blr en nedtrykkng av halvsrkelen tl en bue. En måte å smulere en sprednng tdskonstanter er ved å tlknytte et konstant faseelement kalt CPE eller Q tl kapastansen. Et CPE har mpedansen Z n 1 Q = [Y (ω) ] (2.148) hvor n er en eksponent og kan fyssk varere mellom -1 og 1. Y er den numerske verden av Q. En konsekvens av lknng (2.148) er at fasevnkelen for CPE mpedansen er uavhengg av frekvensen. Dette gr CPE stt navn. Når n = 1, vl CPE representere mpedansen tl en deell kondensator. Ved n = en deell leder (motstand) og ved n = -1 en deell nduktor. I noen tlfeller kan den sanne kapastansen beregnes fra Y og n. Der CPE er parallell med en motstand vl følgende sammenheng gjelde [1] C 1 R ω (1/ n) (1/ n 1) = = Y R (2.149) Maks hvor ω Maks er hvor den magnære delen er på stt maksmum. Fra elektrodene kan det være flere ulke prosesser som kan g halvsrkler et ACmpedansspekter. En elektrode er en kontakt mellom to forskjellge faser, for eksempel et metall og en onsk leder. Denne grenseflaten kalles dobbeltlaget. Kapastansen tl dette dobbeltlaget kalles da dobbeltlagkapastansen. En typsk verd på denne kapastansen er 1-6 F. Elektroden har også en ladnngsoverførngsmotstand. Denne motstanden ser noe om lengden elektronene og onene må hoppe over barreren, elektrode-elektrolytt grenseflaten. Ladnngsoverførngsmotstanden er parallell med dobbeltlagkapastansen, og danner sammen en halvsrkel mpedansspekteret ved en lavere frekvens enn for bulk og korngrensen. I sere med ladnngsoverførngsmotstanden kan det være flere transportprosesser, for eksempel adsorpsjon og dffusjon. Dsse prosessene gr kapastanser som er mye større enn de tl nå nevnte. 42
52 Totalt kan elektroder kontakt med en elektrolytt uttrykkes ved en såkalt Randles krets. (C dl (R lo (R d Q d ))) vst fgur 2.1. Fgur 2.1 Klasssk ekvvalentkrets for kke-blokkerende elektroder. C dl er dobbeltlagskapastansen, R lo er ladnngsoverførngsmotstanden, Q d er dffusjonskapastansen og R d er dffusjonsmotstanden elektrodemålnger Denne metoden er en kombnasjon mellom 2- og 4- elektrode modus og benyttes for å studere elektrodempedans. En elektrode benyttes som både strøm- og spennngsprobe. Impedansen av denne elektroden er dermed nkludert målngen. Denne elektroden kalles arbedselektroden. De to andre elektrodene er motelektroden for strøm, og referanseelektroden for spennng. Sden referanseelektroden er fr for strøm, vl denne elektrodens mpedans ekskluderes. 3-elektrodemålnger kan benytte 3 eller 4 lednnger, dvs. arbedselektroden kan kontaktes med en eller to lednnger. Fgur 2.11 Strømfelt og ekvpotenselle lnjer ved treelektrodemålnger. De stplede lnjene fgur 2.11 smulerer strømmens ve gjennom elektrolytten. De andre lnjene smulerer de ekvpotenselle lnjene, dsse lnjene vl alltd være loddrette på strømlnjene. De ekvpotenselle lnjene kan sammenlknes med kotene på et kart. Ved 43
53 trepunktsmålnger vl spennngsfallet fra den ekvpotenselle lnjen og opp tl over arbedselektroden måles. 2.8 Elektroder Elektrodene er avgjørende for en brenselcelles ytelse. Elektrodenes oppgave er å lede elektroner tl den eksterne kretsen og transportere reaktanter og produkter tl og fra elektrolytten. De elektrokjemske reaksjonene skjer på en trefasegrense mellom gassfasen, elektrolytten og elektroden. Størrelsen på trefasegrensen er avhengg av en porøs elektrode, og ser noe om hvor mange elektrokjemske reaksjoner som kan foregå. Desto større trefasegrense jo bedre elektrode. Det er gunstg med et elektrodematerale som er katalytsk aktvt mot den elektrokjemske reaksjonen for å senke aktverngsenergen Metallelektroder Enkle metallelektroder som for eksempel nkkel eller platnaelektroder er kjent for å ha en høy katalytsk aktvtet mot adsorpsjon og dssosasjon av hydrogenmolekyler. I en stude av forskjellge metallelektroder for oksdasjonen av hydrogen vste nkkel å ha den høyeste begrensede strømmen sammenlknet med platna, sølv og gull [11]. Problemet med rent nkkel er at det gr en dårlg trefasegrense elektrode/elektrolytt/h 2, ford nkkel vser en tendens tl å sntre og agglomerere tl en grov struktur ved temperaturer over 8ºC [12]. De elektrokjemske reaksjonene skjer ved trefasegrensen. Det er derfor en fordel at denne trefasegrensen er så stor som mulg for å unngå polarserngsmotstand. For en ren nkkelelektrode vl polarserngsmotstanden være for høy Cermetelektroder Cermetelektroder består av to faser, et keramsk materale og metallsk nkkel. Blandngen sørger for en større trefasegrense enn en enkel metallelektrode. Det keramske nettverket begrenser nkkelets mulghet tl å vokse og sntre sammen, som betyr at det keramske nettverket defnerer den totale strukturen av kompostten, nkludert porøsteten. Porøsteten er nødvendg for å mulggjøre dffusjon av gassmolekyler nn tl elektrolytten. Det er to parametere som hovedsakelg bestemmer egenskapene tl cermetelektroder. 1) Metall/keram volumforholdet. Dette forholdet påvrker hovedsakelg den elektrske lednngsevnen tl materalet. Det er behov for en høy lednngsevne for å sørge for en effektv oppsamlng av strøm på elektroden. 2) Porøsteten og dstrbusjonen av partkkelstørrelsen. Det vl være en konkurrerende effekt mellom høy lednngsevne tl metallsk nkkel og størrelsen på trefasegrensen. Ved store keramske partkler trengs mndre nkkel for å oppnå kontakt mellom nkkelpartklene. Men for å oppnå en stor trefasegrense trengs en relatvt stor andel fnfordelt små keramske partkler, som er jevnt dstrbuert rundt nkkelpartklene for å hndre at nkkelet vokser. 44
54 3 Ltteratur Høytemperatur protonledende brenselceller har de sste 2 årene vært av stor nteresse. En av ponerene nnen dette fagfeltet, Iwahara, publserte tdlg blant annet elektrokjemske studer av SrCeO 3 -baserte materaler [13]. En høy protonlednngsevne de første materalene førte tl et relatvt omfattende søk etter nye materaler og en relatv stor forsknng på lednngsevnemekansmen. Norby [14] fant blant annet en vanndampavhengghet for protonlednngsevnen Y 2 O 3. SrCeO 3 dopet med 5 % Yb og BaCeO 3 dopet med 1 % Y [15] er noen av metalloksdene med høyest protonlednngsevne. Dsse to basske oksdene er valgt som elektrolytter denne oppgaven. 3.1 Struktur BaCeO 3 og SrCeO 3 er oksder med ABO 3 perovsktt-type struktur, fgur 3.1. Perovsktt er det egentlge navnet på mneralet CaTO 3. Generelt for ABO 3 er A og B metalloner, der A er relatvt mye større enn B. I strukturen er de store A katonene og oksygenatomene tl sammen pakket på tettest mulge måte. Oksder som har perovskttstrukturen kan ha alle mulge katoner med oksdasjonstrnn som tl sammen blr +6, eksempler på dette er KTaO 3 (I-V), SrCeO 3 (II-IV) og LaCrO 3 (III-III). I perovsktten er A-katonet 6-koordnert og B-katonet 12-koordnert. Fgur 3.1 Perovskttstrukturen Krystallstrukturen tl udopet BaCeO 3 ble undersøkt 197 av Jacobson et al. [16] ved bruk av nøytrondffraksjon. Knght et al. [17] bestemte senere strukturen av BaCe.9 Y.1 O 2.95 ved pulset nøytronklde og tme of flght dffraksjon. Knght [18] rapporterte senere en uoverensstemmelse mellom romgruppe og gtterkonstanter ved tdlgere studer og gjorde derfor korreksjoner tl strukturen. BaCe.9 Y.1 O 2.95 ved romtemperatur er ortorombsk, med romgruppe Pmcn. 45
55 BaCeO 3, dopet og udopet, gjennomgår tre strukturelle faseoverganger opp tl 1273 K. Ved ca. 563 K fra ortorombsk Pmcn, tl en andre ortorombsk, Incn. Neste faseovergang er ved ca. 673 K som er fra den ortorombske tl en romboedrsk fase med romgruppe R-3c. Den sste faseovergangen skjer ved ca.1173 K, fra romboedrsk med romgruppe R-3c tl en kubsk fase med romgruppe Pm-3m [19]. Krystallstrukturen fgur 3.2 ndkerer to ulke oksygenplasser, O1 og O2. Oksygenvakansene som dannes ved dopng fordeler seg kke homogent mellom de to oksygenplassene, men utelukkende på O2 plassen. Ved faseovergangen tl den romboedrske strukturen vl oksygenvakansene fordele seg homogent over alle oksygenplassene. Dette kan forklare en observert øknng transporttallet for oksygenoner [2] ved en temperatur akkurat over faseovergangen [19]. Fgur 3.2 Krystallstrukturen av BaCeO 3 ved romtemperatur basert på strukturen tl Knght [19], ortorombsk med romgruppe Pmcn. De krystallografske uavhengge oksygenatomene er markert med pler. O1 lgger på spelplanet strukturen mens O2 lgger på den generelle plassen. SrCeO 3 og oksdets dopede dervater er sostrukturelle med BaCeO 3, men SrCeO 3 vser et større avvk fra den kubske symmetr enn BaCeO 3. Som et resultat av dette har kke SrCeO 3 en temperaturfremkallet polymorfsme, og beholder den ortorombske Pmcn strukturen opp tl mnst 1ºC [2]. 3.2 Stabltet Den relatvt høye protonlednngsevnen for dopet BaCeO 3 og SrCeO 3 gjør at dsse materalene er attraktve for en rekke anvendeleser, derblant brenselceller. Høy basstet for de to oksdene er fordelaktg med hensyn på løselgheten av protonske ladnngsbærere. Problemet med dsse basske oksdene er at de relatvt lett reagerer med sure og amfotere gasser. SO 3, CO 2 og H 2 O danner henholdsvs sulfater, karbonater og hydroksder. CO 2 er det kanskje det vktgste problemet speselt med tanke på bruken av hydrokarboner som brensel brenselceller og synteseveer med for eksempel karbonater som utgangstoffer. 46
56 Reaksjonen mellom BaCeO 3 og CO 2 kan skrves BaCeO + + (3.1) 3 CO 2 (g) = BaCO3 CeO 2 Reaksjonen over kan deles opp to reaksjoner, med hvert stt metalloksd. BaCeO 3 = BaO+ CeO 2 BaO + CO 2 (g) = BaCO 3 (3.2) (3.3) Ved standard betngelser, T = 298,15 K og P = 1 atm., er Gbbs energ for reaksjon (3.3), henholdsvs for BaCO 3 og SrCO 3 [21] (BaCO ) = 269,2kJ / mol+ (,172kJ / mol K) T (3.4) G r 3 G r (SrCO3 ) = 234,3kJ / mol+ (,172kJ / mol K) T (3.5) Sden entalpen og entropen for dannelsen av komponentene kke varerer med mer en noen få prosent temperaturntervallet 298,15 K 1 K, kan lknng (3.4) og (3.5) benyttes tl å evaluere den termodynamske stablteten også ved operasjonstemperaturen tl en brenselcelle. For reaksjon (3.2) er det en bred enghet om at reaksjonsentalpen for dannelsen av perovsktter fra de ndvduelle oksdene vser en sammenheng med toleransefaktoren t, (Goldschmdt faktoren) [22], der (R A + R O ) t = (3.6) 1/ 2 2 (R + R ) B O hvor R A, R B og R O er radene for elementene perovsktten ABO 3. Toleransefaktoren beskrver størrelsen på fordrenngen av perovskttstrukturen fra den deelle kubske strukturen tl en uoverensstemmelse mellom A-O og B-O bndngslengdene. En økende toleransefaktor vl g en øknng stabltet, t cerater < t zrkonater < t ttanater [23], dvs. ttanater er mer stable enn cerater. Dannelsesenergen for BaCeO 3 og SrCeO 3 fra karbonatene (lknng (3.1) for BaCeO 3 ) er studert av mange uavhengge grupper [24, 25]. Hale et al.s foretrukne verder for entalpen er gjengtt tabell 3.1 [22], sammen med entroper fra Gopalan et al[24]. 47
57 Tabell 3.1 Termodynamske parametere for reaksjonen ABO 3 + CO 2 = ACO 3 + BO 2 ved standardtlstand, T = 298,15 K og p = 1 atm Entalpverder er fra [22] og entropverdene er fra [24]. ABO 3 o H r kj/mol o S r kj/mol K BaCeO ,268 SrCeO ,262 o En negatv H r mplserer at dannelsen av karbonatet er gunstg sammenlknet med dannelsen av perovsktten ved lave temperaturer. Dette stemmer godt med ekspermentelle observasjoner, [26, 27]. BaCeO 3 og SrCeO 3 er termodynamsk stable mot det aktuelle partaltrykkområdet av vanndamp ved høy temperatur. Ved lav temperatur vl en dårlg knetkk føre tl at en reaksjon med vanndamp kke vl skje. Stablteten av BaCeO 3 og SrCeO 3 mot vanndamp er derfor kke relevant [23]. 3.3 Effekten av kke-støkometr på lednngsevnen Effekten av kke-støkometr ABO 3 perovsktter på protonlednngsevnen, hvor kkestøkometren er defnert som avvkelse molart forhold mellom A og B fra 1:1. Kreuer et al. [28] observerte ekspermentelt at en akseptordopet barumceratforbndelse med et lte barumunderskudd vste vesentlg lavere lednngsevne enn en støkometrsk forbndelse. I det samme arbedet ble det observerte at et barumoverskudd førte tl en øknng lednngsevnen Barumunderskudd Studer på udopet barumcerat vser at perovskttstrukturen kke kan tolerere et vesentlg underskudd av barum [29]. XRD undersøkelser vste en tlstedeværelse av CeO 2. Et underskudd av barum fåes ved å justere sammensetnngen under syntesen, eller fra avdampnng av BaO, som skjer når oksdet holdes ved høy temperatur over en lengre perode. Ma et al. [3] gr to mekansmer for hva som kan skje dopet barumcerat når det blr et underskudd på barum. 1. En del av Y 3+ substtueres for Ba 2+, kke bare for Ce Underskuddet av barum danner katonvakanser på Ba 2+ -plass. Ma et al. konkluderer med at mekansme 1 er lte sannsynlg, sden oneraden tl Y 3+ er mndre enn oneraden tl Ba 2+, 12-koordnert possjon. Y 3+ fra Ce 4+ - tl Ba 2+ -plass vl dermed føre tl et mndre volum av enhetscellen. Det ekspermentelle, ved XRD, vser at enhetscellevolumet øker med et lte underskudd av Ba 2+. Mekansme 2 er derfor den mest sannsynlge. Shma et al. [29] undersøkte gadolnum dopet barumcerat, og fant kontrast med Ma et al. [3] at nkorporerngen av dopanten på fel plass, mekansme 1, er mest troverdg. Kreuer et 48
58 al. har også undersøkt og anerkjent denne mekansmen for både Y og Gd dopet BaCeO 3 [31]. Prosessen kan beskrves ved enten barumunderskudd eller cerumoverskudd X X ' 2Ba Ba + 2OO + Gd Ce + VO Gd Ba + 2BaO (3.7) 2 CeO + (3.8) ' X X 2 + Gd Ce + VO Gd Ba + 2CeCe 6OO Data fra XRD og vannopptaksmålnger [29], vste at enhetscellevolumet mnket med et økende underskudd av barum, som et resultat av at Gd går fra Ce- tl Ba-plass. Et lavere vannopptak er resultat av at oksygenvakansene blr færre. De forskjellge ekspermentelle resultatene fra Ma et al. og Shma et al gr motsatte forklarnger for effekten av barumunderskudd. Det kreves derfor vdere undersøkelser for å fnne ut hva slags mekansme som er den rktge Barumoverskudd Effekten av barumoverskudd er undersøkt mer omfattende enn effekten av barumunderskudd. Ma et al.[3] dskuterer fre forskjellge mekansmer. 1: Overskuddet av BaO går nn på Ce 4+ -plass og danner et tlsvarende antall oksygenvakanser. 2: Overskuddet av BaO danner katonvakanser på Ce 4+ -plass. 3: Overskuddet av BaO ekssterer korngrensene som en amorf fase. 4: En kombnasjon av de tre mulghetene over. Ma et al. kommer frem tl at mekansme 1 er lte sannsynlg. En substtusjon av Ba 2+ for Ce 4+ er relatvt vanskelg sden oneraden for Ba 2+ er mye større enn raden tl Ce 4+. For mekansme 3 er det rapportert for BaCe,9 Gd,1 O 3-α at noe BaO ekssterer korngrensene som en amorf protonledende fase [32]. Ma et al. argumenterer med at dersom et overskudd av BaO befnner seg korngrensene burde man kke se en forskjell gtterparameterne ved et varerende nnhold av Ba 2+. Det ekspermentelle vser at akselengden c og enhetscellevolumet øker bemerkelsesverdg med et økende nnhold av Ba 2+. Mekansme 3 er derfor også lte sannsynlg. Ma et al. konkluderer, med bakgrunn avvsnngen av mekansme 1 og 3, at mekansme 2 er den mest sannsynlge. Shma et al. [29] kommer frem tl at mekansme 1 er den mest sannsynlge. Denne mekansmen kan beskrves ved defektlknngen 2 BaO (3.9) X '' x = Ba Ba + Ba Ce + 2OO + VO Barum går nn på Ce plass og danner en oksygenvakans. Enhetscellevolumet skal dermed øke med økende barumnnhold. Dette stemmer med ekspermentelle observerte dffraksjonsdata og vannopptakdata. Argumentet Ma et al. brukte for at denne mekansmen er 49
59 lte sannsynelg, behandles kke. Shma et al. dskuterer også mulgheten for mekansme 2, og ser at dannelsen av en cerumvakans med høy effektv ladnng er lte troverdg, kontrast med Ma et al. Når det gjelder nkorporerngen av barumoksd korngrensene er det et samsvar mellom de to gruppene. Konklusjonen fra Ma et al.(mekansme 2) og Shma et al.(mekansme 1) fører begge tl en økt konsentrasjon av oksygenvakanser med økende nnhold av barum. Denne øknngen av antall oksygenvakanser burde føre tl en økt onsk lednngsevne. En slk øknng er observert for udopet barumcerat [33], men kke ved alle undersøkelser av dopet barumcerat. Shma et al.[29] observerte, ved lave temperaturer, en monoton nedgang lednngsevnen for Gd-dopet barumcerat med økende barumnnhold Ar mettet med vanndamp. Ved høye temperaturer var stuasjonen motsatt, lednngsevnen økte med økende nnhold av barum. Guan et al. [34] observerte for Y-dopet barumcerat en øknng lednngsevnen med økende nnhold av barum ved lave konsentrasjoner av yttrum (5 %). Ved en høyere konsentrasjon av yttrum (1 %) var stuasjonen motsatt, lednngsevnen sank. En sammenlknbar reduksjon lednngsevnen observerte Ma et al. [3] for 1 % Y-dopet barumcerat under en rekke forskjellge atmosfærer. Effekten av kke-støkometr på protonlednngsevnen barumcerat er fortsatt kke avklart. Kreuers observasjon [28] av en øknng lednngsevne med økende barumnnhold og en mnkende lednngsevne med mnkende barumnnhold er kke generelt akseptert. Det er lkevel en vss enghet, med tanke på lednngsevnen, at det ved lave konsentrasjoner av dopng og ved høy temperatur, er en fordel med et lte barumoverskudd. 3.4 Elektrske egenskaper Lednngsevnen tl akseptordopet BaCeO 3 og SrCeO 3 er studert som funksjon av mange varabler, som for eksempel type og mengde dopng, grader av kke-støkometr (kapttel 3.3), temperatur og gass-sammensetnng. Ved varasjon av gass-sammensetnng kan ulke lednngsevnebdrag kvantfseres. Graf 3.1 vser en slk stude der lednngsevnen har bltt funnet varerende reduserende/oksderende forhold. I reduserende forhold er det kjent at forbndelsene har en n-type elektronsk komponent og oksderende forhold er det kjent at forbndelsene har en p-type elektronsk komponent. I området mellom reduserende og oksderende forhold er forbndelsene er onsk ledende. Akseptordopet BaCeO 3 har også bltt undersøkt brenselcelleforhold, med hydrogen på anodesden og luft/o 2 på katodesden [2]. Dette forholdet gav den høyeste lednngsevnen sammenlknet med andre gasssammensetnnger, antagelgvs på grunn av en høy aktvtet av vanndamp elektrolytten. 5
60 log (σ total / S cm -1 ) SCYb 8 o C SCYb 9 o C SCYb 1 o C BCGd 8 o C BCGd 9 o C BCGd 1 o C log (p O2 / atm) Graf 3.1 Elektrsk lednngsevne for Yb-dopet SrCeO 3 (SCYb)og Gd-dopet BaCeO 3 (BCGd) ved forskjellge temperaturer som en funksjon av p O2. SCYb data fra [35] og BCGd data fra [36]. Oppgtt vanndamppartaltrykk for BCGd p H2O = atm, for SCYb oppgtt hydrogenfr. For akseptordopet BaCeO 3 har det, på grunn av den høye lednngsevnen, bltt publsert store mengder arbed. BaCeO 3 har derfor en vktg rolle som et modellmaterale for høytemperatur protonledere [37]. Graf 3.2 vser noen publserte lednngsevneverder for yttrumdopet barumcerat. Aktverngsenerger for 1 % yttrumdopet barumcerat ved lav temperatur er fra Bonanos et al. [38] oppgtt tl 5,1 kj mol -1 mens for Slade et al. [39] tl 45,6 kj mol -1. log ((σt) / S cm -1 K -1 ) Coors et al. 3 % H 2-97 % Ar Bonanos et al. luft Slade et al. (1) fuktg N 2 Slade et al. (2) H 2 - He Ma et al. fuktg H 2 Kreuer et al. fuktg gass, Ba,97 Y,19 Ce,84 O T -1 / K -1 Graf 3.2 Sammenlknng av lednngsevne for yttrumdopet barumcerat, 1 % dersom annet kke er oppgtt. Publsert ltteratur fra Coors et al. [4], Bonanos et al. [38], Slade et al.(1) [39], Slade et al.(2) [41], Ma et al. [42] og Kreuer et al. [31]. Alle dataene er fra AC-mpedansspektroskop. 51
61 Graf 3.3 vser en modell for protonlednngsevnen fra Kreuer [43]. Modellen benytter Nernst- Ensten lknngen (lknng (2.82)) for å beregne protonlednngsevnen. Denne lknngen tar utgangspunktet verder for konsentrasjonen av hydroksdoner og verder for dffusjonskoeffsenten tl hydroksdonene. Konsentrasjonen av hydroksdoner beregnes fra K hydr og fåes fra sobare TG-målnger (termogravmetr) ved varerende temperaturer [43]. Verder for dffusjonskoeffsenten fåes fra et NMR-spektrometer med pulset magnetsk feltgradent (PFG) [31]. Fra grafen sees at protonlednngsevnen synker relatvt raskt over 6ºC. Det vl ved temperaturer > 6ºC skje en dehydratserng. Dette er samsvar med fgur Modell for protonlednngsevnen fra Kreuer 1.5 log ((σt) / S cm -1 K) T -1 / K -1 Graf 3.3 Modell av protonlednngsevnen fra Kreuer [43]. Grafen er modfsert fra [4]. Guan et al. [34] har undersøkt graden av onsk-elektronsk lednngsevne 5 % yttrumdopet barumcerat (BCY5) ved AC-mpedansspektroskop og OCV målnger. Ved målng av transporttallet en konsentrasjonscelle med oksygen og vanndamp, domnerte protonlednngsevnen ved lav temperatur og oksygenonelednngsevnen ved høy temperatur. I tllegg sank den totale onelednngsevnen forhold tl den elektronske lednngsevnen med økende temperatur. I en konsentrasjonscelle med hydrogen og vanndamp sank det totale onske transporttallet fra,9 tl,79 ved en øknng temperatur fra 5 tl 8ºC. Dette transporttallet var høyere hydrogen/vanndamp enn oksygen/vanndamp atmosfærer. Guan et al. målte også at protontransporttallet synker fra,87 tl,63 og oksygenonetransport-tallet øker fra,3 tl,15 hydrogen/vanndamp atmosfærer fra 5 tl 8ºC. Guan et al. konkludere med at protonlednngsevnen domnerer den onske lednngsevne temperaturområdet som ble undersøkt. Den høye protonlednngsevnen SrCeO 3 ble, som nevnt kapttelnnlednngen, tdlg oppdaget og er derfor studert av flere grupper gjennom de sste 2 årene. Graf 3.4 vser noen publserte lednngsevneverder for ytterbumdopet strontumcerate. 52
62 For SrCeO 3 dopet med Yb har de Vres [44] utført en grundg undersøkelse av de elektrske egenskapene. de Vres vser ved AC-mpedansspektroskop, en rekke forskjellge atmosfærer og temperaturntervallet fra 35 8 ºC, at SrCe,95 Yb,5 O 3-δ hovedsakelg er oksygenvakansleder atmosfærer som kke nneholder protoner, og protonledende atmosfærer som nneholder protoner, for eksempel fuktede atmosfærer. Vdere undersøkte de Vres aktverngsenergen for bulklednngsevnen hydrogen/vanndamp og fant en E a ~ 53 kj mol -1 med en preeksponentell faktor A ~ 35 K Ω -1 cm -1. Verden for aktverngsenergen lgger følge de Vres noe lavere enn andre ltteraturverder, ~ 6 kj mol -1. Denne forskjellen forklares med en høyere kjemsk homogentet på materalet som ble undersøkt. Hamakawa et al. [45] har blant annet undersøkt n- og p-lednngsevnen tl SrCe,95 Yb,5 O 3-δ ved 9ºC hydrogen og oksygennneholdende atmosfærer. Ved å se på brenselcelleforhold, der det vl være n-lednngsevne på hydrogensden og p-lednngsevne på oksygensden, konkluderer Hamakawa et al. med at SCYb totalt kan sees som en blandet proton/p-leder. Dette begrunnes med at p-lednngsevnen > 4, 1-3 S cm -1 og den totale elektronske lednngsevnen er 4,7 1-3 S cm -1. Den totale elektronske lednngsevnen vl dermed være domnert av p-lednngsevnen. log ((σt) / S cm -1 K) Kosack et al. oksygen Kosack et al. P O2 = 1-15 atm Iwahara et al. luft Iwahara et al. hydrogen Bonanos et al. luft; N % H 2 Scherban et al. behandlet oksygen Scherban et al. behandlet 5 % CO/CO T -1 / K -1 Graf 3.4 Sammenlknng av lednngsevne for 5 % ytterbumdopet strontumcerat. Publsert ltteratur fra Kosack et al. [35], Iwahara et al. [13], Bonanos et al. [46] og Scherban et al. [47]. Alle dataene er fra ACmpedansspektroskop. 53
63 3.4.1 Proton- vs. oksygenonelednngsevne Det er en bred enghet om at en elektrolytt bestående av barumcerat både kan lede oksygenoner og protoner og at transporttallet tl de to onene er avhengg av temperaturen. En overgang fra domnerende proton tl oksygenonelednngsevne oksygenatmosfærer temperaturntervallet 6-1ºC, har bltt bekreftet ved flere ekspermentelle undersøkelser[2, 3, 36, 38, 48]. Bonanos et al. [2] så også denne overgangen fuktg hydrogen ved målnger av vanndamptransport en celle med Gd-dopet BaCeO 3. Dette er kontrast med Guan et al [34], kapttel 3.4. I en annen stude av Bonanos et al. [36] observert de denne overgangen også ved undersøkelser av vanndampnnholdet av eksosgassen en opererende brenselcelle. Denne observasjonen er gjengtt graf 3.4. Dannelsen av vann på katodesden bekrefter protontransport, mens dannelsen av vann på anodesden sgnalserer en oksygenonetransport. Dette fenomenet kan forklares enkelt ved å anta en endrng lkevekten for vannnkorporerng, lknng (2.35). Vann drves ut av strukturen ved høy temperatur og reduserer dermed konsentrasjonen av hydroksdoner. Med denne forklarngen burde samme stuasjonen oppstå for SrCeO 3 [2]. Dette er kke tlfellet, SrCeO 3 beholder den domnerende protonlednngsevnen opp tl 1ºC og har derfor ngen blandet onsk lednngsevne. I følge Bonanos et al. [2] kan overgangen transportmekansmen være et resultat av faseovergangen for BaCeO 3 som SrCeO 3 kke har. Som tdlgere nevnt kapttel 3.1 har lavtemperaturfasen av BaCeO 3 to krystallografske kke-ekvvalente oksygenplasser. I dopet BaCeO 3 ved lav temperatur, vl kke oksygenvakansene okkupere dsse plassene homogent. Dette ndkerer at de to plassene også er energsk ulke. I høytemperaturfasen er oksygenplassene ekvvalente, og vl derfor ha en lk energ. Dette kan kvaltatvt forklares med et bedre forhold for oksygenonelednngsevne ved høye temperaturer. Denne problemstllngen er undersøkt enda en gang av Bonanos, og er behandlet neste kapttel. 3.5 Brenselcelleforsøk H 2 /O 2 -brenselcelle; arbed av Bonanos et al. [48]. Bonanos et al. konstruerte en brenselcelle med Gd-dopet BaCeO 3 som elektrolytt, hvor målet var å studere ytelsen tl en hydrogen/oksygen brenselcelle ved strømtetthet/spennngsmålnger. De ønsket også å dentfsere typen onetransport Gd-dopet BaCeO 3 ved å se på vannnnholdet eksosgassen. Brenselcellen ble operert ved 6 og 8ºC tørr hydrogen og tørr oksygen. AC-mpedansspektroskop ble benyttet tl å estmere elektrolyttmotstanden. Vannnnholdet eksosgassen ble målt ved gasskromatograf og et annet forsøk med et duggpunktmeter. Den ekspermentelle åpne cellespennngen ved 6ºC var samsvar med den teoretske, mens spennngen ved 8ºC var ~15 mv under den beregnede. Dette avvket forklares med en kke-elektrokjemsk reaksjon mellom H 2 og O 2 porene tl elektrolytten ved 8ºC. Det dannes vann drekte på grunn av at prøven kke er tett nok (< 91 %). 54
64 Strømtetthet/spennngsmålnger, gjengtt graf 3.5, vser en øknng strømtetthet nverst med øknngen tykkelse på elektrolytten. Dette er samsvar med at motstanden elektrolytten er avhengg av tykkelsen T = 8 o C Cellespennng / mv Cell 4, (,4 mm) 2 Cell 1, (1,5 mm) Cell 2, (1,2 mm) Cell 3, (,5 mm) Strømtetthet / ma cm -2 Graf 3.5 Spennng/strømtetthet kurver for en brenselcelle basert på Gd-dopet BaCeO 3 -tabletter med forskjellge tykkelser ved 8ºC Ved et 3-elektrodesystem ble de forskjellge bdragene tl spennngsfallet undersøkt. Resultatene er gjengtt graf 3.6. Cellespennng / mv (a) OCV T = 6 o C } } R Elektrolytt η Katode Strømtetthet / ma cm -.2 } η Anode Cellespennng / mv (b) T = 8 o C OCV } } Strømtetthet / ma cm -2 η Anode } η Katode R Elektrolytt Graf 3.6 Forskjellge bdrag tl spennngsfallet for en brenselcelle basert på Gd-dopet BaCeO 3- tablett, 1,2 mm, ved to forskjellge temperaturer, (a) 6ºC, (b) 8ºC. Bonanos et al. kommenterer forskjellene (a) og (b) fra graf 3.6, og er speselt overrasket over det store bdraget spennngsfallet forårsaket av platnaanoden. De forklarer denne store forskjellen med en for lte porøs Pt-anode. Et overpotensal på grunn av massetransport oppstår. At elektrolyttmotstanden er relatvt høyt var mer forventet på grunn av at elektrolytten var relatvt tykk (1,2 mm). Konklusjonen ble at Pt-anoden var den begrensede 55
65 faktoren for ytelsen, sden elektrolyttmotstanden kunne reduseres ved å benytte tynnere prøver. Bonanos et al. utførte også en stabltetstest, ved å konstant trekke 8 ma cm -2 1 tmer fra en brenselcelle som opererte ved 8ºC. Spennngen tl brenselcellen ble kke lavere under peroden. Det konkluderes derfor med at ytelsen tl Gd-dopet BaCeO 3 kke ble negatvt påvrket under brenselcelleforhold. Bonanos et al. målte mengden vanndamp anode- og katodegassene som funksjon av strøm og temperatur. Dette ekspermentet vste at ved økende strøm, økte mengden vann på de to sdene med forskjellge hastgheter. Mengden vanndamp på katodesden var større enn mengden vanndamp på anodesden. Ved 8ºC var protontransporten tre ganger raskere enn oksygenonetransporten, dvs. t H+ =,75 og t O2- =,25. Graf 3.7 vser t O2- mot temperatur. Bonanos et al. forklarer resultatet fra graf 3.7 med en overgang fra ren protontransport ved 6 ºC, tl domnerende oksygenonetransport ved 9ºC. Dette resultatet vser at det dopet barumcerat er en parallell transportprosess av oksygenoner og protoner, der hastgheten av de to varerer med temperaturen..7 Oksygenone-transportnummer Temperatur / o C Graf 3.7 Transporttallet for oksygenoner Gd-dopet BaCeO 3 bestemt fra konsentrasjonen av vanndamp anode og katode eksosgassen fra en brenselcelle 56
66 3.5.2 NH 3 /O 2 -brenselcelle; arbed av McFarlan et al. [4] Denne gruppen har operert en ammonakkbrenselcelle med BaCe.8 Gd.2 O 3-δ som elektrolytt. Platna ble benyttet som både anode og katode materale. I tllegg ble det benyttet to plater, bestående en nkkellegerng for å holde elektrolytten på plass celleoppsettet. Dsse platene var elektrsk solert. Graf 3.8 vser spennng/strømtetthetmålnger som McFarlan et al. gjennomførte forskjellge anodeatmosfærer. Cellespennngen er margnalt mndre med ammonakk som brensel, sammenlknet med hydrogen. Denne effekten var reversbel og ble tlskrevet et lavere hydrogentrykk på grunn av at ntrogenet som ble dannet ved dekomponerngen av ammonakk fortynnet mengden hydrogen. Dekomponerngen av ammonakk antaes å skje på nkkellegerngen. McFarlan et al. konkluderer med at en komplett dekomponerng av ammonakk er mulg på grunn av brenselcellens evne tl å kontnuerlg fjerne hydrogen fra anodesden og at brenselcellen tlfører den nødvendge varmen tl dekomponerngsreaksjonen av ammonakk. MacFarlan et al. dskuterer kke en relatv lav OCV forhold tl teoretsk OCV. Lav OCV kan ndkere en grad av elektronsk lednngsevne, eller komme fra lekkasje mellom anode og katodekammeret. Systemet ble bekreftet lekkasjefrtt ved romtemperatur, men kke ved operasjonstemperatur. 1 5 ml/mn H 2 Cellespennng / mv ml/mn NH 3 25 ml/mn NH 3 1 ml/mn NH Strømtetthet / ma cm -2 Graf 3.8 I-V plott for en 2 cm 2 x 1.3 mm tykk BaCe.8 Gd.2 O 3-δ -elektrolytt hydrogen eller ammonakk ved 7ºC. Gassflowen på katodesden var 5 ml mn -1 luft. 3.6 Cermetelektroder; arbed av Mather et al. [5] G.C. Mather et al. [5] har syntetsert og karaktersert N-SrCe.9 Yb,1 O 3-δ cermetanoder tl bruk brenselceller. Syntesen av cermetmateralet ble gjort ved å forbrenne en blandng av smeltet ntrater og urea. Cermetmateralet ble co-presset på en SCYb grønnkropp etterfulgt av sntrng og reduksjon. For å oppnå en høy porøstet og samtdg beholde en god anode/elektrolytt heft, ble det tlsatt kobolt tl strontumceratet for å senke 57
67 sntrngstemperaturen (125ºC). Sammensetnngen av cermeten var 33 % nkkel og 66 % SCYb. De elektrske egenskapene tl anoden ble karaktersert ved AC-mpedansspektroskop temperaturområdet 4 7ºC og fuktg H 2 og H 2 /N 2 atmosfærer. Graf 3.9 vser en lednngsevne med en aktverngsenerg på ~ 39 kj mol -1. Polarsasjonsmotstanden ved 7ºC er oppgtt å være ~ 5 Ω cm log (σ / S cm -1 ) Arealspesfkk motstand Lednngsevne log (R -1 / Ohm -1 cm -2 ) T -1 / K -1 Graf 3.9 Arrhenusplott av N-SCYb/SCYb/N-SCYb symmetrsk oppsett som vser lednngsevne og arealspesfkk polarsasjonsmotstand. Mather et al. undersøkte også stablteten tl anodecermeten. Prøven ble utsatt for relatvt sterkt reduserende atmosfærer (ph 2 =,87 atm, ph 2 O =,13 atm) ved 7ºC. Det vste seg at en betydelg degraderng hadde skjedd. XRD undersøkelser vste tegn av en fluorttstruktur, med en noe større enhetscelle enn enhetscellen tl CeO 2. Ekspansjonen av CeO 2 gtteret antydes å komme fra en delvs reduksjon av Ce(IV) tl Ce(III). Spor av SrCO 3 ble også observert, som tydet på at overskuddet av SrO har reagert med CO 2 fra luften. Det ble konkludert at kjemske reaksjoner med SCYb reduserende betngelser utgjør et betydelg problem for nkorporerngen av cermetelektroder basert på ceratperovsktter tl bruk protonledende brenselceller. At elektrolyttkomponenten kke reagerer på samme måten som elektroden, det samme tdsntervallet hvor undersøkelsen ble gjort, antyder at degraderngsmekansmen er overflatekontrollert snarere enn at den skjer ved en absorpsjon av hydrogen bulk etterfulgt av degraderng. 58
68 4 Ekspermentelt I oppgaven ble det benyttet 2 forskjellge prøver/elektrolytter, BaCeO 3 dopet med 1 % Y (BCY) og SrCeO 3 dopet med 5 % Yb (SCYb). Prøvekarakterserng ble utført ved XRD og SEM. Begge elektrolyttene ble benyttet brenselcellemålnger (strømtetthet/spennngsmålnger og mpedansspektroskop) for hydrogen/oksygen brenselcellen, bare BCY ammonakk/oksygen brenselcellen. SCYb ble benyttet som elektrolytt 3-elektrodemålnger (mpedansspektroskop) av N-SCYb cermetelektrode. Hydrogen/oksygen brenselcellemålngene ble utført varerende hydrogennnhold og varerende oksygennnhold. Ammonakk/oksygen brenselcellemålngene ble utført ved konstant ammonakknnhold og varerende oksygennnhold. 3-elektrodemålngene ble utført konstant ammonakk og konstant hydrogennnhold. Alle målngene ble også utført ved forskjellge temperaturer. Ammonakkgassen tl bruk brenselcellen ble forsøkt fremstlt. Dette blr omhandlet tl slutt kapttelet. 4.1 Syntese og prøvepreparerng BCY ble syntetsert våtkjemsk ved stratmetoden med etylenglykol [49], en modfsert Pechn prosess [5]. SCYb var ferdg syntetsert konvensjonelt ved spray pyrolyse (Praxar Surface Technologes, U.S.). Det ble benyttet to typer elektroder, Pt og N-SCYb cermet Prøvekarakterserng Karakterserng av prøvene ble utført ved røntgenpulverdffraksjon (XRD) og scannng elektron mkroskop (SEM). Resultatene er gtt kapttel Dffraktometeret som ble benyttet var av typen X-ray dffraktometer D-5 fra Semens. Ved røntgenpulverdffraksjon kan et materales struktur, romgruppe og gtterparametere bestemmes basert på refleksjon fra de krystallografske planene. Elektronmkroskopet som ble benyttet var av typen FEG_SEM, Quanta 2F fra FEI, U.S. med tlhørende EDS fra EDAX. FEG_SEM står for feltemsjon-scannng elektron mkroskop, EDS for energdspersv spektroskop. Alle bldene ble tatt høyvakuum. Instrumentet har to mulge detektorer, en detektor for sekundærelektroner (ETD) og en for tlbakespredte elektroner (SSD). Detektoren som benyttes nevnes blledtekst Syntese av BaCe,9 Y.1 O 2,95 ved stratmetoden Stratmetoden er en avart av sol-gel metoden der man ved polymerserng av stronsyrekomplekser søker å beholde den atomære homogenteten fra væskefasen det faste stoffet. Stronsyre er en treprotsk karboksylsyre med strukturformel som gtt fgur
69 H H C COOH HO C COOH H 2 O H C COOH H Fgur 4.1 Strukturformel av stronsyre. Forskjellge katoner vl danne komplekser med en smeltende stronsyre, det vl oppstå en blandng av katonene på atomært nvå. Under forsktg varmebehandlngen luft av en løsnng med stronsyrekomplekser vl en polymerserng og dekomponerng skje parallelt, nntl man får en gel. Ved å fjerne det resterende vannet fra gelen fåes en såkalt xerogel, som er et amorf, glassaktg materale. Mesteparten av de organske restene fjernes ved vdere oppvarmng av xerogelen luft. Reaksjonslknngen for dannelsen av BCY er som gtt lknng (4.1) og (4.2) med to forskjellge utgangsstoffer for yttrum. Ved bruk av Y 2 O 3 som utgangsstoff: 2 BaCO 3 (s) + 18 Ce(NO 3 ) 3 6 H 2 O(s) + Y 2 O 3 (s) 2 BaCe,9 Y.1 O 2,95 (s) + 54 NO 2 (g) + 2 CO 2 (g) + 18 H 2 O(g) + 8,5 O 2 (g) (4.1) Ved bruk av Y(NO 3 ) 3 5 H 2 O som utgangsstoff: 1 BaCO Ce(NO 3 ) 3 6 H 2 O + Y(NO 3 ) 3 5H2O 1 BaCe.9 Y.1 O 2, NO 2 (g) + 1 CO 2 (g) + 59 H 2 O(g) + 5 O 2 (g) (4.2) Utgangsstoffer for syntesen: Yttrumntrat pentahydrat (Y(NO 3 ) 3 5 H 2 O), 99,9 %, Aldrch, U.S. Cerumntrat hexahydrat (Ce(NO 3 ) 3 6 H 2 O), >99, % Fluka, Svets. Barumkarbonat (BaCO 3 ), >99, %, Fluka, Svets. Etylen glykol, EG, (C 2 H 6 O 2 ), 99,5 %, Merck, U.S. Stronsyre monohydrat, CA, (C 6 H 8 O 7 H 2 O), 99 %, Prolabo, Frankrke. Syntesegangen er vst fgur
70 EG CA Varmer og rører ca. 4 mn. ved 5ºC Deler ca 5/5 Varmer og rører ca. 1t. ved 5ºC Y(NO 3 ) 3 5 H 2 O Ce(NO 3 ) 3 6 H 2 O Alternerende blandng. BaCO 3 Varmer og rører ca. 2t. ved 5ºC Varmer og rører ca. 2,5t. ved 8ºC Metall-strat kompleks Varmer tørkeovn ca. 12t. ved 9ºC Polymersert kompleks Varmer tørkeovn ca. 4t. ved 29ºC Polymer forløper Varmerbehandler ved 9ºC ca. 4t. BaCe,9 Y,1 O 2.95 Fgur 4.2 Flytskjema for syntesen av BCY ved strat metoden. Stronsyren og etylenglykolen ble henholdsvs benyttet som kompleksbnder og reaksjonsmedum. Den molare mengden av EG/CA/Me (Me = Y(NO 3 ) 3 5 H 2 O, Ce(NO 3 ) 3 6 H 2 O og BaCO 3 ) ble satt tl 2:5:1. Syntesen startet med at stronsyren ble løst etylenglykolen under rørng ved ca. 5ºC 4 mnutter for å lage den kompleksbndende løsnngen. Løsnngen ble så delt to begerglass for å hndre at en tungtløselg cerumforbndelse dannes når barumkarbonat tlsettes. Cerumntrathexahydrat og yttrumntrat-pentahydrat løste seg 61
71 under rørng ved 5ºC ca. 1 tme tl en klar gjennomsktg løsnng. Ved tlsettng av barumkarbonat det andre begerglasset ble brusng observert, noe som kan forklares ved at barumkarbonatet løser seg og CO 2 -gass utvkles. Denne løsnngen ble satt tl rørng ved 5ºC. Etter ca. 2 tmer, kunne det fortsatt observeres små hvte korn løsnngen av antagelgvs kke løst barumkarbonat. Resten av løsnngen hadde en hvt blakket farge. De to separate løsnngene ble blandet ved alternerende mksng (løsnngene ble helt over hverandres begerglass 5 ganger), og satt tl rørng ved 8ºC. Etter ca. 5 tmer var løsnngen gulaktg og klar/gjennomsktg uten synlge tegn tl utfellnger, som tydet på at resterende barumkarbonat var bltt løst. Løsnngen hadde en srupslknende konsstens. Begerglasset ble nå satt nn tørkeovn for gelerng 12 tmer ved 9ºC. Gelen fkk en jevn brunaktg farge. Gelen ble så tørket 4 tmer ved 29ºC. Etter tørkngen hadde gelen bltt en slags xerogel, dvs. et porøst gråaktg materale. Xerogelen antas nå å være en homogen blandng av barum-, cerum- og yttrumforbndelser på atomært nvå. Den sste behandlngen er kalsnerng. Xerogel-pulveret ble mortet og deretter presset tl tabletter for å henholdsvs få mndre korn og en kortere avstand mellom kornene. Tablettene ble overført tl alumnabegre og temperaturbehandlet en elektrsk ovn med vfte. Temperaturprogrammet er vst graf Temperatur / ºC Td / tmer Graf 4.1 Temperaturprogram for kalsnerngen av BCY. For å mnmere mulgheten for at Ba reagerer med CO 2 fra luften, kapttel 3.2, ble alumnabegrene ble tatt ut av ovnen ved ca. 6ºC for en raskere avkjølng tl romtemperatur. Pulveret ble satt ekskator så raskt det var mulg med hensyn på høy temperatur. 62
72 Syntesen ble utført totalt 5 ganger, med blandet hell. En oppsummerng av de 5 forsøkene er gtt tabell 4.1. Tabell 4.1 Resultat fra syntesen av BCY. Det effektvt høye CO 2 partaltrykket under kalsnerngen av batch III er tlstedet pga. at alumnabegeret som nneholdt reaksjonsblandngen var tldekket. Karbondoksdet som utvklet seg fra reaksjonen ble gjen nne alumnabegeret. Batch I II III IV V Resultat Bruk av Y 2 O 3 som utgangsstoff for yttrum, gjorde at dekomponerngen av stronsyren skjedde for tdlg. Tungtløselg CeO 2 ble dannet under for rask tlsettng av barumkarbonat. Et for høyt effektvt CO 2 trykk under kalsnerngen førte tl en forskyvnng av lkevekten mot BaCO 3 og CeO 2 som produkter, lknng (3.1). Pulveret ble kalsnert på nytt, XRD vste at pulveret var BaCe,9 Y,1 O 2,95. Delvs ukontrollerbar dekomponerngsreaksjon av stronsyren. Ved ca. 12 tmers henstand, ble allkevel resultatet ok Sntrng Et dlatometer (Dl 42C, Netzsch, GmbH, Tyskland) ble benyttet for å fnne den deelle sntrngstemperaturen tl SCYb og BCY. Dlatometeret er et nstrument som måler ekspansjonen eller sammentreknngen av et materale som funksjon av temperatur. For BCY ble det utført 2 dlatometerforsøk for å se på om det var en sgnfkant forskjell på et møllet og et kke-møllet pulver. Det ble benyttet alumnaskver mellom prøven og dlatometeret for å unngå kontamnerng fra delen av dlatometeret som var drekte kontakt med prøven. Resultatet er gjengtt graf BCY1 kke møllet BCY2 møllet ca. 1 tme L/L Temperatur / o C Td / mn Graf 4.2 Sntrngskurve for BCY møllet og kke-møllet utført et dlatometer. 63
73 Tettheten på grønnkropp og sntret prøve ble målt med en mkrometerskrue, og er gjengtt tabell 4.2. Tabell 4.2 Tetthet, forhold tl teoretsk tetthet, av grønnkropp og sntret prøver. Tetthet grønnkropp Tetthet sntret prøve BCY 1 kke møllet 59 % 95 % BCY 2 møllet 57 % 96 % Fra graf 4.2 er det mulg å se at prøven, der pulveret ble møllet en tme, sntret bedre enn prøven der pulveret kke ble møllet på forhånd. Det møllede pulveret gr også følge tabell 4.2 en noe høyere tetthet. En stor uskkerhet ved målngen av tettheten gjør at forskjellen mellom tettheten av de to prøvene kke er sgnfkant. Dette fører og tl at det kke med skkerhet kan ses at det er fordelaktg å mølle pulveret. Sntrngstemperaturen for BCY fnnes ved å dervere sntrngskurven graf 4.2. Der den derverte er størst vl det foregå en maksmal sntrng. For BCY2 er det to maksma, et ved ca. 115ºC og et ved ca. 145ºC. En generell tolknng av dsse to toppene vl være at sntrngen kke kan gjøres ved 115ºC da det gjen skjer en øknng sntrngen ved 148ºC. Ut fra sntrngsforløpene ble sntrngstemperaturen av BCY tabletter satt tl mellom 145ºC og 155ºC. Prøvene for elektrsk karakterserng ble presset en 25 mm presse, og dlatometerprøvene ble presset en 1 mm presse. Det vste seg at en prøve som ble sntret ved 145ºC, med 25 mm presse, fkk en relatv tetthet < 9 %. Denne forskjellen tetthet, mellom prøvene presset med 1 og 25 mm presse sntret ved 145ºC, kan ha sammenheng med at det vl være et jevnere press, en mer optmal fordelng av pulveret, 1 mm pressen. Vdere sntrng av BCY ble derfor utført ved temperaturer over 15ºC. For SCYb ble det også utført dlatometr for å fnne den mest deelle sntrngstemperaturen. Resultatet er gjengtt graf
74 .5. SCYb tl 155 o C L/L O Temperatur / o C Td / mn Graf 4.3 Sntrngskurve for SCYb utført et dlatometer. Ved samme type tolknng som for BCY ble sntrngen av SCYb-prøver tl elektrsk karakterserng utført mellom ºC. Dlatometerprøven og prøvene som ble benyttet brenselcelle og 3-elektrodemålngene hadde alle en tetthet over 95 % av teoretsk tetthet. Det ble benyttet en bnder under pressngen av grønnkroppene. Utgangspulveret ble mortet og blandet med en bnder for å skape en bedre mekansk stabltet. Bndemddelet består av totalt 1 vekt % av polymerene B-6 og B-72 9 vekt % etylacetat. Etter etylacetatet var dampet av ble pulveret presset tl tabletter under 5 tonns trykk for 25 mm tabletter og 1 tonn trykk for 1 mm tabletter. Tabell 4.3 vser tykkelse og relatv tetthet på prøvene som ble benyttet oppgaven. Tabell 4.3 Overskt over prøvene som ble benyttet brenselcelle og 3-elektrodemålnger. Tettheten for prøven benyttet 3-elektrodemålngene kunne kke bestemmes sden elektrodene ble malt drekte på grønnkroppen. Ved forsøk på å benytte en lknende prøve tl brenselcellemålnger ble det funnet at prøven kke hadde en tlfresstlende tetthet (> 93 %). Referanser tl teoretsk tetthet er for SCYb[51] og for BCY[18]. Forsøk Elektrolytt materale Sntrngstemperatur Tykkelse Relatv tetthet Brenselcelle BCY (Batch III) 155ºC 1,525 mm > 93 % SCYb 145ºC,97 mm > 96 % 3-elektrodemålng SCYb 125ºC 1,1 mm < 9 % 65
75 4.1.4 Elektroder I oppgaven ble det benyttet to forskjellge elektroder. Platnaelektroder ble brukt ved brenselcelleforsøkene (strømtetthet/spennng og AC-mpedansspektroskop) både på BCY og SCYb elektrolyttene. En N-SCYb cermetelektrode ble undersøkt på SCYb elektrolytt ved en 3-elektrodemålng. Platnaelektrodene ble festet på ferdg sntret BCY og SCYb. Et tynt lag med platnamalng (Penture Pt A3788A, Metalor, Frankrke), ca. 1 cm dameter, ble først malt på hver sde av prøven. På det første laget ble det festet et platnanett, som så ble etterfulgt av 2 nye lag med platnamalng. Mellom hvert påmalte lag ble malngen tørket varmeskap ved 15ºC ca. 1 tme. Elektrodene ble varmebehandlet ved 1ºC 1 tme. For å undersøke elektrodene ble motstanden over hver elektrode målt med et multmeter (UnVolt DT-888). Ved en motstand under,5 Ω ble elektroden ansett for å være tlstrekkelg god. Tabell 4.4 vser en overskt over elektrodearealet tl prøvene som ble benyttet under de forskjellge målngene. N-SCYb cermetelektroden ble preparert fra en NO-SCYb forløper. En blandng av NO (99,9 %, Baker Ltd, Nederland) og SCYb (99,9 %, Praxar Surface technologes, U.S.) ble fremstlt ved å kulemølle 1, g (,143 mol) NO og 5,3 g (,18 mol) SCYb sopropanol 3 mnutter. Slurryen som dannes ble helt over en kolbe og tørket varmeskap over natta ved 1ºC. Forløperpulveret ble varmebehandlet ved 1ºC 3 tmer for å unngå en separasjon den ferdge malngen. Etter varmebehandlngen ble pulveret sktet (d =,36 mm) for å få ut de små partklene. 1, g av de små partklene ble nå blandet med,72 g av polyvnylpyrroldn (PVP K25, Fluka Cheme AG, Svets) og gjort vskøst ved å tlsette 5 vol % etylenglykol sopropanol. I motsetnng tl Pt-elektroden ble cermetmalngen påført grønnkropptablettene. Det ble påført tre lag med cermetmalngen. Hvert lag ble tørket tørkeskap ved 15ºC ca. 1 tme. De ferdge malte tablettene ble sntret ved 125ºC 5 tmer. Langsom oppvarmng/avkjølng var vktg for å unngå spennnger mellom cermetelektroden og prøven som følge av en forskjellg termsk utvdelse. Følgende temperaturprogram ble benyttet: tl 5ºC 12 K/tme, 5 tl 1ºC 2 K/tme, 1 tl 125ºC 12 K/tme, 5 tmer soterm ved 125ºC og 125 tl ºC 12 K/tme. Reduserngen av NO tl metallsk N, ble gjort etter at tabletten var montert målecellen. Ved 1ºC, under oppvarmng argon, ble atmosfæren endret tl en blandng av 1 % fuktg hydrogen og argon. Lednngsevnen tl prøven ble målt som funksjon av td under reduksjonen. Reduksjonen var antatt å være ferdg når lednngsevnen vste et stablt nvå. Tabell 4.4 vser elektrodearealet tl N-SCYb cermetelektroden som ble benyttet 3- elektrodemålngen. 66
76 Tabell 4.4 Overskt over elektrodematerale og elektrodeareal for prøvene som ble benyttet brenselcelle og 3- elektrodemålnger. For de respektve prøvene var elektrodearealet det samme for begge elektrodene. Elektrodearealet for referanseelektroden tl prøven benyttet 3-elektrodemålngene ble kke målt. Forsøk Elektrolyttmaterale Elektrodematerale Elektrodeareal Brenselcelle BCY (Batch III) Pt, med Pt nett,88 cm 2 SCYb Pt, med Pt nett,87 cm 2 3-elektrodemålng SCYb N-SCYb cermet,64 cm 2 En SCYb prøve med N-SCYb cermetelektrode ble forsøkt sntret tett tl bruk brenselcellemålnger. Denne prøven ble sntret ved 125ºC. Det vste seg at denne prøven kke var tlstrekelge tett med tanke på gasspermeabltet, tabell 4.4. En ny prøve ble derfor sntret ved en høyere temperatur, 135ºC. Ved denne temperaturen vste det seg at cermetelektroden kke heftet tl elektrolytten. Cermetelektroden hadde antagelgvs sntret først, og når elektrolytten sntret ble det et stort mekansk stress på cermetelektroden. Det ble konkludert med at et vdere arbed var nødvendg for å kunne produsere en tett tablett med cermetelektrode. En mulg løsnng kan være å tlsette kobolt tl SCYb for å senke sntrngstemperaturen [5]. N-BCY cermet ble syntetsert og malt på BCY elektrolytt med samme metode som N-SCYb cermeten. En prøve ble sntret ved 15ºC. Ved stude SEM det vste seg at cermetmateralet hadde smeltet/reagert (blde 5.6). En ny prøve ble derfor sntret ved 145ºC. Denne prøven vste seg ved SEM/EDS analyse å ha et underskudd av barum (blde 5.5). BaO vl lett kunne dampe av ved høye temperaturer (lknng (2.32)). En mulg N-dffusjon nn BCY elektrolytten ble også observert sden den gjennomgående fargen elektrolytten var endret. Dette problemet er tdlgere observert [52]. Vdere forsøk med N-BCY cermet ble kke utført. En mulg løsnng på problemet med avdampnng av BaO kan være å sntre nærvær av BaO pulver. Damptrykket fra BaO pulveret vl da hndre avdampnng av BaO fra N-BCY cermetelektroden. 67
77 4.2 Målecelle Målecellen (Probostat, NorECs, Norge) som ble benyttet ved strømtetthet/spennng og ACmpedansspektroskop er vst fgur 4.3 og 4.4. Den nedre delen av cellen, hvor nngangene for gass og elektrodene befnner seg, består av rustfrtt stål for å kunne motstå ugjestmlde kjemske forhold som ammonakkgass. Denne delen ble også avkjølt ved hjelp av et vannkjølesystem med temperert vann for å unngå for høy temperatur, sden det ble benyttet gummrnger for å gjøre målecellen gasstett. Fgur 4.3 vser hvordan den øvre delen av målecellen er bygget opp. Prøven blr holdt på plass av en fjærbelastet alumnarng som ved brenselcellemålngene også presser mot en gullrng for å få en god forseglng. For å oppnå god kontakt mellom den ytre elektrodekontakten og elektroden, ble den ytre elektrodekontakten presset ned mot elektroden med det ytre kvartsgassrøret. Den ndre elektrodekontakten settes ned det ndre alumnagassrøret, for å kunne bruke det ndre gassrøret tl å presse den ndre elektrodekontakten mot den ndre elektroden på prøven. Temperaturen ved prøven ble målt ved hjelp av et platna/platna-1 % rhodum termoelement. Temperaturmålnger med et slkt termoelement er basert på at det oppstår en temperaturavhengg spennng mellom to ulke materaler som er kontakt med hverandre to punkter. Fgur 4.3 Sksse av målecellen med en forstørret øvre del. Fguren er modfsert fra [53] 68
78 Fgur 4.4 Blder av målecellen som ble benyttet brenselcelle- og 3-elektrodemålngene. 4.3 Gassmkserenheten Strømtetthet/spennng og AC-mpedansspektroskop ble utført forskjellge gasssammensetnnger. Gass-sammensetnngen ble kontrollert ved en gassmkserenhet. To forskjellge varanter av denne enheten er vst fgur 4.5 og 4.6. Varant A for gasssammensetnnger med hydrogen og oksygen, og varant B for gass-sammensetnnger med et nnhold av ammonakk Varant A; gassmkser for H 2 /O 2 brenselcellen Denne enheten ble benyttet tl hydrogen/oksygen brenselcelleforsøk (strømtetthet/spennng og AC-mpedansspektroskop). Argon var alle forsøkene fortynnngsgassen. Helum, ntrogen og luft kunne om ønskelg også benyttes. Varant A kan sees å bestå av to deler, en del med hydrogen og en del med oksygen. Blandngsforholdet mellom hydrogen/argon og oksygen/argon ble bestemt ved å kontrollere mengden av hver gass. Dette ble gjort ved hjelp av masseflowkontroller. Dsse elektronsk kontrollerte flowmeterene ble operert ved hjelp av et LabVew [54]. Programmet hadde nnebygd kalbrerngskurver for hver av de respektve gassene, som gjorde det mulg å få mengden gass ml mn -1. De forskjellge blandngsforholdene ble dermed enkle å kontrollere. 69
79 Etter at blandngsforholdene er satt, kan gassblandngene fuktes, tørkes eller gå drekte tl målecellen. Fuktngen foregår ved at gassblandngene bobles gjennom en mettet kalumbromdløsnng. Gassen oppnår da et vanndampnnhold på ~,2 atm (8 % av fullt fuktet gass). Ved tørkng ledes gassene gjennom et tørkeledd med fosforpentoksd. Forsforpentoksd har svært høy affntet for vann, som gjør at gassene vl få et vanndampnnhold på mndre enn 1 ppm. Det er også mulg å blande tørr og fuktg gass, som vl mulggjøre en kontrollerng av vanndampnnholdet gassblandngen. Dette gjøres va to manuelle flowmetere, som kan kontrollerer gass-strømmen/flowen ved å justere åpnngen en nålventl. Gass-strømmen ledes gjennom et glassrør, der høyden tl en glasskule ser noe om mengden gass. Den vdere gass-strømmen går nå tl et sste manuelt flowmeter som bestemmer strømmen av gass tl cellen. Etter hvert mulge blandnngspunkt er det montert bobleledd for å kontrollere trykket systemet og for å ha en skkerhet mot eventuelle tlstopnnger. Dsse leddene nneholder dbutylftalat. Dbutylftalat har et lavt damptrykk og omtrent den samme tettheten som vann, noe som gjør det meget godt egnet Varant B; gassmkser for NH 3 /O 2 brenselcellen Denne varanten, fgur 4.6, ble benyttet tl ammonakk/oksygen brenselcelleforsøk (strømtetthet/spennng og mpedansmålnger) og tl hydrogen og ammonakk 3- elektrodemålnger. Varanten er veldg lk varant A, ammonakktlførselen og ammonakkfeller er tllegg. Ammonakkgassen ble hentet fra en gassbeholder med p NH3 ~ 6 bar. En nålventl av stål kontrollerte mengden gass fra bomben tl det manuelle flowmeteret. Fra dette flowmeteret ble ammonakkgassen blandet med argon og deretter ført tl målecellen. Argon kom fra den delen modfkasjon A som leverte hydrogenet. For å skre mot en tlstopnng av gassen tl målecellen ble det montert en ammonakkfelle etter blandngspunktet. Denne ammonakkfellen fungerte også som et bobleledd for å kontrollere trykket. I brenselcelleforsøkene ble oksygenet ført tl cellen ved oksygendelen av varant A. Målecellens to gassutganger ble ført tl hver sne ammonakkfeller. Ammonakkfellen er forklart kapttel
80 Fgur 4.5 Gassmkserenheten, varant A, for H 2 /O 2 brenselcellen. 71
81 Fgur 4.6 Gassmkserenheten varant B, for NH 3 /O 2 brenselcellen. 72
82 4.3.3 Målng av mengden ammonakk For å fnne blandngsforholdet ble det benyttet et såpeflmflowmeter (Soap flm flowmeter, HP, U.S.) og en stoppeklokke. Først ble mengden ammonakk undersøkt ved å justere høyden på kulen det manuelle flowmeteret tl ~ 7 mm, og måle tden en såpeboble benyttet å bevege seg et volum på 1 ml. Det samme forsøket ble utført for argon. En rekke målnger ble gjort. Målngene for ammonakk var relatvt ustable. Resultatet var for ammonakk 12 ± 3 s ml.1 og for argon 11,3 ±,1 s ml -1. Dsse resultatene tlsvarer 5 ± 1,25 ml mn -1 ammonakk og 5,3 ±,1 ml mn -1 for argon. I brenselcelle og 3-elektrode-målngene ble ammonakk fortynnet med argon. Både ammonakk- og argonflowmeteret ble justert tl ~ 7 mm. Mengden ammonakk som ble benyttet målngene er derfor ~ 5 % ut fra beregnngene over. Dersom det antas at all ammonakk dekomponerer tlsvarer denne mengden ammonakk ~ 38 % hydrogen gtt ved forholdet mellom antall mol ntrogen og hydrogen som dannes ved dekomponerngsreaksjonen gtt under 2 NH 3 (g) = 3H 2 (g) + N 2 (g) (4.3) Termodynamsk sett vl denne dekomponerngsreaksjonen øke med økende temperatur følge graf 4.4. I temperaturntervallet 6 tl 9ºC vl det ut fra denne grafen kunne antas at nesten all ammonakk vl dekomponere, forutsatt at knetkken kke er begrensende. 5 2NH 3 (g) = 3H 2 (g) + N 2 (g) G / kj mol Temperatur / o C Graf 4.4 Gbbs energ mot temperatur for dekomponerngsreaksjonen tl ammonakk. Termodynamske data fra [21] 73
83 4.4 Strøm/spennngsmålnger Dsse målngene ble utført ved bruk av en kombnert galvanostat/potentostat (EG&G modell 363 Prnceton Appled Resarch, U.S), galvanostatsk modus. Spennngen ble lest av med et multmeter (UnVolt DT-888, Tyskland). Potentostaten/galvanostaten ble operert ved å manuelt endre mengden strøm som ble trukket. Målngene ble utført ved følgende betngelser: Hydrogen/oksygen brenselcellen Temperaturer: 6, 7, 8 og 9 ºC. Gass-sammensetnng anode: 1, 2, 4 og 6 % fuktg hydrogen fortynnet med fuktg argon tl en totalflow på 7 ml mn -1. Gass-sammensetnng katode: 1, 2, 4, 6, 8 % fuktg oksygen fortynnet med fuktg argon tl en totalflow på 7 ml mn -1. Ammonakk/oksygen brenselcellen Temperaturer: 6, 7, 8 og 9ºC. Gass-sammensetnng anode: ~ 5 % ammonakk, se kapttel 4.3.3, fortynnet med fuktg argon. Gass-sammensetnng katode: 1, 2, 4 og 6 % fuktg oksygen fortynnet med fuktg argon tl en totalflow på 7 ml mn -1. Fuktg gass betyr at gassen nneholder 2,1 % vanndamp. Verder for totalflow er fra mengden gass blandet etter massflowkontrollerne. 4.5 AC-mpedansspektroskop AC-mpedansspektroskop ble utført med en Schlumberger SI 126 Impedance/gan-phase Analyzer, U.K som kan måle frekvensområdet 1 µhz tl 32 MHz. Ampltuden tl sgnalet kan vareres fra tl 3 V, og oppløsnngen er 5 mv. Inngangsmpedansen tl nstrumentet er 1 MΩ Topunktsmålnger Fgur 4.5 vser det ekspermentelle oppsettet for topunktsmålnger. Det ble utført topunkts AC-mpedansspektroskop på de samme prøvene som ble undersøkt ved I-V målnger. Impedansspektre ble målt ved 6, 7, 8 og 9ºC, 1, 2, 4 og 6 % H 2 fortynnet med Ar på anodesden og 1 % O 2 fortynnet med Ar på katodesden. For cellen med BCY som elektrolytt ble det også målt mpedansspektre ved 7, 8 og 9ºC, med 1 og 6 % O 2 fortynnet med Ar på katodesden og ~ 5 % NH 3 fortynnet med Ar på anodesden. Målngene ble utført med en oscllasjonsspennng på 1 V, bas og frekvensområdet,1 Hz tl 1 MHz. 74
84 4.5.2 Trepunktsmålnger Målngene ble utført på en prøve bestående av SCYb som elektrolytt og N/SCYb-cermet som arbeds-, mot- og referanseelektrode. Prøven med elektroder er skssert fgur 4.7. Arbedselektrode Arbedselektrode Elektrolytt Referanseelektrode Referanseelektrode Motelektrode Referanseelektrode Motelektrode Fgur 4.7 Elektrodeoppsett for trepunktsmålnger, modfsert fgur fra [53]. Referanseelektroden plasseres mellom det ndre bærerøret og prøven målecellen. For trepunktsmålnger er det to mulgheter å koble elektrodelednngene tl mpedansspektrometeret [55], som llustrert fgur 4.8. En mulghet er å koble low spennngslednngen og low strømlednng (INPUT 1) tl arbedselektroden ( LO-pn konfgurasjon). Den andre mulgheten er å koble hgh spennngslednngen og hgh strømlednngen (GEN OUTPUT) tl referanseelektroden ( HI-pn konfgurasjon). I begge tlfeller kobles gjenværende spennngslednng med referanseelektroden, og den gjenværende strømlednngen tl motelektroden. Under målngene ble bare LO-pn konfgurasjonen benyttet. For å måle på motelektroden ble lednngene koblet om på målecellen. Fgur 4.8 HI-pn og LO-pn konfgurasjon for målng av elektrodempedanser [55]. Treelektrodemålngene ble utført temperaturområdet 5 9ºC, hver 5ende grad, 5 % H 2 fortynnet med Ar og ca. 5 % NH 3 fortynnet med Ar. AC-mpedansspektroskop ble utført for både arbeds og motelektroden. Målngene ble utført med en oscllasjonsspennng på,1 V, bas og frekvensområdet,1 Hz tl 1 MHz. 75
85 4.6 Produksjon av ammonakk tl bruk laboratoret. De aktuelle kldene for ammonakk tl bruk laboratoret er ammonakkløsnng, ammonakk dannet en kjemsk reaksjon og ammonakk fra en gass-sylnder. Dsse kldene ble undersøkt som vdere forklart. Ammonakk fra en ammonakkløsnng er problematsk med tanke på at brenselcellen trenger en jevn tlgang på et relatvt høyt partaltrykk av ammonakk. Ved å boble en nert gass gjennom en konsentrert ammonakkløsnng (ca. 25 vol %) vl konsentrasjonen av ammonakk løsnngen bl lavere med td, sden antall mol NH 3 og H 2 O kke er den samme væskefasen som gassfasen, ammonakk har en mye større flyktghet enn vann. For å tlfredsstlle kravet om en jevn tlførsel av ammonakk, dvs. at molmengdene må være lke, må ammonakkløsnngen være veldg fortynnet. Denne metoden vl dermed g et meget lav partaltrykk av ammonakk, noe som gjør den uegnet som klde av ammonakk tl brenselcellen der det som sagt kreves en mye større mengde ammonakk. Ammonakk dannes flere forskjellge kjemsk reaksjoner. På laboratoreskala er den mest vanlge metoden å varme på en blandng av ammonumsalt og en base. For å undersøke om denne metoden kunne benyttes tl ammonakk-klde mot brenselcellen ble det satt opp et system der nert gass ble sendt gjennom en reaktor og vdere tl et massespektrometer (fgur 4.9). I massespektrometeret (QMG 421, Quadrupole Mass Spectrometer, Baltzers, Lchtensten) ble produktgassen undersøkt med tanke på mengde ammonakk og om mengden var stabl over en lengre perode. Valget av ammonumsalt og hvlken base som skulle benyttes ble gjort fra termodynamske betraktnnger. Gbbs energ ble beregnet for forkjellge reaksjoner med data fra [7]. Reaksjonen som ble valgt for vdere undersøkelse er gtt lknngen under, 2NH 4 Cl(s) + Ca(OH) 2 (s) 2NH 3 (g) + 2H 2 O(g) + CaCl 2 (s) (4.4) Mengden ammonakk fra reaksjonen kunne reguleres ved å endre temperaturen tl reaksjonsblandngen. Totalt ble det utført 3 forsøk på å lage ammonakk fra reaksjon (4.4) med forskjellge reaksjonsbetngelser. 76
86 Fgur 4.9 Forsøksoppsett for produksjon av ammonakk tl bruk laboratoret. Forsøk 1 Molare mengder av ammonumklord og kalsumhydroksd ble ved nn og blandet ved bruk av kuler en plastkontener ca 1 tme. Blandngen ble så overført tl en glassbeholder, reaktor, og satt nn forsøksoppsettet. Temperaturen ble kontrollert med et vannbad, satt tl 25ºC. Resultatet fra dette første forsøket var kke tlfredsstllende. Mengden ammonakk var ustabl og for lten. Forsøk 2 Samme oppsett som 1, men med høyere temperatur for å øke mengden ammonakk. Resultatet var fortsatt kke tlfredsstllende da det var ustablt. Forsøk 3: Reaksjonen gjøres vått. En løsnng mettes med molare mengder av saltet og basen. I tllegg tlsettes CaCl 2, for å få en aktvtet av dette produktet lk 1 ved start. Teoretsk skulle nå mengden ammonakk være konstant, tl saltet eller hydroksdet ble brukt opp. Resultatet fra dette forsøket er vst graf 4.4. Mengden ammonakk var for lten. Temperaturen ble derfor økt fra 25ºC tl 5ºC, som skulle g en øknng mengden ammonakk. Resultatet vste at mengden ammonakk fortsatt ble for lten. I tllegg var heller kke mengden ammonakk stabl. 77
87 .5 Ammonakksyntese forsøk 3.4 ~ pnh 3 / bar Td / tmer Graf 4.4 Produksjon av ammonakk forsøk 3. Hullene grafen er på grunn av at målngene ble slått av. Mengden ammonakk er for lten og ustabl tl å kunne brukes brenselcellen. Ekspermentet med ammonakk fra en kjemsk reaksjon ble etter dsse forsøkene avsluttet. De ekspermentelle resultatene vste at det var vanskelg å lage en stabl mengde ammonakk over en lengre perode. Tl senere ekspermenter ble det benyttet en gassbeholder av ammonakk. 4.7 Ammonakkfelle Ammonakk er svært skadelg for mennesker. Ammonakkgassen som ble benyttet under forsøkene måtte derfor uskadelggjøres eller fjernes på en skker måte. Dette ble gjort ved bruk av en ammonakkfelle. Ammonakkfellen består av to bobleledd, ett med vann og ett med melkesyre (fgur 4.1). Vannfrtt melkesyre er flytende, og vl danne et flytende ammonakk-kompleks. Begge forbndelsene er også løselge vann. Nøytralserngen kan sees ved følgende reaksjonslknng NH 3 (g) + C 3 H 6 O 3 (aq) NH 4 C 3 H 5 O 3 (aq) (4.5) Ammonumlactat er flytende. Vannleddet fungerer som en buffer og en sperre, slk at melkesyren kke har en drekte kontakt med ammonakkgassen. Det ble tlsatt ndkator, fenolrødt, tl melkesyren for å observere når melkesyren var bltt mettet med ammonakkomplekset. 78
88 Fgur 4.1 Ammonakkfelle 79
89 5 Resultater Prøvekarakterserngen ble utført ved XRD og SEM, kapttel Hydrogen/oksygen og ammonakk/oksygen-brenselcellen ble undersøkt ved I-V målnger (strømtetthet-spennng) og AC-mpedansspektroskop, henholdsvs kapttel 4.4 og 4.5. N-SCYb cermetelektroden ble undersøkt ved 3-punkts AC-mpedansspektroskop, kapttel Prøvekarakterserng Røntgendffraksjon Fgur 5.1 vser spekteret av BCY batch III. Kalsnerngen av denne batchen ble, som tdlgere nevnt tabell 4.1, utført et for høyt effektvt partaltrykk av CO 2. Dffraktogrammet vser topper som tlhører BaCO 3 og CeO 2. Fgur 5.2 vser røntgenspekteret tl batch IV. Pulveret ble funnet å være enfase av BaCe,9 Y,1 O 2, CeO2 Intenstet CeO2 CeO2 4 BaCO3 CeO2 BaCO3 BaCO3 BaCO3 CeO2 CeO2 CeO2 CeO2 CeO2 BaCO Theta Fgur 5.1 Røntgendffraksjonsspekter av BCY, batch III. På grunn av et for høyt effektvt CO 2 -trykk under kalsnerngen har lkevekten bltt forkjøvet mot CeO 2 og BaCO 3. Scannet ble utført med følgende parametere: PSD fast-scan. Start 1.º - slutt 9.15º - step.16º - step td 1s temperatur 25ºC. 8
90 1 8 Intenstet Theta Fgur 5.2 Røntgendffraksjonsspekter av BCY, batch IV. Scannet ble utført med følgende parametere: PSD fastscan. Start 1.º - slutt 9.15º - step.16º - step td 1s temperatur 25ºC SEM Blde 5.1 og 5.2 vser mkrostrukturen av henholdsvs BCY og SCYb. Kornstørrelsen er ca. 2 µm dameter for begge prøvene. Den tette sammengrongen av kornene, speselt for SCYbprøven, vtner om god sntrng. Porene BCY-prøven er vanskelg å se, mens porene SCYbprøven sees bulk og korngrensene, speselt trppelpunktene. Den relatve tettheten av de to prøvene er 94 % for BCY og 95 % for SCYb. BCY prøven ble sntret ved 1525ºC og SCYb ved 145ºC. Blde 5.3 vser grenseflaten av en N-SCYb cermetelektrode på SCYb elektrolytt. Prøven med elektrode ble produsert som forklart kapttel Bldet vser at cermetelektroden er porøs og består av en relatvt homogen blandng av nkkel og SCYb. Tykkelsen på cermetelektroden er ~ 3 µm. Blde 5.4 vser en redusert N-SCYb cermetelektrode, de mørke nkkelkornene har en dameter på ~ 4 µm, mens dameteren på SCYb kornene er ~ 2 µm. En cermetelektrode av nkkel og BCY er vst blde 5.5 og 5.6. Blde 5.5 vser en N-BCY cermetelektrode sntret ved 145ºC, mens blde 5.6 vser en N-BCY cermetelektrode sntret ved 15ºC. I elektroden som er sntret ved 15ºC ser det ut som om nkkelet har reagert med BCY, og dannet en tett elektrode. Dette ser kke ut tl å ha skjedd ved 145ºC. De små lyse kornene som stter på større lyse korn blde 5.5 vste et underskudd av barum ved EDS analyse. Barumoksd har antagelgvs dampet av under sntrngen. 81
91 2, µm 2, µm Blde 5.1 BCY som vser kornstørrelsen. Bldet er tatt med ETD detektor. Blde 5.2 SCYb som vser kornstørrelsen. Bldet er tatt med ETD detektor. 5,µm 5, µm Blde 5.3 Grenseflate av N-SCYb cermetelektrode på SCYb elektrolytt. Lyse områder SCYb, mørke N. Bldet er tatt med SSD detektor. Prøven ble produsert samarbed med [56]. Blde 5.4 Redusert N-SCYb cermetelektrode. Lyse områder SCYb, mørke N. Bldet er tatt med ETD detektor. 82
92 2, µm 2, µm Blde 5.5 Cermetelektrode av BCY og N, kke redusert, sntret ved 145ºC. Lyse områder BCY, mørke NO. Små korn på store korn av BCY har et relatvt stort barumunderskudd. Bldet er tatt med SSD detektor. Blde 5.6 Cermetelektrode av BCY og N, kke redusert, sntret ved 15ºC. Det kan se ut som om cermetmateralene har reagert. Bldet er tatt med SSD detektor 5.2 I-V karakterserng Hydrogen/oksygen-brenselcelle I-V (strømtetthet-spennng) karakterserngskurver for en hydrogen/oksygen brenselcelle med BaCe,9 Y,1 O 2,95 (BCY) og SrCe,95 Yb,5 O 2,95 (SCYb) som elektrolytt og platna som elektrodematerale ved varerende gass-sammensetnng og forskjellge temperaturer er vst graf 5.1 tl BCY 12 SCYb Spennng / mv o C, 2% O 2 1 % H 2 2 % H 2 4 % H 2 6 % H 2 Spennng / mv C, 2 % O 2 1 % H 2 2 % H 2 4 % H 2 6 % H Strømtetthet / ma cm Strømtetthet / ma cm -2 Graf 5.1 I-V karakterserngskurve for BCY og SCYb med Pt-elektroder ved 7ºC, 2 % oksygen og varerende mengde hydrogen, 1, 2, 4 og 6 %. Vanndampnnholdet er 2,1 % alle gassblandngene. 83
C(s) + 2 H 2 (g) CH 4 (g) f H m = -74,85 kj/mol ( angir standardtilstand, m angir molar størrelse)
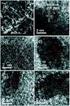 Fyskk / ermodynamkk Våren 2001 5. ermokjem 5.1. ermokjem I termokjemen ser v på de energendrnger som fnner sted kjemske reaksjoner. Hver reaktant og hvert produkt som nngår en kjemsk reaksjon kan beskrves
Fyskk / ermodynamkk Våren 2001 5. ermokjem 5.1. ermokjem I termokjemen ser v på de energendrnger som fnner sted kjemske reaksjoner. Hver reaktant og hvert produkt som nngår en kjemsk reaksjon kan beskrves
Defektkjemi og transport i Ybsubstituert
 Defektkjem og transport Ybsubsttuert BaTb 3 Kate Alce Furøy Hovedoppgave for cand.scent.-graden ved Kjemsk nsttutt, Det matematsk-naturtenskapelge fakultet UNIVERSITETET I SL 14. november 2005 3 Forord
Defektkjem og transport Ybsubsttuert BaTb 3 Kate Alce Furøy Hovedoppgave for cand.scent.-graden ved Kjemsk nsttutt, Det matematsk-naturtenskapelge fakultet UNIVERSITETET I SL 14. november 2005 3 Forord
i kjemiske forbindelser 5. Hydrogen har oksidasjonstall Oksygen har oksidsjonstall -2
 Repetsjon 4 (16.09.06) Regler for oksdasjonstall 1. Oksdasjonstall for alle fre element er 0 (O, N, C 60 ). Oksdasjonstall for enkle monoatomske on er lk ladnngen tl onet (Na + : +1, Cl - : -1, Mg + :
Repetsjon 4 (16.09.06) Regler for oksdasjonstall 1. Oksdasjonstall for alle fre element er 0 (O, N, C 60 ). Oksdasjonstall for enkle monoatomske on er lk ladnngen tl onet (Na + : +1, Cl - : -1, Mg + :
Forelesning nr.3 INF 1411 Elektroniske systemer. Parallelle og parallell-serielle kretser Kirchhoffs strømlov
 Forelesnng nr.3 INF 4 Elektronske systemer Parallelle og parallell-serelle kretser Krchhoffs strømlov Dagens temaer Parallelle kretser Kretser med parallelle og serelle ster Effekt parallelle kretser Krchhoffs
Forelesnng nr.3 INF 4 Elektronske systemer Parallelle og parallell-serelle kretser Krchhoffs strømlov Dagens temaer Parallelle kretser Kretser med parallelle og serelle ster Effekt parallelle kretser Krchhoffs
(iii) Når 5 er blitt trukket ut, er det tre igjen som kan blir trukket ut til den siste plassen, altså:
 A-besvarelse ECON2130- Statstkk 1 vår 2009 Oppgave 1 A) () Antall kke-ordnede utvalg: () P(Arne nummer 1) = () Når 5 er bltt trukket ut, er det tre gjen som kan blr trukket ut tl den sste plassen, altså:
A-besvarelse ECON2130- Statstkk 1 vår 2009 Oppgave 1 A) () Antall kke-ordnede utvalg: () P(Arne nummer 1) = () Når 5 er bltt trukket ut, er det tre gjen som kan blr trukket ut tl den sste plassen, altså:
Forelesning nr.3 INF 1411 Elektroniske systemer
 Forelesnng nr.3 INF 4 Elektronske systemer 009 04 Parallelle og parallell-serelle kretser Krchhoffs strømlov 30.0.04 INF 4 Dagens temaer Parallelle kretser Kretser med parallelle og serelle ster Effekt
Forelesnng nr.3 INF 4 Elektronske systemer 009 04 Parallelle og parallell-serelle kretser Krchhoffs strømlov 30.0.04 INF 4 Dagens temaer Parallelle kretser Kretser med parallelle og serelle ster Effekt
Appendiks 1: Organisering av Riksdagsdata i SPSS. Sannerstedt- og Sjölins data er klargjort for logitanalyse i SPSS filen på følgende måte:
 Appendks 1: Organserng av Rksdagsdata SPSS Sannerstedt- og Sjölns data er klargjort for logtanalyse SPSS flen på følgende måte: Enhet År SKJEBNE BASIS ANTALL FARGE 1 1972 1 0 47 1 0 2 1972 1 0 47 1 0 67
Appendks 1: Organserng av Rksdagsdata SPSS Sannerstedt- og Sjölns data er klargjort for logtanalyse SPSS flen på følgende måte: Enhet År SKJEBNE BASIS ANTALL FARGE 1 1972 1 0 47 1 0 2 1972 1 0 47 1 0 67
Løsningsforslag ST2301 Øving 8
 Løsnngsforslag ST301 Øvng 8 Kapttel 4 Exercse 1 For tre alleler, fnn et sett med genfrekvenser for to populasjoner, som gr flere heterozygoter enn forventa utfra Hardy-Wenberg-andeler for mnst én av de
Løsnngsforslag ST301 Øvng 8 Kapttel 4 Exercse 1 For tre alleler, fnn et sett med genfrekvenser for to populasjoner, som gr flere heterozygoter enn forventa utfra Hardy-Wenberg-andeler for mnst én av de
TMA4240/4245 Statistikk Eksamen august 2016
 Norges teknsk-naturvtenskapelge unverstet Insttutt for matematske fag TMA44/445 Statstkk Eksamen august 6 Løsnngssksse Oppgave a) Ved kast av to ternnger er det 36 mulge utfall: (, ),..., (6, 6). La Y
Norges teknsk-naturvtenskapelge unverstet Insttutt for matematske fag TMA44/445 Statstkk Eksamen august 6 Løsnngssksse Oppgave a) Ved kast av to ternnger er det 36 mulge utfall: (, ),..., (6, 6). La Y
Magnetisk nivåregulering. Prosjektoppgave i faget TTK 4150 Ulineære systemer. Gruppe 4: Rune Haugom Pål-Jørgen Kyllesø Jon Kåre Solås Frode Efteland
 Magnetsk nvåregulerng Prosjektoppgave faget TTK 45 Ulneære systemer Gruppe 4: Rune Haugom Pål-Jørgen Kyllesø Jon Kåre Solås Frode Efteland Innholdsfortegnelse Innholdsfortegnelse... Innlednng... Oppgave
Magnetsk nvåregulerng Prosjektoppgave faget TTK 45 Ulneære systemer Gruppe 4: Rune Haugom Pål-Jørgen Kyllesø Jon Kåre Solås Frode Efteland Innholdsfortegnelse Innholdsfortegnelse... Innlednng... Oppgave
Sparing gir mulighet for å forskyve forbruk over tid; spesielt kan ujevne inntekter transformeres til jevnere forbruk.
 ECON 0 Forbruker, bedrft og marked Forelesnngsnotater 09.0.07 Nls-Henrk von der Fehr FORBRUK OG SPARING Innlednng I denne delen skal v anvende det generelle modellapparatet for konsumentens tlpasnng tl
ECON 0 Forbruker, bedrft og marked Forelesnngsnotater 09.0.07 Nls-Henrk von der Fehr FORBRUK OG SPARING Innlednng I denne delen skal v anvende det generelle modellapparatet for konsumentens tlpasnng tl
Automatisk koplingspåsats Komfort Bruksanvisning
 Bruksanvsnng System 2000 Art. Nr.: 0661 xx /0671 xx Innholdsfortegnelse 1. rmasjon om farer 2. Funksjon 2.1. Funksjonsprnspp 2.2. Regstrerngsområde versjon med 1,10 m lnse 2.3. Regstrerngsområde versjon
Bruksanvsnng System 2000 Art. Nr.: 0661 xx /0671 xx Innholdsfortegnelse 1. rmasjon om farer 2. Funksjon 2.1. Funksjonsprnspp 2.2. Regstrerngsområde versjon med 1,10 m lnse 2.3. Regstrerngsområde versjon
Eksamen i emne SIB8005 TRAFIKKREGULERING GRUNNKURS
 Sde 1 av 5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET Fakultet for bygg- og mljøteknkk INSTITUTT FOR SAMFERDSELSTEKNIKK Faglg kontakt under eksamen: Navn Arvd Aakre Telefon 73 59 46 64 (drekte) / 73
Sde 1 av 5 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET Fakultet for bygg- og mljøteknkk INSTITUTT FOR SAMFERDSELSTEKNIKK Faglg kontakt under eksamen: Navn Arvd Aakre Telefon 73 59 46 64 (drekte) / 73
4 Energibalanse. TKT4124 Mekanikk 3, høst Energibalanse
 4 Energbalanse Innhold: Potensell energ Konservatve krefter Konserverng av energ Vrtuelt arbed for deformerbare legemer Vrtuelle forskvnngers prnspp Vrtuelle krefters prnspp Ltteratur: Irgens, Fasthetslære,
4 Energbalanse Innhold: Potensell energ Konservatve krefter Konserverng av energ Vrtuelt arbed for deformerbare legemer Vrtuelle forskvnngers prnspp Vrtuelle krefters prnspp Ltteratur: Irgens, Fasthetslære,
MA1301 Tallteori Høsten 2014
 MA1301 Tallteor Høsten 014 Rchard Wllamson 3. desember 014 Innhold Forord 1 Induksjon og rekursjon 7 1.1 Naturlge tall og heltall............................ 7 1. Bevs.......................................
MA1301 Tallteor Høsten 014 Rchard Wllamson 3. desember 014 Innhold Forord 1 Induksjon og rekursjon 7 1.1 Naturlge tall og heltall............................ 7 1. Bevs.......................................
Tema for forelesningen var Carnot-sykel (Carnot-maskin) og entropibegrepet.
 FORELESNING I ERMOYNMIKK ONSG 29.03.00 ema for forelesnngen var arnot-sykel (arnot-maskn) og entropbegrepet. En arnot-maskn produserer arbed ved at varme overføres fra et sted med en øy temperatur ( )
FORELESNING I ERMOYNMIKK ONSG 29.03.00 ema for forelesnngen var arnot-sykel (arnot-maskn) og entropbegrepet. En arnot-maskn produserer arbed ved at varme overføres fra et sted med en øy temperatur ( )
Dynamisk programmering. Hvilke problemer? Overlappende delproblemer. Optimalitetsprinsippet
 Dynamsk programmerng Hvlke problemer? Metoden ble formalsert av Rchard Bellmann (RAND Corporaton) på -tallet. Har ngen tng med programmerng å gøre. Dynamsk er et ord som kan aldr brukes negatvt. Skal v
Dynamsk programmerng Hvlke problemer? Metoden ble formalsert av Rchard Bellmann (RAND Corporaton) på -tallet. Har ngen tng med programmerng å gøre. Dynamsk er et ord som kan aldr brukes negatvt. Skal v
EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Torsdag 11. august, Tillatte hjelpemidler : K.Rottman, Matematisk formelsamling
 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Professor Asle Sudbø, tlf 93403 EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Torsdag 11. august, 2005 09.00-13.00
NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Professor Asle Sudbø, tlf 93403 EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Torsdag 11. august, 2005 09.00-13.00
Illustrasjon av regel 5.19 om sentralgrenseteoremet og litt om heltallskorreksjon (som i eksempel 5.18).
 Econ 2130 HG mars 2012 Supplement tl forelesnngen 19. mars Illustrasjon av regel 5.19 om sentralgrenseteoremet og ltt om heltallskorreksjon (som eksempel 5.18). Regel 5.19 ser at summer, Y = X1+ X2 + +
Econ 2130 HG mars 2012 Supplement tl forelesnngen 19. mars Illustrasjon av regel 5.19 om sentralgrenseteoremet og ltt om heltallskorreksjon (som eksempel 5.18). Regel 5.19 ser at summer, Y = X1+ X2 + +
Alternerende rekker og absolutt konvergens
 Alternerende rekker og absolutt konvergens Forelest: 0. Sept, 2004 Sst forelesnng så v på rekker der alle termene var postve. Mange av de kraftgste metodene er utvklet for akkurat den typen rekker. I denne
Alternerende rekker og absolutt konvergens Forelest: 0. Sept, 2004 Sst forelesnng så v på rekker der alle termene var postve. Mange av de kraftgste metodene er utvklet for akkurat den typen rekker. I denne
Studieprogramundersøkelsen 2013
 1 Studeprogramundersøkelsen 2013 Alle studer skal henhold tl høgskolens kvaltetssystem være gjenstand for studentevaluerng mnst hvert tredje år. Alle studentene på studene under er oppfordret tl å delta
1 Studeprogramundersøkelsen 2013 Alle studer skal henhold tl høgskolens kvaltetssystem være gjenstand for studentevaluerng mnst hvert tredje år. Alle studentene på studene under er oppfordret tl å delta
Tillegg 7 7. Innledning til FY2045/TFY4250
 FY1006/TFY4215 Tllegg 7 1 Dette notatet repeterer noen punkter fra Tllegg 2, og dekker detalj målng av degenererte egenverder samt mpulsrepresentasjonen av kvantemekankk. Tllegg 7 7. Innlednng tl FY2045/TFY4250
FY1006/TFY4215 Tllegg 7 1 Dette notatet repeterer noen punkter fra Tllegg 2, og dekker detalj målng av degenererte egenverder samt mpulsrepresentasjonen av kvantemekankk. Tllegg 7 7. Innlednng tl FY2045/TFY4250
Arbeid og potensiell energi
 Arbed og potensell energ 4.3.5 Mdtveseksamen: 6.3. Pensum: Kap. boken flere lærer på data-lab YS-MEK 4.3.5 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d d energbevarng vertkal kast: mg
Arbed og potensell energ 4.3.5 Mdtveseksamen: 6.3. Pensum: Kap. boken flere lærer på data-lab YS-MEK 4.3.5 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d d energbevarng vertkal kast: mg
Anvendelser. Kapittel 12. Minste kvadraters metode
 Kapttel Anvendelser I dette kaptlet skal v se på forskjellge anvendelser av teknkke v har utvklet løpet av de sste ukene Avsnttene og eksemplene v skal se på er derfor forholdsvs uavhengge Mnste kvadraters
Kapttel Anvendelser I dette kaptlet skal v se på forskjellge anvendelser av teknkke v har utvklet løpet av de sste ukene Avsnttene og eksemplene v skal se på er derfor forholdsvs uavhengge Mnste kvadraters
Simpleksmetoden. Initiell basistabell Fase I for å skaffe initiell, brukbar løsning. Fase II: Iterativ prosess for å finne optimal løsning Pivotering
 Lekson 3 Smpleksmetoden generell metode for å løse LP utgangspunkt: LP på standardform Intell basstabell Fase I for å skaffe ntell, brukbar løsnng løse helpeproblem hvs optmale løsnng gr brukbar løsnng
Lekson 3 Smpleksmetoden generell metode for å løse LP utgangspunkt: LP på standardform Intell basstabell Fase I for å skaffe ntell, brukbar løsnng løse helpeproblem hvs optmale løsnng gr brukbar løsnng
KONTINUASJONSEKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Fredag 13. august, Tillatte hjelpemidler : K.Rottman, Matematisk formelsamling
 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Martn Grønsleth, tlf 93772 KONTINUASJONSEKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Fredag 13. august, 2004
NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Martn Grønsleth, tlf 93772 KONTINUASJONSEKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Fredag 13. august, 2004
EKSAMEN I FAG SIF5040 NUMERISKE METODER Tirsdag 15. mai 2001 Tid: 09:00 14:00
 Norges teknsk naturvtenskapelge unverstet Insttutt for matematske fag Sde 1 av 9 Faglg kontakt under eksamen: Enar Rønqust, tlf. 73 59 35 47 EKSAMEN I FAG SIF5040 NUMERISKE METODER Trsdag 15. ma 2001 Td:
Norges teknsk naturvtenskapelge unverstet Insttutt for matematske fag Sde 1 av 9 Faglg kontakt under eksamen: Enar Rønqust, tlf. 73 59 35 47 EKSAMEN I FAG SIF5040 NUMERISKE METODER Trsdag 15. ma 2001 Td:
EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Mandag 23. mai, Tillatte hjelpemidler : K.Rottman, Matematisk formelsamling
 NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Martn Grønsleth, tlf 93772 EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Mandag 23. ma, 2005 09.00-13.00 Tllatte
NORGES TEKNISK-NATURVITENSKAPELIGE UNIVERSITET INSTITUTT FOR FYSIKK Faglg kontakt under eksamen: Martn Grønsleth, tlf 93772 EKSAMEN I TFY4210 ANVENDT KVANTEMEKANIKK Mandag 23. ma, 2005 09.00-13.00 Tllatte
SIF4012 og MNFFY103 høst 2002: Sammendrag uke 44 (Alonso&Finn )
 SIF402 og MNFFY03 høst 2002: Sammendrag uke 44 (Alonso&Fnn 26.4-26.6) Magnetsme To effekter når et materale påvrkes av et ytre magnetfelt B:. nnrettng av permanente atomære (evt. molekylære) magnetske
SIF402 og MNFFY03 høst 2002: Sammendrag uke 44 (Alonso&Fnn 26.4-26.6) Magnetsme To effekter når et materale påvrkes av et ytre magnetfelt B:. nnrettng av permanente atomære (evt. molekylære) magnetske
ØVINGER 2017 Løsninger til oppgaver
 ØVINGER 017 Løsnnger tl oppgaver Øvng 1 7.1. Med utgangspunkt de n 5 observasjonsparene (x 1, y 1 ), (x, y ),..., (x 5, y 5 ) beregner v først mddelverdene x 1 5 Estmert kovarans blr x 3. ȳ 1 5 s XY 1
ØVINGER 017 Løsnnger tl oppgaver Øvng 1 7.1. Med utgangspunkt de n 5 observasjonsparene (x 1, y 1 ), (x, y ),..., (x 5, y 5 ) beregner v først mddelverdene x 1 5 Estmert kovarans blr x 3. ȳ 1 5 s XY 1
Generell likevekt med skjermet og konkurranseutsatt sektor 1
 1 Jon Vsle; februar 2018 ECON 3735 vår 2018 Forelesnngsnotat #1 Generell lkevekt med skjermet og konkurranseutsatt sektor 1 V betrakter en økonom med to sektorer; en skjermet sektor («-sektor») som produserer
1 Jon Vsle; februar 2018 ECON 3735 vår 2018 Forelesnngsnotat #1 Generell lkevekt med skjermet og konkurranseutsatt sektor 1 V betrakter en økonom med to sektorer; en skjermet sektor («-sektor») som produserer
Eksamen ECON 2200, Sensorveiledning Våren Deriver følgende funksjoner. Deriver med hensyn på begge argumenter i e) og f).
 Eksamen ECON 00, Sensorvelednng Våren 0 Oppgave (8 poeng ) Derver følgende funksjoner. Derver med hensyn på begge argumenter e) og f). (Ett poeng per dervasjon, dvs, poeng e og f) a) f( x) = 3x x + ln
Eksamen ECON 00, Sensorvelednng Våren 0 Oppgave (8 poeng ) Derver følgende funksjoner. Derver med hensyn på begge argumenter e) og f). (Ett poeng per dervasjon, dvs, poeng e og f) a) f( x) = 3x x + ln
TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller likt uansett variasjon i vanskelighetsgrad. Svarene er gitt i << >>.
 ECON13: EKSAMEN 14V TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt >. Oppgave 1 Innlednng. Rulett splles på en rekke kasnoer
ECON13: EKSAMEN 14V TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt >. Oppgave 1 Innlednng. Rulett splles på en rekke kasnoer
Dynamisk programmering. Hvilke problemer? Overlappende delproblemer. Optimalitetsprinsippet
 Dynamsk programmerng Metoden ble formalsert av Rchard Bellmann (RAND Corporaton på -tallet. Programmerng betydnngen planlegge, ta beslutnnger. (Har kke noe med kode eller å skrve kode å gøre. Dynamsk for
Dynamsk programmerng Metoden ble formalsert av Rchard Bellmann (RAND Corporaton på -tallet. Programmerng betydnngen planlegge, ta beslutnnger. (Har kke noe med kode eller å skrve kode å gøre. Dynamsk for
Arbeid og potensiell energi
 Arbed og potensell energ.3.7 YS- MEK.3.7 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d energbevarng vertkal kast: mg d mg fjær: k k d atom krstall: b π cos π b b d π sn b YS- MEK.3.7 kraft
Arbed og potensell energ.3.7 YS- MEK.3.7 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d energbevarng vertkal kast: mg d mg fjær: k k d atom krstall: b π cos π b b d π sn b YS- MEK.3.7 kraft
At energi ikke kan gå tapt, må bety at den er bevart. Derav betegnelsen bevaringslov.
 Sde av 7 LØSNINGSFORSLAG TIL EKSAMEN 007 SMN69 VARMELÆRE DATO: 7. OKTOBER 007 TID: KL. 09.00 -.00 OPPGAVE (0%) a) Termodynamkkens. hovedsats. hovedsetnng: Energ kan verken oppstå eller forsvnne, bare omdannes
Sde av 7 LØSNINGSFORSLAG TIL EKSAMEN 007 SMN69 VARMELÆRE DATO: 7. OKTOBER 007 TID: KL. 09.00 -.00 OPPGAVE (0%) a) Termodynamkkens. hovedsats. hovedsetnng: Energ kan verken oppstå eller forsvnne, bare omdannes
TMA4265 Stokastiske prosesser
 orges teknsk-naturvtenskapelge unverstet Insttutt for matematske fag TMA4265 Stokastske prosesser Våren 2004 Løsnngsforslag - Øvng 6 Oppgaver fra læreboka 4.56 X n Antallet hvte baller urna Trekk tlf.
orges teknsk-naturvtenskapelge unverstet Insttutt for matematske fag TMA4265 Stokastske prosesser Våren 2004 Løsnngsforslag - Øvng 6 Oppgaver fra læreboka 4.56 X n Antallet hvte baller urna Trekk tlf.
1653B/1654B. Installasjonstest på et IT anlegg i drift
 65B/654B Installasjonstest på et IT anlegg drft Utførng av testene Spennngsmålnger Testeren kan brkes som et ac voltmeter hvor spennng og frekvens kan vses samtdg ved å sette rotasjonsbryteren tl V. Alle
65B/654B Installasjonstest på et IT anlegg drft Utførng av testene Spennngsmålnger Testeren kan brkes som et ac voltmeter hvor spennng og frekvens kan vses samtdg ved å sette rotasjonsbryteren tl V. Alle
Arbeid og potensiell energi
 Arbed og potensell energ 5.3.4 YS-MEK 5.3.4 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d d energbevarng vertkal kast: mg d d mg fjær: k d k d atom krstall: b cos b b d d sn b YS-MEK 5.3.4
Arbed og potensell energ 5.3.4 YS-MEK 5.3.4 Konservatve krefter: v kan fnne en potensalfunksjon slk at: d d energbevarng vertkal kast: mg d d mg fjær: k d k d atom krstall: b cos b b d d sn b YS-MEK 5.3.4
X ijk = µ+α i +β j +γ ij +ǫ ijk ; k = 1,2; j = 1,2,3; i = 1,2,3; i=1 γ ij = 3. i=1 α i = 3. j=1 β j = 3. j=1 γ ij = 0.
 UNIVERSITETET I OSLO Det matematsk-naturvtenskapelge fakultet Eksamen : Eksamensdag: 7. jun 2013. Td for eksamen: 14.30 18.30. Oppgavesettet er på 8 sder. Vedlegg: Tllatte hjelpemdler: STK2120 LØSNINGSFORSLAG
UNIVERSITETET I OSLO Det matematsk-naturvtenskapelge fakultet Eksamen : Eksamensdag: 7. jun 2013. Td for eksamen: 14.30 18.30. Oppgavesettet er på 8 sder. Vedlegg: Tllatte hjelpemdler: STK2120 LØSNINGSFORSLAG
TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller likt uansett variasjon i vanskelighetsgrad. Svarene er gitt i <<< >>>.
 ECON30: EKSAMEN 05 VÅR - UTSATT PRØVE TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt
ECON30: EKSAMEN 05 VÅR - UTSATT PRØVE TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt
Løsningskisse for oppgaver til uke 15 ( april)
 HG Aprl 01 Løsnngsksse for oppgaver tl uke 15 (10.-13. aprl) Innledende merknad. Flere oppgaver denne uka er øvelser bruk av den vktge regel 5.0, som er sentral dette kurset, og som det forventes at studentene
HG Aprl 01 Løsnngsksse for oppgaver tl uke 15 (10.-13. aprl) Innledende merknad. Flere oppgaver denne uka er øvelser bruk av den vktge regel 5.0, som er sentral dette kurset, og som det forventes at studentene
Seleksjon og uttak av alderspensjon fra Folketrygden
 ato: 07.01.2008 aksbehandler: DH Seleksjon og uttak av alderspensjon fra Folketrygden Dette notatet presenterer en enkel framstllng av problemet med seleksjon mot uttakstdpunkt av alderspensjon av folketrygden.
ato: 07.01.2008 aksbehandler: DH Seleksjon og uttak av alderspensjon fra Folketrygden Dette notatet presenterer en enkel framstllng av problemet med seleksjon mot uttakstdpunkt av alderspensjon av folketrygden.
IT1105 Algoritmer og datastrukturer
 Løsnngsforslag, Eksamen IT1105 Algortmer og datastrukturer 1 jun 2004 0900-1300 Tllatte hjelpemdler: Godkjent kalkulator og matematsk formelsamlng Skrv svarene på oppgavearket Skrv studentnummer på alle
Løsnngsforslag, Eksamen IT1105 Algortmer og datastrukturer 1 jun 2004 0900-1300 Tllatte hjelpemdler: Godkjent kalkulator og matematsk formelsamlng Skrv svarene på oppgavearket Skrv studentnummer på alle
Side 1 av 3/nyn. Kontakt under eksamen: Ivar S. Ertesvåg, tel. (735) EKSAMEN I FAG TEP4125 TERMODYNAMIKK august 2016 Tid:
 Sde 1 av 3/nyn. NOREGS TEKNISK-NATURVITSKAPLEGE UNIVERSITET INSTITUTT FOR ENERGI- OG PROSESSTEKNIKK Kontakt under eksamen: Ivar S. Ertesvåg, tel. (735)93839 EKSAMEN I FAG TEP4125 TERMODYNAMIKK 2 19. august
Sde 1 av 3/nyn. NOREGS TEKNISK-NATURVITSKAPLEGE UNIVERSITET INSTITUTT FOR ENERGI- OG PROSESSTEKNIKK Kontakt under eksamen: Ivar S. Ertesvåg, tel. (735)93839 EKSAMEN I FAG TEP4125 TERMODYNAMIKK 2 19. august
Spinntur 2017 Rotasjonsbevegelse
 Spnntur 2017 Rotasjonsbevegelse August Geelmuyden Unverstetet Oslo Teor I. Defnsjon og bevarng Newtons andre lov konstaterer at summen av kreftene F = F som vrker på et legeme med masse m er lk legemets
Spnntur 2017 Rotasjonsbevegelse August Geelmuyden Unverstetet Oslo Teor I. Defnsjon og bevarng Newtons andre lov konstaterer at summen av kreftene F = F som vrker på et legeme med masse m er lk legemets
Sluttrapport. utprøvingen av
 Fagenhet vderegående opplærng Sluttrapport utprøvngen av Gjennomgående dokumenterng fag- og yrkesopplærngen Februar 2012 Det å ha lett tlgjengelg dokumentasjon er en verd seg selv. Dokumentasjon gr ungedommene
Fagenhet vderegående opplærng Sluttrapport utprøvngen av Gjennomgående dokumenterng fag- og yrkesopplærngen Februar 2012 Det å ha lett tlgjengelg dokumentasjon er en verd seg selv. Dokumentasjon gr ungedommene
Notater. Bjørn Gabrielsen, Magnar Lillegård, Berit Otnes, Brith Sundby, Dag Abrahamsen, Pål Strand (Hdir)
 2009/48 Notater Bjørn Gabrelsen, Magnar Lllegård, Bert Otnes, Brth Sundby, Dag Abrahamsen, Pål Strand (Hdr) Notater Indvdbasert statstkk for pleeog omsorgstjenesten kommunene (IPLOS) Foreløpge resultater
2009/48 Notater Bjørn Gabrelsen, Magnar Lllegård, Bert Otnes, Brth Sundby, Dag Abrahamsen, Pål Strand (Hdr) Notater Indvdbasert statstkk for pleeog omsorgstjenesten kommunene (IPLOS) Foreløpge resultater
Norske CO 2 -avgifter - differensiert eller uniform skatt?
 Norske CO 2 -avgfter - dfferensert eller unform skatt? av Sven Egl Ueland Masteroppgave Masteroppgaven er levert for å fullføre graden Master samfunnsøkonom Unverstetet Bergen, Insttutt for økonom Oktober
Norske CO 2 -avgfter - dfferensert eller unform skatt? av Sven Egl Ueland Masteroppgave Masteroppgaven er levert for å fullføre graden Master samfunnsøkonom Unverstetet Bergen, Insttutt for økonom Oktober
Randi Eggen, SVV Torunn Moltumyr, SVV Terje Giæver. Notat_fartspåvirkn_landeveg_SINTEFrapp.doc PROSJEKTNR. DATO SAKSBEARBEIDER/FORFATTER ANTALL SIDER
 NOTAT GJELDER SINTEF Teknolog og samfunn Transportskkerhet og -nformatkk Postadresse: 7465 Trondhem Besøksadresse: Klæbuveen 153 Telefon: 73 59 46 60 Telefaks: 73 59 46 56 Foretaksregsteret: NO 948 007
NOTAT GJELDER SINTEF Teknolog og samfunn Transportskkerhet og -nformatkk Postadresse: 7465 Trondhem Besøksadresse: Klæbuveen 153 Telefon: 73 59 46 60 Telefaks: 73 59 46 56 Foretaksregsteret: NO 948 007
Samfunnsøkonomi andre avdeling, mikroøkonomi, Diderik Lund, 18. mars 2002
 Samfunnsøkonom andre avdelng, mkroøkonom, Dderk Lund, 8. mars 00 Markeder under uskkerhet Uskkerhet vktg mange (de fleste? markeder Uskkerhet omkrng framtdge prser og leverngsskkerhet (f.eks. om leverandør
Samfunnsøkonom andre avdelng, mkroøkonom, Dderk Lund, 8. mars 00 Markeder under uskkerhet Uskkerhet vktg mange (de fleste? markeder Uskkerhet omkrng framtdge prser og leverngsskkerhet (f.eks. om leverandør
må det justeres for i avkastningsberegningene. se nærmere nedenfor om valg av beregningsmetoder.
 40 Metoder for å måle avkastnng Totalavkastnngen tl Statens petroleumsfond blr målt med stor nøyaktghet. En vktg forutsetnng er at det alltd beregnes kvaltetsskret markedsverd av fondet når det kommer
40 Metoder for å måle avkastnng Totalavkastnngen tl Statens petroleumsfond blr målt med stor nøyaktghet. En vktg forutsetnng er at det alltd beregnes kvaltetsskret markedsverd av fondet når det kommer
Balanserte søketrær. AVL-trær. AVL-trær. AVL-trær høyde AVL AVL. AVL-trær (Adelson-Velskii og Landis, 1962) Splay-trær (Sleator og Tarjan, 1985)
 alanserte søketrær VL-trær Et bnært tre er et VL-tre hvs ølgende holder: VL-trær delson-velsk og Lands, 96 play-trær leator og Tarjan, 98. orskjellen høyde mellom det høyre og det venstre deltreet er maksmalt,
alanserte søketrær VL-trær Et bnært tre er et VL-tre hvs ølgende holder: VL-trær delson-velsk og Lands, 96 play-trær leator og Tarjan, 98. orskjellen høyde mellom det høyre og det venstre deltreet er maksmalt,
KVIKKSØLVEKSPONERING VED DENTALLABORATORIER. Nils Gundersen og Arve Lie HD 807/790814
 KVIKKSØLVEKSPONERING VED DENTALLABORATORIER Nls Gundersen og Arve Le HD 807/790814 KVIKKSØLVEKSPONERING VED DENTALLABORATORIER Nls Gundersen og Arve Le HD 807/790814 l SAMMENDRAG: Rapporten omhandler bruk
KVIKKSØLVEKSPONERING VED DENTALLABORATORIER Nls Gundersen og Arve Le HD 807/790814 KVIKKSØLVEKSPONERING VED DENTALLABORATORIER Nls Gundersen og Arve Le HD 807/790814 l SAMMENDRAG: Rapporten omhandler bruk
Forelesning nr.3 INF 1410
 Forelesnng nr. INF 40 009 Node og mesh-analyse 6.0.009 INF 40 Oerskt dagens temaer Bakgrunn Nodeanalyse og motasjon Meshanalyse 009 Supernode Bruksområder og supermesh for node- og meshanalyse 6.0.009
Forelesnng nr. INF 40 009 Node og mesh-analyse 6.0.009 INF 40 Oerskt dagens temaer Bakgrunn Nodeanalyse og motasjon Meshanalyse 009 Supernode Bruksområder og supermesh for node- og meshanalyse 6.0.009
Lise Dalen, Pål Marius Bergh, Jenny-Anne Sigstad Lie og Anne Vedø. Energibruk î. næringsbygg 1995-1997 98/47. 11 Notater
 98/47 Notater 998 Lse Dalen, Pål Marus Bergh, Jenny-Anne Sgstad Le og Anne Vedø Energbruk î. nærngsbygg 995-997 Avdelng for økonomsk statstkk/seksjon for utenrkshandel, energ og ndustrstatstkk Innhold.
98/47 Notater 998 Lse Dalen, Pål Marus Bergh, Jenny-Anne Sgstad Le og Anne Vedø Energbruk î. nærngsbygg 995-997 Avdelng for økonomsk statstkk/seksjon for utenrkshandel, energ og ndustrstatstkk Innhold.
TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller likt uansett variasjon i vanskelighetsgrad. Svarene er gitt i <<< >>>.
 ECON: EKSAMEN 6 VÅR - UTSATT PRØVE TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt
ECON: EKSAMEN 6 VÅR - UTSATT PRØVE TALLSVAR. Det anbefales at de 9 deloppgavene merket med A, B, teller lkt uansett varasjon vanskelghetsgrad. Svarene er gtt
Veiledning til obligatorisk oppgave i ECON 3610/4610 høsten N. Vi skal bestemme den fordeling av denne gitte arbeidsstyrken som
 Jon sle; oktober 07 Ogave a. elednng tl oblgatorsk ogave ECO 60/60 høsten 07 har nå at samlet arbedskraftmengde er gtt lk, slk at ressurskravet er. skal bestemme den fordelng av denne gtte arbedsstyrken
Jon sle; oktober 07 Ogave a. elednng tl oblgatorsk ogave ECO 60/60 høsten 07 har nå at samlet arbedskraftmengde er gtt lk, slk at ressurskravet er. skal bestemme den fordelng av denne gtte arbedsstyrken
EKSAMEN Ny og utsatt Løsningsforslag
 . jun 0 EKSAMEN Ny og utsatt Løsnngsorslag Emnekode: ITD50 Dato:. jun 0 Emne: Matematkk, deleksamen Eksamenstd: 09.00.00 Hjelpemdler: To A-ark med valgrtt nnhold på begge sder. Formelhete. Kalkulator er
. jun 0 EKSAMEN Ny og utsatt Løsnngsorslag Emnekode: ITD50 Dato:. jun 0 Emne: Matematkk, deleksamen Eksamenstd: 09.00.00 Hjelpemdler: To A-ark med valgrtt nnhold på begge sder. Formelhete. Kalkulator er
Hva er afasi? Afasi. Hva nå? Andre følger av hjerneskade. Noen typer afasi
 Hva er afas? Afas er en språkforstyrrelse som følge av skade hjernen. Afas kommer som oftest som et resultat av hjerneslag. Hvert år rammes en betydelg andel av Norges befolknng av hjerneslag. Mange av
Hva er afas? Afas er en språkforstyrrelse som følge av skade hjernen. Afas kommer som oftest som et resultat av hjerneslag. Hvert år rammes en betydelg andel av Norges befolknng av hjerneslag. Mange av
Studie av overføring av kjemisk energi til elektrisk energi og omvendt. Vi snakker om redoks reaksjoner
 Kapittel 19 Elektrokjemi Repetisjon 1 (14.10.02) 1. Kort repetisjon redoks Reduksjon: Når et stoff tar opp elektron Oksidasjon: Når et stoff avgir elektron 2. Elektrokjemiske celler Studie av overføring
Kapittel 19 Elektrokjemi Repetisjon 1 (14.10.02) 1. Kort repetisjon redoks Reduksjon: Når et stoff tar opp elektron Oksidasjon: Når et stoff avgir elektron 2. Elektrokjemiske celler Studie av overføring
Rapport 2008-031. Benchmarkingmodeller. incentiver
 Rapport 28-3 Benchmarkngmodeller og ncentver CO-rapport nr. 28-3, Prosjekt nr. 552 ISS: 83-53, ISB 82-7645-xxx-x LM/ÅJ, 29. februar 28 Offentlg Benchmarkngmodeller og ncentver Utarbedet for orges vassdrags-
Rapport 28-3 Benchmarkngmodeller og ncentver CO-rapport nr. 28-3, Prosjekt nr. 552 ISS: 83-53, ISB 82-7645-xxx-x LM/ÅJ, 29. februar 28 Offentlg Benchmarkngmodeller og ncentver Utarbedet for orges vassdrags-
NA Dok. 52 Angivelse av måleusikkerhet ved kalibreringer
 Sde: av 7 orsk akkredterng Dok.d.: VII..5 A Dok. 5: Angvelse av måleuskkerhet ved kalbrernger Utarbedet av: Saeed Behdad Godkjent av: ICL Versjon:.00 Mandatory/Krav Gjelder fra: 09.05.008 Sdenr: av 7 A
Sde: av 7 orsk akkredterng Dok.d.: VII..5 A Dok. 5: Angvelse av måleuskkerhet ved kalbrernger Utarbedet av: Saeed Behdad Godkjent av: ICL Versjon:.00 Mandatory/Krav Gjelder fra: 09.05.008 Sdenr: av 7 A
Er verditaksten til å stole på?
 NORGES HANDELSHØYSKOLE Bergen, våren 2006 Er verdtaksten tl å stole på? En analyse av takstmannens økonomske relasjon tl eendomsmegler av Krstan Gull Larsen Veleder: Professor Guttorm Schjelderup Utrednng
NORGES HANDELSHØYSKOLE Bergen, våren 2006 Er verdtaksten tl å stole på? En analyse av takstmannens økonomske relasjon tl eendomsmegler av Krstan Gull Larsen Veleder: Professor Guttorm Schjelderup Utrednng
Adaptivt lokalsøk for boolske optimeringsproblemer
 Adaptvt lokalsøk for boolske optmerngsproblemer Lars Magnus Hvattum Høgskolen Molde Lars.M.Hvattum@hmolde.no Arne Løkketangen Høgskolen Molde Arne.Lokketangen@hmolde.no Fred Glover Leeds School of Busness,
Adaptvt lokalsøk for boolske optmerngsproblemer Lars Magnus Hvattum Høgskolen Molde Lars.M.Hvattum@hmolde.no Arne Løkketangen Høgskolen Molde Arne.Lokketangen@hmolde.no Fred Glover Leeds School of Busness,
Auksjoner og miljø: Privat informasjon og kollektive goder. Eirik Romstad Handelshøyskolen Norges miljø- og biovitenskapelige universitet
 Auksjoner og mljø: Prvat nformasjon og kollektve goder Erk Romstad Handelshøyskolen Auksjoner for endra forvaltnng Habtatvern for bologsk mangfold Styresmaktene lyser ut spesfserte forvaltnngskontrakter
Auksjoner og mljø: Prvat nformasjon og kollektve goder Erk Romstad Handelshøyskolen Auksjoner for endra forvaltnng Habtatvern for bologsk mangfold Styresmaktene lyser ut spesfserte forvaltnngskontrakter
En teoretisk studie av tv-markedets effisiens
 NORGES HANDELSHØYSKOLE Bergen, våren 007 Utrednng fordypnng: Økonomsk analyse Veleder: Hans Jarle Knd En teoretsk stude av tv-markedets effsens av Odd Hennng Aure og Harald Nygård Bergh Denne utrednngen
NORGES HANDELSHØYSKOLE Bergen, våren 007 Utrednng fordypnng: Økonomsk analyse Veleder: Hans Jarle Knd En teoretsk stude av tv-markedets effsens av Odd Hennng Aure og Harald Nygård Bergh Denne utrednngen
EKSAMEN ny og utsatt løsningsforslag
 8.. EKSAMEN n og utsatt løsnngsorslag Emnekode: ITD Dato:. jun Hjelpemdler: - To A-ark med valgrtt nnhold på begge sder. Emnenavn: Matematkk ørste deleksamen Eksamenstd: 9.. Faglærer: Chrstan F Hede -
8.. EKSAMEN n og utsatt løsnngsorslag Emnekode: ITD Dato:. jun Hjelpemdler: - To A-ark med valgrtt nnhold på begge sder. Emnenavn: Matematkk ørste deleksamen Eksamenstd: 9.. Faglærer: Chrstan F Hede -
Oppvarming og innetemperaturer i norske barnefamilier
 Ovarmng og nnetemeraturer norske barnefamler En analyse av husholdnngenes valg av nnetemeratur Henrette Brkelund Masterogave samfunnsøkonom ved Økonomsk Insttutt UNIVERSITETET I OSLO 13.05.2013 II ) Ovarmng
Ovarmng og nnetemeraturer norske barnefamler En analyse av husholdnngenes valg av nnetemeratur Henrette Brkelund Masterogave samfunnsøkonom ved Økonomsk Insttutt UNIVERSITETET I OSLO 13.05.2013 II ) Ovarmng
Vekst i skjermet virksomhet: Er dette et problem? Trend mot større andel sysselsetting i skjermet
 Forelesnng NO kapttel 4 Skjermet og konkurranseutsatt vrksomhet Det grunnleggende formål med eksport: Mulggjøre mport Samfunnsøkonomsk balanse mellom eksport og mportkonkurrerende: Samme valutanntjenng/besparelse
Forelesnng NO kapttel 4 Skjermet og konkurranseutsatt vrksomhet Det grunnleggende formål med eksport: Mulggjøre mport Samfunnsøkonomsk balanse mellom eksport og mportkonkurrerende: Samme valutanntjenng/besparelse
COLUMBUS. Lærerveiledning Norge og fylkene. ved Rolf Mikkelsen. Cappelen Damm
 COLUMBUS Lærervelednng Norge og fylkene ved Rolf Mkkelsen Cappelen Damm Innlednng Columbus Norge er et nteraktvt emddel som nneholder kart over Norge, fylkene og Svalbard, samt øvelser og oppgaver. Det
COLUMBUS Lærervelednng Norge og fylkene ved Rolf Mkkelsen Cappelen Damm Innlednng Columbus Norge er et nteraktvt emddel som nneholder kart over Norge, fylkene og Svalbard, samt øvelser og oppgaver. Det
Fast valutakurs, selvstendig rentepolitikk og frie kapitalbevegelser er ikke forenlig på samme tid
 Makroøkonom Publserngsoppgave Uke 48 November 29. 2009, Rev - Jan Erk Skog Fast valutakurs, selvstendg rentepoltkk og fre kaptalbevegelser er kke forenlg på samme td I utsagnet Fast valutakurs, selvstendg
Makroøkonom Publserngsoppgave Uke 48 November 29. 2009, Rev - Jan Erk Skog Fast valutakurs, selvstendg rentepoltkk og fre kaptalbevegelser er kke forenlg på samme td I utsagnet Fast valutakurs, selvstendg
Oppgaver. Multiple regresjon. Forelesning 3 MET3592 Økonometri ved David Kreiberg Vår 2011
 Forelesnng 3 MET359 Økonometr ved Davd Kreberg Vår 0 Oppgaver Alle oppgaver er merket ut fra vanskelghetsgrad på følgende måte: * Enkel ** Mddels vanskelg *** Vanskelg Multple regresjon Oppgave.* Ta utgangspunkt
Forelesnng 3 MET359 Økonometr ved Davd Kreberg Vår 0 Oppgaver Alle oppgaver er merket ut fra vanskelghetsgrad på følgende måte: * Enkel ** Mddels vanskelg *** Vanskelg Multple regresjon Oppgave.* Ta utgangspunkt
Fleksibelt arbeidsliv. Befolkningsundersøkelse utført for Manpower September 2015
 Fleksbelt arbedslv Befolknngsundersøkelse utført for Manpower September 015 Antall dager med hjemmekontor Spørsmål: Omtrent hvor mange dager jobber du hjemmefra løpet av en gjennomsnttsmåned (n=63) Prosent
Fleksbelt arbedslv Befolknngsundersøkelse utført for Manpower September 015 Antall dager med hjemmekontor Spørsmål: Omtrent hvor mange dager jobber du hjemmefra løpet av en gjennomsnttsmåned (n=63) Prosent
EKSAMEN Løsningsforslag
 . desember 6 EKSAMEN Løsnngsorslag Emnekode: ITD Emnenavn: Matematkk ørste deleksamen Dato:. desember 6 Hjelpemdler: - To A-ark med valgrtt nnold på begge sder. - Formelete. - Kalkulator som deles ut samtdg
. desember 6 EKSAMEN Løsnngsorslag Emnekode: ITD Emnenavn: Matematkk ørste deleksamen Dato:. desember 6 Hjelpemdler: - To A-ark med valgrtt nnold på begge sder. - Formelete. - Kalkulator som deles ut samtdg
Kapitalbeskatning og investeringer i norsk næringsliv
 Rapport Kaptalbeskatnng og nvesternger norsk nærngslv MENON-PUBLIKASJON NR. 28/2015 August 2015 av Leo A. Grünfeld, Gjermund Grmsby og Marcus Gjems Thee Forord Denne rapporten er utarbedet av Menon Busness
Rapport Kaptalbeskatnng og nvesternger norsk nærngslv MENON-PUBLIKASJON NR. 28/2015 August 2015 av Leo A. Grünfeld, Gjermund Grmsby og Marcus Gjems Thee Forord Denne rapporten er utarbedet av Menon Busness
SNF-rapport nr. 23/05
 Sykefravær offentlg og prvat sektor av Margt Auestad SNF-prosjekt nr. 4370 Endrng arbedsforhold Norge Prosjektet er fnansert av Norges forsknngsråd SAMFUNNS- OG NÆRINGSLIVSFORSKNING AS BERGEN, OKTOBER
Sykefravær offentlg og prvat sektor av Margt Auestad SNF-prosjekt nr. 4370 Endrng arbedsforhold Norge Prosjektet er fnansert av Norges forsknngsråd SAMFUNNS- OG NÆRINGSLIVSFORSKNING AS BERGEN, OKTOBER
Statistikk og økonomi, våren 2017
 Statstkk og økonom, våren 7 Oblgatorsk oppgave Løsnngsforslag Oppgave Anta at forbruket av ntrogen norsk landbruk årene 987 99 var følgende målt tonn: 987: 9 87 988: 8 989: 8 99: 8 99: 79 99: 87 99: 9
Statstkk og økonom, våren 7 Oblgatorsk oppgave Løsnngsforslag Oppgave Anta at forbruket av ntrogen norsk landbruk årene 987 99 var følgende målt tonn: 987: 9 87 988: 8 989: 8 99: 8 99: 79 99: 87 99: 9
NÆRINGSSTRUKTUR OG INTERNASJONAL HANDEL
 NÆRINGSSTRUKTUR OG INTERNASJONAL HANDEL Norman & Orvedal, kap. 1-5 Bævre & Vsle Generell lkevekt En lten, åpen økonom Nærngsstruktur Skjermet versus konkurranseutsatt vrksomhet Handel og komparatve fortrnn
NÆRINGSSTRUKTUR OG INTERNASJONAL HANDEL Norman & Orvedal, kap. 1-5 Bævre & Vsle Generell lkevekt En lten, åpen økonom Nærngsstruktur Skjermet versus konkurranseutsatt vrksomhet Handel og komparatve fortrnn
UNIVERSITETET I OSLO ØKONOMISK INSTITUTT
 Utsatt eksamen : ECON13 Statstkk 1 UNIVERSITETET I OSLO ØKONOMISK INSTITUTT Eksamensdag: 11.8.16 Sensur kunngjøres senest: 6.8.16 Td for eksamen: kl. 9: 1: Oppgavesettet er på 4 sder Tllatte hjelpemdler:
Utsatt eksamen : ECON13 Statstkk 1 UNIVERSITETET I OSLO ØKONOMISK INSTITUTT Eksamensdag: 11.8.16 Sensur kunngjøres senest: 6.8.16 Td for eksamen: kl. 9: 1: Oppgavesettet er på 4 sder Tllatte hjelpemdler:
MoD233 - Geir Hasle - Leksjon 10 2
 Leksjon 10 Anvendelser nettverksflyt Transportproblemet Htchcock-problemet Tlordnngsproblemet Korteste-ve problemet Nettverksflyt med øvre begrensnnger Maksmum-flyt problemet Teorem: Maksmum-flyt Mnmum-kutt
Leksjon 10 Anvendelser nettverksflyt Transportproblemet Htchcock-problemet Tlordnngsproblemet Korteste-ve problemet Nettverksflyt med øvre begrensnnger Maksmum-flyt problemet Teorem: Maksmum-flyt Mnmum-kutt
Kopi til. star ovenfor som ønsket effekt gjennom å understreke den vedvarende. fremtiden. tillegg er tre elementer; i
 - / BEFALETS FELLESORGANISASJON Forsvarsstaben Var saksbehander. Kop tl Var referanse Jon Vestl [Koptl] 2015/JV/jv 14.09.2015 953 65 907, Jon.vestl@bfo.no Internt Intern kop tl Tdlgere referanse Var Tdlgere
- / BEFALETS FELLESORGANISASJON Forsvarsstaben Var saksbehander. Kop tl Var referanse Jon Vestl [Koptl] 2015/JV/jv 14.09.2015 953 65 907, Jon.vestl@bfo.no Internt Intern kop tl Tdlgere referanse Var Tdlgere
Løsningsforslag øving 10 TMA4110 høsten 2018
 Løsnngsforslag øvng TMA4 høsten 8 [ + + Projeksjonen av u på v er: u v v u v v v + ( 5) [ + u v v u [ 8/5 6/5 For å fnne ut om en matrse P representerer en projeksjon, må v sjekke om P P a) b) c) [ d)
Løsnngsforslag øvng TMA4 høsten 8 [ + + Projeksjonen av u på v er: u v v u v v v + ( 5) [ + u v v u [ 8/5 6/5 For å fnne ut om en matrse P representerer en projeksjon, må v sjekke om P P a) b) c) [ d)
DEN NORSKE AKTUARFORENING
 DEN NORSKE AKTUARFORENING _ MCft% Fnansdepartementet Postboks 8008 Dep 0030 OSLO Dato: 03.04.2009 Deres ref: 08/654 FM TME Horngsuttalelse NOU 2008:20 om skadeforskrngsselskapenes vrksomhet. Den Norske
DEN NORSKE AKTUARFORENING _ MCft% Fnansdepartementet Postboks 8008 Dep 0030 OSLO Dato: 03.04.2009 Deres ref: 08/654 FM TME Horngsuttalelse NOU 2008:20 om skadeforskrngsselskapenes vrksomhet. Den Norske
10 kmol/s 8,314 kj/(kmol K) 298,15 K 110 kpa. kmol K ,20 ln
 LØYSINGSFORSLAG, eksamen 3. ma 07 fag TEP45 TERMODYNAMIKK. Iar S. Ertesåg, sst endra. jun 07 ) p, bar; p 6 bar; p 3, bar. T T T 3 5 C 98,5 K ṅ O, kmol/s; ṅ N, 7 kmol/s; ṅ CO, kmol/s; ṅ O,3 ṅ O,; ṅ N,3
LØYSINGSFORSLAG, eksamen 3. ma 07 fag TEP45 TERMODYNAMIKK. Iar S. Ertesåg, sst endra. jun 07 ) p, bar; p 6 bar; p 3, bar. T T T 3 5 C 98,5 K ṅ O, kmol/s; ṅ N, 7 kmol/s; ṅ CO, kmol/s; ṅ O,3 ṅ O,; ṅ N,3
GYdas Vei 8. PO:'~.)cks 8149 Osl o Dep, Oslo 1. a-kvarts pa NUCLEPORE FILTERE MED R0NTGEN-
 . KVANTTATV MKROANALYSE AV a-kvarts pa NUCLEPORE FLTERE MED R0NTGEN- :\~ D FFRAKTOMETR. Grete Edholm og Davd G. Ncholson Yrkeshygensk nsttutt, Gydas ve 8, Oslo 3.HD 7 8 3 o. november 1978 /" ARBEJOSFORSKN
. KVANTTATV MKROANALYSE AV a-kvarts pa NUCLEPORE FLTERE MED R0NTGEN- :\~ D FFRAKTOMETR. Grete Edholm og Davd G. Ncholson Yrkeshygensk nsttutt, Gydas ve 8, Oslo 3.HD 7 8 3 o. november 1978 /" ARBEJOSFORSKN
Årbeidsretta tiltak og tjenester
 skal være ledende og framtdsrettet nnen tlrettelagt arbed og arbedsrelatert opplærng Hallngdal Å R S R Å P P O R T 2 0 5 Årbedsretta tltak og tjenester INNHOLD SIDE Innlednng Om : Eerforhold og lokalserng
skal være ledende og framtdsrettet nnen tlrettelagt arbed og arbedsrelatert opplærng Hallngdal Å R S R Å P P O R T 2 0 5 Årbedsretta tltak og tjenester INNHOLD SIDE Innlednng Om : Eerforhold og lokalserng
Trykkløse rørsystemer
 Trykkløse rørsystemer har kabel- og avløpsrørsystemer PVC, PP og PE med komplette delespektre. PE benyttes trykkrør som utslppslednnger, som lednng dårlge masser (myr) og ved høy overdeknng og/eller høy
Trykkløse rørsystemer har kabel- og avløpsrørsystemer PVC, PP og PE med komplette delespektre. PE benyttes trykkrør som utslppslednnger, som lednng dårlge masser (myr) og ved høy overdeknng og/eller høy
Oppsummering Mekanikk. Newtons 2. lov: masse akselerasjon = kraft (total ytre kraft) Posisjon x [m] dx dt. v x. a x () t dt. Hastighet v x [m/s]
![Oppsummering Mekanikk. Newtons 2. lov: masse akselerasjon = kraft (total ytre kraft) Posisjon x [m] dx dt. v x. a x () t dt. Hastighet v x [m/s] Oppsummering Mekanikk. Newtons 2. lov: masse akselerasjon = kraft (total ytre kraft) Posisjon x [m] dx dt. v x. a x () t dt. Hastighet v x [m/s]](/thumbs/55/35965284.jpg) Oppsummerng Mekankk Sde av 6 Newtons. lov: masse akselerasjon kraft (total ytre kraft) Possjon x [m] Hastghet v x [m/s] Akselerasjon a x [m/s ] v x dx ----- dx v x x() t x( 0) a x t 0 v x () t dv -------
Oppsummerng Mekankk Sde av 6 Newtons. lov: masse akselerasjon kraft (total ytre kraft) Possjon x [m] Hastghet v x [m/s] Akselerasjon a x [m/s ] v x dx ----- dx v x x() t x( 0) a x t 0 v x () t dv -------
Makroøkonomi - B1. Innledning. Begrep. Mundells trilemma 1 går ut på følgende:
 Makroøkonom Innlednng Mundells trlemma 1 går ut på følgende: Fast valutakurs, selvstendg rentepoltkk og fre kaptalbevegelser er kke forenlg på samme td Av de tre faktorene er hypotesen at v kun kan velge
Makroøkonom Innlednng Mundells trlemma 1 går ut på følgende: Fast valutakurs, selvstendg rentepoltkk og fre kaptalbevegelser er kke forenlg på samme td Av de tre faktorene er hypotesen at v kun kan velge
Henny Penny varmeskap Modell HEC-103 Modell HEC-104 Modell HEC-123 Modell HEC-124
 Henny Penny varmeskap Modell HEC-103 Modell HEC-104 Modell HEC-123 Modell HEC-124 BRUKERHÅNDBOK INNHOLD Sde Del 1. INNLEDNING 1-1. Varmeskap... 1-1 1-2. Funksjoner... 1-1 1-3. Rktg behandlng... 1-2 1-4.
Henny Penny varmeskap Modell HEC-103 Modell HEC-104 Modell HEC-123 Modell HEC-124 BRUKERHÅNDBOK INNHOLD Sde Del 1. INNLEDNING 1-1. Varmeskap... 1-1 1-2. Funksjoner... 1-1 1-3. Rktg behandlng... 1-2 1-4.
Forelesning 4 og 5 MET3592 Økonometri ved David Kreiberg Vår 2011
 Løsnnger lle oppgaver er merket ut fra vanskelghetsgrad på følgende måte: * Enkel ** Mddels vanskelg *** Vanskelg Hypotesetestng testng av enkelthypoteser Oppgave 1.* Når v tester enkelthypoteser ved hjelp
Løsnnger lle oppgaver er merket ut fra vanskelghetsgrad på følgende måte: * Enkel ** Mddels vanskelg *** Vanskelg Hypotesetestng testng av enkelthypoteser Oppgave 1.* Når v tester enkelthypoteser ved hjelp
Omsettelige grønne sertifikater under autarki og handel: Noen analytiske resultater*
 Norsk Økonomsk Tdsskrft 119 (2005) s. 1-15 Omsettelge grønne sertfkater under autark og handel: Noen analytske resultater* Erk S. Amundsen A og Gjermund Nese B Sammendrag: En rekke land har planer om å
Norsk Økonomsk Tdsskrft 119 (2005) s. 1-15 Omsettelge grønne sertfkater under autark og handel: Noen analytske resultater* Erk S. Amundsen A og Gjermund Nese B Sammendrag: En rekke land har planer om å
SIF5072 Stokastske prosesser Sde 2 av 6 b) Hva vl det s at en Markov-kjede er rredusbel? Er Markov-kjeden fx n g denne oppgaven rredusbel? Er den aper
 Norges teknsk naturvtenskapelge unverstet Insttutt for matematske fag Sde 1 av 6 Faglg kontakt under eksamen: Bo Lndqvst 73 59 35 20 EKSAMEN I FAG SIF5072 STOKASTISKE PROSESSER Mandag 13. august 2001 Td:
Norges teknsk naturvtenskapelge unverstet Insttutt for matematske fag Sde 1 av 6 Faglg kontakt under eksamen: Bo Lndqvst 73 59 35 20 EKSAMEN I FAG SIF5072 STOKASTISKE PROSESSER Mandag 13. august 2001 Td:
Jobbskifteundersøkelsen Utarbeidet for Experis
 Jobbskfteundersøkelsen 15 Utarbedet for Expers Bakgrunn Oppdragsgver Expers, ManpowerGroup Kontaktperson Sven Fossum Henskt Befolknngsundersøkelse om holdnnger og syn på jobbskfte Metode Webundersøkelse
Jobbskfteundersøkelsen 15 Utarbedet for Expers Bakgrunn Oppdragsgver Expers, ManpowerGroup Kontaktperson Sven Fossum Henskt Befolknngsundersøkelse om holdnnger og syn på jobbskfte Metode Webundersøkelse
Eksamensoppgave i TFY4125 Fysikk
 de av 3 Insttutt for fyskk Eksamensoppgave TFY45 Fyskk Faglg kontakt under eksamen: Evnd Hs Hauge Tlf.: 98 5 3 Eksamensdato: 8. jun 3 Eksamenstd (fra-tl): 9: 3: Hjelpemddelkode/Tllatte hjelpemdler: Kode
de av 3 Insttutt for fyskk Eksamensoppgave TFY45 Fyskk Faglg kontakt under eksamen: Evnd Hs Hauge Tlf.: 98 5 3 Eksamensdato: 8. jun 3 Eksamenstd (fra-tl): 9: 3: Hjelpemddelkode/Tllatte hjelpemdler: Kode
Forelesning 17 torsdag den 16. oktober
 Forelesnng 17 torsdag den 16. oktober 4.12 Orden modulo et prmtall Defnsjon 4.12.1. La p være et prmtall. La x være et heltall slk at det kke er sant at x 0 Et naturlg tall t er ordenen tl a modulo p dersom
Forelesnng 17 torsdag den 16. oktober 4.12 Orden modulo et prmtall Defnsjon 4.12.1. La p være et prmtall. La x være et heltall slk at det kke er sant at x 0 Et naturlg tall t er ordenen tl a modulo p dersom
Fourieranalyse. Fourierrekker på reell form. Eksempel La. TMA4135 Matematikk 4D. En funksjon sies å ha periode p > 0 dersom
 TMA435 Matematkk 4D Foureranalyse Fourerrekker på reell form En funksjon ses å ha perode p > dersom f(x + p) = f(x) () for alle x defnsjonsmengden tl f. Den mnste p slk at () holder, kalles fundamentalperoden
TMA435 Matematkk 4D Foureranalyse Fourerrekker på reell form En funksjon ses å ha perode p > dersom f(x + p) = f(x) () for alle x defnsjonsmengden tl f. Den mnste p slk at () holder, kalles fundamentalperoden
Alderseffekter i NVEs kostnadsnormer. - evaluering og analyser
 Alderseffekter NVEs kostnadsnormer - evaluerng og analyser 2009 20 06 20 10 20 10 20 10 21 2011 20 10 20 10 20 10 20 10 20 10 20 10 20 10 20 10 20 10 R A P P O R T 20 10 20 10 20 10 20 10 20 10 20 10 20
Alderseffekter NVEs kostnadsnormer - evaluerng og analyser 2009 20 06 20 10 20 10 20 10 21 2011 20 10 20 10 20 10 20 10 20 10 20 10 20 10 20 10 20 10 R A P P O R T 20 10 20 10 20 10 20 10 20 10 20 10 20
