1 OPPSUMMERING. Brev stiles til Statens legemiddelverk. Vennligst oppgi vår referanse.
|
|
|
- Konrad Haaland
- 7 år siden
- Visninger:
Transkript
1 Rapport og vedtak fra Statens legemiddelverk vedrørende søknad om opptak av fulvestrant (Faslodex) på listen over refusjonsberettigede legemidler etter 9 i forskrift om godtgjørelse av utgifter til viktige legemidler 1 OPPSUMMERING Formål: Å vurdere fulvestrant (Faslodex) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning av utgifter til viktige legemidler og spesielt medisinsk utstyr (blåreseptforskriften) 9 punkt 9 maligne svulster, leucæmia, lymfomatose, myelomatose o.l. Indikasjon: Fulvestrant (Faslodex) er indisert ved behandling av postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastaserende brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling eller ved sykdomsprogresjon under behandling med antiøstrogen. Bakgrunn: Brystkreft er en ondartet svulst som oppstår i brystet. Det finnes flere typer, men de fleste utgår fra brystkjertlene. Biologisk er brystkreft karakterisert ved svært varierende sykdomsforløp. I den ene enden av skalaen finnes rasktvoksende svulster med tidlig spredning, mens det i den andre enden av skalaen finnes langsomtvoksende svulster som forblir lokale i brystkjertelen. Brystkreft er den hyppigste kreftform hos kvinner i Norge, og utgjør om lag 23 % av alle krefttilfeller hos kvinner. Hvert år diagnostiseres mer enn 2700 nye tilfeller, og antallet nye tilfeller (insidens) er jevnt økende. Målsettingen med behandlingen er å etablere kontroll over brystkreftsykdommen og å bedre muligheten for helbredelse. I dette ligger intensjonen om å forhindre plager av lokal svulst, forebygge tilbakefall av lokal svulst og forhindre videre spredning. Den viktigste behandling ved brystkreft er kirurgi og eventuelt strålebehandling. Kirurgi er fortsatt hovedmetoden for å oppnå kontroll over kreftsvulst i bryst og armhule. Selv om leveutsiktene ved brystkreft er bedret gjennom de siste tiår, vil en relativt stor andel av pasientene måtte påregne tilbakefall av sykdommen. På grunn av gunstige effekter av tilleggsbehandling (adjuvant) med kjemoterapi og hormonell (endokrin) behandling, får brystkreftpasientene i dag tilbud om slik behandling i en eller annen form. En av de viktigste legemiddelgruppene innen hormonell behandling av østrogenfølsom brystkreft, er antiøstrogener. For brystkreftpasienter som har fått tilbakefall eller progresjon av sykdommen kan behandling med aromatasehemmere eller progesteroner være alternativ. Brev stiles til Statens legemiddelverk. Vennligst oppgi vår referanse. Statens legemiddelverk Tlf.: Kto Besøksadr.: Sven Oftedals vei 8, 0950 Oslo Fax: post@legemiddelverket.no Org.nr Varelev.: Sven Oftedals vei 6, 0950 Oslo
2 2/21 Fulvestrant representerer det første legemidlet i en ny klasse av antiøstrogener som betegnes østrogenreseptorantagonister. Kliniske studier på postmenopausale kvinner med primær brystkreft, har vist at fulvestrant signifikant nedregulerer ER-protein i østroge n- reseptorpositive svulster sammenlignet med placebo. Studier viser at fulvestrant trolig ikke er kryssresistent med andre hormonelle behandlinger slik som eksempelvis tamoksifen er. Dette gir en ny behandlingsmulighet for kvinner som tidligere har respondert på hormonell behandling, men hvor sykdommen har progrediert. Resultat: Effekten av fulvestrant ble undersøkt i to randomiserte, kontrollerte multisenter studier. I studiene ble fulvestrant direkte sammenlignet med den selektive aromatasehemmeren anastrozol hos postmenopausale kvinner med lokalavansert eller metastaserende br ystkreft. I evalueringsrapporten til de europeiske legemiddelmyndigheter (EMEA) konkluderes det med at månedlig injeksjon av 250 mg fulvestrant er vist å være minst like effektiv (non-inferiority) som daglig behandling med 1 mg anastrozol hos postmenopaus ale kvinner med lokalavansert eller metastaserende brystkreft. EMEA understreker at effekt kun er vist for pasienter som har østrogenreseptorpositiv kreft. Den helseøkonomiske modellen som er lagt ved refusjonssøknaden er en markovmodell med monte carlo simulering der fulvestrant direkte blir sammenlignet med anastrozol. Refusjonssøker har utført en kostnad-effekt analyse hvor resultatene indik e- rer at behandling med fulvestrant synes å gi en mer-effekt i form av at gjennomsnittspasienten får flere levemåneder og økt helserelatert livskvalitet. Legemiddelverket har den oppfatning at det er knyttet usikkerhet rundt kostnadseffektiviteten ved bruk av fulvestrant til behandling av avansert brystkreft. Brystkreft er en alvorlig sykdom der behandlingsmulighetene for avansert sykdom i dag er begrenset. Behandling med fulvestrant kan representere et nytt behandlingstilbud for denne gruppen pasienter.
3 3/21 Vedtak: Statens legemiddelverk vedtar at fulvestrant (Faslodex) innvilges refusjon etter 9 punkt 9, bokstav a) for indikasjonen behandling av: Postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastaserende brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling, eller ved sykdomsprogresjon under behandling med antiøstrogen. Med følgende refusjonsvilkår: - Postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastasternede brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling, eller ved sykdomsprogresjon under behandling med antiøstrogen. - Behandling kan kun igangsettes av spesialist i onkologi, eller spesialist i generell kirurgi ved sykehus som behandler pasienter med brystkreft - Før behandling med Faslodex (fulvestrant) igangsettes skal progresjon av sykdom under eller etter annen endokrin adjuvant behandling dokumenteres. Vedtaket er betinget i den forstand at det kan revurderes og endres dersom det tilkommer nye forhold som endrer grunnlaget eller premissene for refusjonsvedtaket. Det stilles derfor krav om at senest 1 år etter at oppfølgingsstudier av effekt og sikkerhet av fulvestrant i høyere dosering er avsluttet, skal refusjonssøker sende inn en ny helseøkonomisk analyse av fulvestrant, jf legemiddelforskriften Statens legemiddelverk vil da foreta en revurdering av refusjonsstatus for fulvestrant (Faslodex).
4 4/21 Innholdsfortegnelse 1 OPPSUMMERING SØKNADSLOGG INTRODUKSJON/BAKGRUNN BRYSTKREFT EKSISTERENDE BEHANDLINGSMULIGHETER Kirurgi og strålebehandling Adjuvant systemisk behandling BEHANDLING MED FULVESTRANT INNLEDNING EFFEKTSTUDIER, DESIGN OG RESULTATER Valg av sammenligningspreparat Endepunkt Resultater Dosering EMEAS EVALUERINGSRAPPORT BIVIRKNINGER INTERAKSJONER EN LEGEMIDDELØKONOMISK ANALYSE AV FULVES TRANT REFUSJONSSØKNADENS MODELL- OG METODEAPPARAT HELSEEFFEKTER, HELSEGEVINST OG KOS TNADER VED VURDERTE BEHANDLINGSALTERNATIV STUDIENS KOSTNADSPERSPEKTIV KOSTNADER Direkte kostnader Indirekte kostnader Ubestemte kostnader Legemiddelets kostnadseffektivitet SENSITIVITETSANALYSE DISKONTERING DISKUSJON FOREKOMST AV SYKDOM AKTUELLE KANDIDATER FOR BEHANDLING MED FULVESTRANT KLINISK DOKUMENTASJON AV FULVESTRANT LEGEMIDDELVERKETS VURDERING AV DEN HELSEØKONOMISKE ANALYSEN VEDTAK REFERANSER...21
5 5/21 2 SØKNADSLOGG Refusjonssøker: Preparat: Virkestoff: Indikasjon: ATC-nr: Legemiddelform, styrke: Søknadsprosess: AstraZeneca. Faslodex Fulvestrant Faslodex (fulvestrant) er indisert ved behandling av postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastaserende brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling eller ved sykdomsprogresjon under behandling med antiøstrogen L02B A03 Injeksjonsvæske, oppløsning, 250 mg/5 ml. Søknad mottatt Statens legemiddelverk og funnet gyldig Vedtak og rapport er sendt til Helsedepartementet Saksbehandlingstiden for refusjonssøknaden var 168 dager. 3 INTRODUKSJON/BAKGRUNN 3.1 Brystkreft Brystkreft er en ondartet svulst som oppstår i brystet. Det finnes flere typer, men de fleste utgår fra brystkjertlene. Biologisk er brystkreft karakteriser t ved svært varierende sykdomsforløp. I den ene enden av skalaen finnes rasktvoksende svulster med tidlig spredning, mens det i den andre enden av skalaen finnes langsomtvoksende svulster som forblir lokale i brys t- kjertelen. Personer med forhøyet risiko for å få brystkreft (arv) tilbys en adekvat oppfølging for å kunne stille diagnosen brystkreft så tidlig som mulig. Tidlig diagnose er tross store forskjeller i biologi, den viktigste faktor for å bedre prognosen for pasienter med brystkreft. Dette er vist i flere screeningundersøkelser. Utvikling av brystkreft deles ofte inn i fire stadier, og leveutsiktene vil avhenge av hvilket stadium kreften er i når den oppdages. For brystkreft i 1. og 2. stadium er utsiktene gode fordi kreftsvulsten er begrenset til br ystkjertelen (stadium 1) og nærliggende lymfekjertler (stadium 2). I 1995 hadde mer enn 60% av kvinnene ved dia g- nosetidspunktet påvisbar kreft kun i selve brystet (stadium 1). Dette er en klar forbedring fra tidligere, og viser trolig effekten av innføring av mammografiscreening. Den observerte økningen i antall nye tilfeller av brystkreft i de senere årene utgjøres hovedsakelig av kvinner med brystkreft i stadium 1.
6 6/21 % Figur 1: Stadiumfordeling- Brystkreft i Norge 1995 Stadium 1 Stadium 2 Stadium 3 Stadium 4 Stadium 1: Påvisbar liten svulst i brystet Stadium 2: Svulst begrenset til bryst og nærliggende lymfeknuter Stadium 3: Svulsten er mer omfangsrik. Stadium 4: Spredning til andre organer Kilde: Blåboka Norsk Bryst Cancer Gruppe Forekomst Brystkreft er den hyppigste kreftform hos kvinner i Norge og utgjør om lag 23 % av alle krefttilfeller hos kvinner 1. Beregninger viser at hver 11. kvinne vil utvikle brystkreft 1. Hvert år diagnostiseres mer enn 2700 nye tilfeller, og antallet nye tilfeller (insidens) er jevnt økende 2. Rundt kvinner i Norge har diagnosen brystkreft, og det er først og fremst kvinner over 50 år som rammes. Trolig utgjør denne gruppen ca 80 % av alle brystkrefttilfellene og ca 32% av disse befinner seg i stadium 2 (se figur 1). Tall fra kreftregisteret viser at forekomsten av kvinner med brystkreft i stadium 2 i 2001 var Aktuelle kandidater for behandling med fulvestrant Behandling med fulvestrant kan på bakgrunn av godkjent indikasjon være aktuelt for postmenopausale kvinner der kreften betegnes som østrogenreseptorpositiv, klassifisert til å være i stadium 2 eller eventuelt i en mer langtkommen fase og at kvinnen ikke kan opereres. Dette medfører at antall aktuelle kandidater for fulvestrant vil kunne være begrenset. 3.2 Eksisterende behandlingsmuligheter Kirurgi og strålebehandling Målsettingen med behandlingen er å etablere kontroll over brystkreftsykdommen og å bedre muligheten for helbredelse. I dette ligger intensjonen om å forhindre plager av lokal svulst, forebygge tilbakefall av lokal svulst og forhindre videre spredning. Den viktigste behandling ved brystkreft er kirurgi og eventuelt strålebehandling. Kirurgi er fortsatt hovedmetoden for å oppnå kontroll over kreftsvulst i bryst og armhulen 1. Strålebehandling kan gis både før og etter operasjon, eller som eneste form for lokal behandling. Postoperativ strålebehandling er mest brukt og kan redusere antall tilbakefall og øke overlevelsen ved brystkreft i stadium 2.
7 7/ Adjuvant systemisk behandling Selv om leveutsiktene ved brystkreft er bedret gjennom de siste tiår, vil en relativt stor andel av pasientene måtte påregne tilbakefall av sykdommen. Innen 10 år etter diagnostisering/behandling vil ca 25% av pasienter i stadium 1 og 50-75% av pasientene i stadium 2 oppleve tilbakefall 3. På grunn av gunstige effekter av tilleggsbehandling (adjuvant) med kjemoterapi 4 og hormonell (endokrin) behandling 5 får brystkreftpasientene i dag tilbud om slik behandling i en eller annen form. Hormonbehandling Brystkjertelvevets vekst og funksjon er avhengig av et komplekst samspill mellom mange hormoner. Denne følsomheten for hormoner vil et svulstvev beholde i varierende grad. Derfor vil et sentralt terapeutisk angrepspunkt ved brystkreft være behandling som på forskjellige måter hindrer eksempelvis østrogenets stimulerende virkning på brystkreftceller. I behandling av hormonfølsom brystkreft hos postmenopausale kvinner er følgelig hormonbehandling blitt et naturlig valg. Antiøstrogen En av de viktigste legemiddelgruppene innen hormonell behandling av østrogenfølsom brystkreft har vært og fortsatt er antiøstrogenet tamoksifen. Antiøstrogen har en klar anti-tumor effekt og kan redusere risikoen for kolateral brystkreft 1. Et problem med tamoksifenbehandling kan være utvikling av resistens mot legemidlet. For brystkreftpasienter som har fått tilb a- kefall eller progresjon av sykdommen etter tamoksifenbehandling kan behandling med arom a- tasehemmere eller progesteroner være et alternativ. Aromatasehemmere Aromatasehemmere har anti-tumoreffekt ved at østrogennivåene i brystvevet nedsettes gje n- nom å hemme enzymet som danner østrogener. Aromatasehemmere kan inndeles i to hovedgrupper: De såkalte ikke-steroide reversible hemmerne som anastrozol og letrozol, og de irreversible aromataseinaktivatorene som eksemestan 2. Progesteroner De mest brukte progesteronene er megestrol acetat og medroksyprogesteron. På grunn av høy forekomst av bivirkninger ved bruk av disse legemidlene blir progesteroner lite benyttet og kun ved terapisvikt som tredje/fjerde-linjebehandling.
8 8/21 4 BEHANDLING MED FULVESTRANT 4.1 Innledning Brystkreft er den vanligste kreftformen hos kvinner, og hver 11. kvinne vil i løpet av livet utvikle sykdommen. En økende populasjon av eldre kvinner kan føre til en stigende forekomst av brystkreft, særlig blant postmenopausale kvinner. Indikasjon Fulvestrant (Faslodex) er indisert ved behandling av postmenopausale kvinner med østroge n- reseptorpositiv lokalavansert eller metastaserende brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling eller ved sykdomsprogres jon under behandling med antiøstrogen. Virkningsmekanisme Fulvestrant representerer det første legemidlet i en ny klasse av antiøstrogener som betegnes østrogenreseptorantagonister. Fulvestrant bindes kompetitivt til østrogenreseptorer uten selv å ha østrogenlignende aktivitet (slik som tamoksifen kan ha). Virkningsmekanismen innebærer en nedregulering av østrogenreseptorprotein (ER-protein). Kliniske studier på postmenopausale kvinner med primær brystkreft, har vist at fulvestrant signifikant nedregulerer ER-protein i østrogenreseptorpositive svulster sammenlignet med placebo 6. Studier viser at fulvestrant trolig ikke er kryssresistent med andre hormonelle behandlinger slik som eksempelvis tamoksifen er 7. Dette gir en ny behandlingsmulighet for kvinner som tidligere har respondert på hormonell behandling, men hvor sykdommen har progrediert. 4.2 Effektstudier, design og resultater Effekten av fulvestrant ble undersøkt i to randomiserte, kontrollerte multisenter studier; studie 0020 og I studiene ble fulvestrant direkte sammenlignet med den selektive aromatasehemmeren anastrozol hos postmenopausale kvinner med lokalavansert eller metastaserende brystkreft. Studie 0020, som var en åpen mulitisenterstudie, ble utført i Europa, Australia og Sør-Afrika, mens studie 0021 var en dobbelt-blind studie utført i Nord-Amerika. Begge studiene var opprinnelig designet for å undersøke muligheten for superiority (mer-effekt) av fulvestrant over anastrozol, men statistisk signifikante forskjeller ble ikke vist. Derfor utførte en uavhengig ekspertgruppe en retrospektiv endring i studiedesign til noninferiority (vise tilsvarende effekt). Data fra studiene (0020 og 0021) ble slik som planlagt kombinert for en totalvurdering av effekten til månedlig injeksjon fulvestrant 250 mg Valg av sammenligningspreparat I begge de pivotale studiene ble fulvestrant sammenlignet med anastrozol. Anastrozol var den første tredjegenerasjons aromatasehemmere, og er fortsatt en av de mest benyttede. Anastrozol er tidligere sammenlignet med progesteronet megestrol acetat i studier der median tid til progresjon var tilnærmet 5 måneder, og pasientpopulasjonen tilsvarte deltagerne i fulvestrantstudiene. Valg av anastrozol som sammenligningspreparat er av de europeiske legemiddelmyndigheter (EMEA) vurdert å være relevant 9.
9 9/ Endepunkt Det primære endepunkt i studiene var å sammenligne tid til progresjon av sykdom. Tid til progresjon ble definert som antall dager fra randomisering til en objektiv sykdomsprogresjon ble dokumentert, eller til død uavhengig av årsak. Sekundære endepunkter var blant annet å sammenligne objektiv responsrate, varighet av respons, tid til behandlingssvikt, tid til død, symptomatisk respons, livskvalitet og lokal og systemisk tolerabilitet av legemidlet Resultater Totalt ble 1014 pasienter randomisert og inkludert i studiene 0020 og Hvor av 428 pasienter ble behandlet med månedlige injeksjoner av 250 mg fulvestrant og 423 pasienter ble behandlet daglig med anastrozol 1 mg tabletter. De resterende 163 pasienter fikk månedlig behandling med 125 mg fulvestrant. Denne studiearmen ble avsluttet før planlagt studietid. Dette fordi det ikke ble vist tilstrekkelig effekt av fulvestrant 125 mg hos de 30 første innrullerte deltagere. Gjennomsnittsalderen i begge studier var for pasienter behandlet med fulvestrant 64 år, mens for pasienter behandlet med anastrozol i studie 0020 var 65 år og i studie år. Gjennomsnittlig vekt var for Nord-Amerikanske kvinner 3-5 kg høyere enn for de øvrige deltagerne. Den vanligste hormonelle behandlingen deltagerne tidligere hadde fått var tamoksifen. Pasientene hadde en median oppfølgingstid på 439 dager i studie 0020 og 510 dager i studie 0021 Dette tilsvarer en median oppfølgingstid på 22,1 måneder. Resultatene fra de kombinerte dataene viste at tid til progresjon var 166 dager for fulvestrantgruppen og 126 dager for anastrozolgruppen (Hasard Ratio 0,95, 0,95%KI 0,82-1,10), men resultatet var ikke signifikant (p=0,48). Figur 2 viser et Kapplan-Meier plot av tid til progresjon. Under studieperioden fikk 83% av pasientene i fulvestrantgruppen og 85% av pasientene i anastrozolgruppen pr o- gresjon av sykdommen. Tumorprogresjon var den vanligste årsak til forverring i begge behandlingsgrupper. Død som følge av progresjon forekom sjeldnere enn 5 % i begge grupper. Den objektive responsraten for fulvestrant var 19,2% sammenlignet med 16,5 for anastrozol. Median tid til død var 27,4 måneder for pasienter behandlet med fulvestrant og 27,6 for pas i- enter behandlet med anastrozol. Hazard ratio mellom fulvestrant og anastrozol med hensyn til tid før død var 1,01 (95%KI 0,86-1,19). Analyser fra pasienter med østrogenreseptorstatus viste at bruken av fulvestrant bør begrenses til pasienter med østrogenreseptorpositiv brystkreft.
10 10/21 Figur 2: Kaplan-Meier plot for tid til progresjon kombinerte data fra studie 0020 og Kilde: EMEAS public assesment report, scientific discussion Dosering Månedlig injeksjon av 250 mg fulvestrant er i de pivotale studiene vist å ha tilsvarende effe kt som 1 mg daglig peroralt inntak av anastrozol. Den optimale dose og behandlingsregimet av fulvestrant med hensyn på nytte/risiko er til nå ikke klarlagt, og innehaver av markedsføringstillatelsen er pålagt av EMEA å utføre oppfølgingsstudie r der dette kan klarlegges. Resultatene fra disse studiene er til nå ikke tilgjengelige. Definert døgndose (DDD) er for fulvestrant fastsatt av WHO til å være 8,3 mg 10. Dette tilsvarer en månedlig injeksjon à 250 mg fulvestrant. Den definerte døgndose må generelt betraktes som en teknisk verdi som ligger så nær opp til et gjennomsnitt av de dosene som benyttes. Dette kan innebære at DDD ikke nødvendigvis er den mest forskrevne eller brukte dose. Da fulvestrant administreres fra en ferdigfylt sprøyte som en månedlig injeksjon er det større sannsynlighet at det er overenstemmelse mellom benyttet dose og DDD. Til nå er det samsvar mellom antall solgte døgndoser og antall brukere, men dette kan endres over tid 11, EMEAS evalueringsrapport I evalueringsrapporten til de europeiske legemiddelmyndigheter (EMEA) 9 konkluderes det med at månedlig injeksjon av 250 mg fulvestrant er vist å være minst like effektiv (noninferiority) som daglig behandling med 1 mg anastrozol hos postmenopausale kvinner med lokalavansert eller metastaserende brystkreft. EMEA understreker at effekt kun er vist for
11 11/21 pasienter som har østrogenreseptorpositiv kreft. Dette innebærer at godkjent indikasjon er begrenset til bruk av fulvestrant som annenlinje behandling. 4.4 Bivirkninger I de kliniske studiene opplevede ca 47% av pasientene bivirkninger. Imidlertid var det kun 0,9% av pasientene som avbrøt behandlingen på grunn av bivirkninger. De hyppigst rapporterte bivirkningene er hetebølger, kvalme og reaksjoner på injeksjonsstedet 6. Det finnes ingen langtidsdata på fulvestrant og effekt på bensubstans. På grunn av fulvestrants virkningsmekanisme, er behandling med fulvestrant forbundet med en potensiell risiko for benskjørhet i likhet med aromatasehemmere. 4.5 Interaksjoner Av de interaksjonsstudier som er foretatt viser resultatene at dosejustering ikke er nødvendig for pasienter som får fulvestrant samtidig med CYP 3A4 hemmere eller induktorer.
12 12/21 5 EN LEGEMIDDELØKONOMISK ANALYSE AV FULVESTRANT 5.1 Refusjonssøknadens modell- og metodeapparat Den helseøkonomiske modellen er en markov-modell med monte carlo simulering der fulvestrant (behandlingsforløp A) blir direkte sammenlignet med anastrozol (behandlingsforløp B). De to behandlingsforløpene i modellen er skissert nedenfor (figur 3). Modellen som er utarbeidet er en simuleringsmodell over 10 år av en kohort på 1000 pasie n- ter. Antall mulige sykler i modellen er 120 (tilsvarer 10 år). Modellen er utført i Treeage. Figur 3: Modellens ulike behandlingsforløp A B Postmenopausale kvinner med avansert brystkreft Postmenopausale kvinner med avansert brystkreft Fulvestrant Anastrozol Kjemoterapi Anastrozol Eksemesta- Kjemoterapi Eksemesta- Best supportive care Best supportive care Død Død = 2.linjebehandling = 3.linjebeha ndling Behandlingsforløpet i modellen er basert på hvilket preparat som blir valgt når sykdommen progredierer. En andel pasienter (35%) som ikke har objektiv respons på et endokrint legemiddel vil få kjemoterapi (cellegift). Når ikke lenger endokrin behandling har effekt, vil pas i- entene få best mulig terminalomsorg (best supportive care). Slik behandling varer frem til pasienten dør. Under best mulig terminalomsorg inngår blant annet lindrende strålebehandling av skjellettmetastaser.
13 13/21 For å belyse den helseøkonomiske gevinsten av fulvestrants manglende kryssresistens med andre endokrine legemidler, representerer behandling med fulvestrant et ekstra ledd i kjeden av mulige endokrine behandlinger. Refusjonssøker begrunner at anastrozol vil komme etter fulvestrant i behandlingsforløpet (behandlingsforløp A) fordi anastrozol er en aromatasehemmer, og har følgelig en annen virkemekanisme enn fulvestrant (anti-østrogen). I både behandlingsforløp A og B er eksemestan lagt i inn etter anastrozol. Eksemestan er også en aromatasehemmer, men har noe forskjellig virkemekanisme enn anastrozol, og brukes blant annet på pasienter der behandling med øvrige aromatasehemmere har sviktet 1. Kliniske endepunkter Refusjonssøker ønsker å belyse den helseøkonomiske verdien av fulvestrant ved å vise en mulig utvidelse av det terapeutiske vinduet legemidlet kan representere. Modellens endepunkter er derfor livslengde rapportert i måneder, og helserelatert livskvalitet målt i QALY. Mål på helsetilstand Helsetilstandsmålene (utilities) er hentet fra en cost-utility analyse der to cellegiftbehandlin g- er (2.linje) blir indirekte sammenlignet i behandling av brystkreft 13. Målene for de ulike helsetilstandene (se tabell 1) er fremkommet ved at 30 britiske kreftsykepleiere var respondenter (proxy patients). De ulike helsetilstandsmål er fremkommet ved bruk av standard gamble. Tabell 1: Helsetilstandsmål for ulike tilstander i brystkreftbehandling Sykdomsstatus Helsetilstandsmål (utility) Stabil 0,62 Responder 0,84 Progrediert 0,33 Død 0,00 Overgangssannsynlighetene som er benyttet i modellen er basert på median tid til progresjon, median responstid og median tid til død. Årsaken til dette er at ikke alle pasientene i datamaterialet analysen bygger på hadde progrediert, eller var døde. Refusjonssøker mener at selv ved å benytte gjennomsnitt vil det ikke påvirke kostnadseffektiviteten av fulvestrant, da legemidlet kan bidra til å utsette behandling med kjemoterapi. Modellens bygger på forutsetninger som: - Effektdataene for bruk av fulvestrant og anastrozol som 2.linjebehandling er hentet fra de kliniske studiene 0020 og Effektdataene i 3.linjebehandling er hentet fra en retrospektiv studie av 55 kvinner med avansert brystkreft 14, der pasientene mottar forskjellig typer endokrin (hormonell) behandling. - Det antas at hos 35% av pasientene (både fra 2.linje og 3.linjebehandling) vil sykdommen progrediere etter behandling med enten behandlingsforløp A eller B. Den en-
14 14/21 kelte pasient får høyst 6 kurer med cellegiftbehandling. Deretter vil modellen overføre pasienten til neste steg i behandlingsforløpet som er enten beste terminalomsorg eller død. - Modellen skiller mellom pasienter som har objektiv respons og stabile pasienter. Stabile pasienter er pasienter som ikke har objektiv respons på fulvestrant, men som ikke progredierer til neste nivå i behandlingsforløpet. - Modellen antar at 19,2% av pasientene som er behandlet med fulvestrant er objektive respondere 8. - Modellen antar at 16,5% av pasientene som er behandlet med anastrozol er objektive respondere 8. - Respondere generelt har lengre tid til progresjon enn stabile pasienter. - Median tid til respons er 4 måneder for 2.linjebehandling i begge behandlingsforløpene. Det er ikke antatt noen median til respons for 3.linjebehandling i noen av behandlingsforløpene. - Pasienter som i modellen ikke defineres som objektive respondere får tillagt månedlig behandling med pamidronat (bifosfonat hindrer tumorindisert hyperkalsemi). 5.2 Helseeffekter, helsegevinst og kostnader ved vurderte behandlingsalternativ Den inkrementelle kostnadseffektivitetsraten til fulvestrant sammenlignet med anastrozol er beregnet i antall levemåneder og i kvalitetsjusterte leveår (QALY). Tabell 2 viser resultatene av den helseøkonomiske analysen med hensyn på beregnede ekstra levemåneder behandling med fulvestrant sammenlignet med anastrozol gir. Gitt modellens forutsetninger og varighet over 10 år, viser analysen at behandling med fulvestrant gir i gjennomsnitt 4,39 ekstra levemåneder sammenlignet med behandling med anastrozol. En ekstra levemåned med fulvestrantbehandling koster i gjennomsnitt 4300 kroner. Tabell 2: Inkrementell kostnad-effektivitetsrate av fulvestrant vs. anastrozol med hensyn på levemåneder. Gjennomsnittskostnad Måneder Fulvestrant ,03 Anastrozol ,64 Differanse fulvestrant-anastrozol ,39 Inkrementell kostnadeffektratio 4296 kroner/måned Tabell 3 viser resultatene av den legemiddeløkonomiske analysen med hensyn på kvalitetsjusterte leveår målt i QALY. Gitt modellens forutsetninger og tidsperspektiv på 10 år, viser analysen at behandling med fulvestrant gir i gjennomsnitt 0,253 QALY sammenlignet med tilsvarende behandling med anastrozol. Den inkrementelle kostnad-seffektivtetsratioen viser at kostnaden per QALY er kroner.
15 15/21 Tabell 3: Inkrementell kostnad-effektivitetsrate av fulvestrant vs anastrozol med hensyn på QALY Gjennomsnittskostnad QALY Fulvestrant ,857 Anastrozol ,604 Differanse fulvestrant -anastrozol ,253 Inkrementell kostnadeffektratio kroner/qaly 5.3 Studiens kostnadsperspektiv Kostnadsperspektivet i den helseøkonomiske analysen er beregnet fra et samfunnsmessig perspektiv. Kostnad per mer-effekt i levemåneder og QALY er beregnet. 5.4 Kostnader Direkte kostnader Den helseøkonomiske modellen fokuserer kun på kostnader knytte t til behandling av avansert brystkreft. De direkte behandlingskostnader som er inkludert i modellen omfatter legemidde l- kostnader av fulvestrant, anastrozol og eksemestane. Videre inkluderer modellen kostnader ved terminal pleie, kjemoterapi, strålebehandling og kostnader ved konsultasjon hos spesialist. For pasienter som ikke blir definert som objektive respondere kommer i tillegg behandling med bifosfonat. Etter legemiddelverkets oppfatning er behandling av brystkreft meget komplekst og avansert. De fleste pasienter vil utover de identifiserte behandlinger ha behov for behandling av eksempelvis søvn og smerteplager. Dette vil likevel ikke få betydning for den legemiddeløkonomiske analysen da slik tilleggsbehandling vil være nødvendig for hele pasientgruppe n. Direkte kostnader utenfor helsesektoren som pasientkostnader, kostnader for pårørende og lignende er ikke beregnet Indirekte kostnader Indirekte kostnader i form av eksempelvis produksjonstap er ikke inkludert i modellen. Dette er rimelig da hovedtyngden pasienter enten vil være alderspensjonister, eller snart alderspensjonister Ubestemte kostnader Slike kostnader er ikke inkludert.
16 16/ Legemiddelets kostnadseffektivitet Den helseøkonomiske hovedanalysens samlede resultater av mer-effekt på antall levemåneder og kvalitetsjusterte leveår, gitt dataene, viser at fulvestrant kan være kostnadseffektiv behandling sammenlignet med anastrozol. Dette fordi de beregnede helseeffekter står i et rimelig forhold til kostnadene. 5.5 Sensitivitetsanalyse Det er utført sensitivitetsanalyser ved å endre blant annet variabler som kostnader og sannsynligheter. Det er utført 20 simuleringer der de fleste variabler er økt eller redusert med 50%. Legemiddelkostnadene er for 2.linjebehandling endret med 25% og med 50% for 3.linjebehandling. Refusjonssøker benytter også flere toveis sensitivitetsanalyser for å teste styrken av de viktigste faktorer i hovedanalysen. Generelt viser sensitivitetsanalysene at kostnadseffektiviteten av fulvestrant sammenlignet med anastrozol er robust for de endringer som er utført. Refusjonssøker fremhever at endringer i legemiddelkostnadene (dvs. fulvestrant og anastrozol) får liten betydning fordi dette blant annet kan skyldes en mer-effekt av fulvestrant ved at tid til progresjon forlenges og dermed bruker pasientene fulvestrant over en lengre tidsperiode. En følge av lengre tid til progresjon kan være utsettelse av terminalpleie og stråleterapi. Dette bidrar til en inkrementell kostnad-effekt ratio i favør av fulvestrant. Refusjonssøker trekker denne konklusjon på bakgrunn av sensitivitetsanalyse av blant annet diskonteringsrenten og prisendringer. Ved å endre sannsynlighetene i modellen utøver dette en relativt betydelig effekt på den inkrementelle kosntad-effekt ratioe n i retning av å gjøre både en ekstra levemåned og et kvalitetsjustert leveår dyrere. Dette kan illustreres ved å redusere det totale antall gjennomsnittlige levemåneder fra 4,39 til 2,72, medfører at en ekstra levemåned med fulvestrant da vil koste 7495 kroner. En tilsvarende reduksjon i QALY medfører at kostnaden per QALY øker fra (hovedanalysen) til (sensitivitetsanalysen). 5.6 Diskontering Analysens tidshorisont er 10 år. Det er derfor diskontert for både helseeffekter og kostnader. Renten som er lagt til grunn for diskontering er 4 %. Refusjonssøker begrunner valg av diskonteringsrente med at renten tilsvarer anbefaling i finansdepartementets veiledning for samfunnsøkonomiske analyser 15. Det er utført sensitivitetsanalyse av diskonteringsrenten i he n- hold til Legemiddelverkets retningslinjer for legemiddeløkonomiske analyser 16.
17 17/21 6 Diskusjon 6.1 Forekomst av sykdom Forekomsten av brystkreft er økende og er i dag den hyppigste kreftform hos kvinner 17. Utvikling og endringer i forekomst er i Norge mulig å følge da leger har plikt til å melde krefttilfeller til Kreftregisteret, jf Lov om helsepersonell og Lov om Helseregistre med tilhørende forskrifter. Dette innebærer at det finnes gode data på forekomst av sykdommen. Masseundersøkelsen mot brystkreft, Mammografiprogrammet, som er et tilbud om røntgenunde r- søkelse av brystene til kvinner i alderen år bidrar vesentlig til at kreftsykdommen oppdages på et tidlig stadium Aktuelle kandidater for behandling med fulvestrant På tross av data fra kreftregisteret vil det være usikkerhet knyttet til forekomst av brystkreft innen de ulike stadier (se 3.1) og om kreftsykdommen er hormonavhengig. Det kan derfor være vanskelig å beregne et mer eksakt antall aktuelle kandidater for behandling med fulvestant. Det er også usikkerheter knyttet til behandlingslengde med fulvestrant da det vil være store individuelle forskjeller i både hvem som responderer på behandlingen, og tid til progr e- sjon. Gitt dataene fra de kliniske studiene 8, og antagelsen om at median tid med bruk av fulvestrant er 6,5 måneder, har refusjonssøker beregnet at det til enhver tid vil være ca 250 kandidater som kan være aktuelle for slik behandling. Hvor stor markedsandel fulvestra nt på sikt vil kunne etablere er vanskelig å forutsi. I dag er det 3 øvrige aktuelle legemidler som benyttes ved avansert brystkreft hos postmenopausale kvinner 1,3, det vil derfor være en viss konkurranse i markedet. Faslodex (fulvestrant) er i dag indisert ved behandling av postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastaserende brystkreft, eller ved tilbakefall og sykdomsprogresjon under eller etter adjuvant antiøstrogenbehandling. Dette innebærer at behandling med fulvestrant er godkjent som 2.linjebehandling av avansert/metastatisk brys t- kreft. Gitt Norsk Bryst Cancer Gruppes retningslinjer for endokrin behandling av avansert og metastatisk brystkr eft 1, og de tidligere nevnte data for forekomst av avansert brystkreft, er Legemiddelverket av den oppfatning at aktuelle kandidater for behandling med fulvestrant er reelt. 6.3 Klinisk dokumentasjon av fulvestrant Refusjonssøker bygger sin søknad på den kliniske dokumentasjonen for fulvestrant som ligger til grunn for markedsføringen av preparatet. Dette innebærer at effekten av fulvestrant er vist å være minst like effektiv som anastrozol i behandling av ava nsert brystkreft. Det er altså ikke dokumentert noen klinisk mer-effekt av fulvestrant, men at legemidlet kan representere en ny behandlingsmulighet for denne pasientgruppen. Da fulvestrant til nå ikke har vist kryssresistens med øvrige endokrine legemidle r som brukes ved behandling av brystkreft, kan fulvestrant være et behandlingsalternativ for brystkreftpasienter som er rammet av slik terapiresisens. Legemiddelverket er derfor av den oppfatning, gitt den kliniske dokumentasjonen, at
18 18/21 verdien av behandling med fulvestrant er begrenset til å representere et ekstra ledd i den eksisterende behandlingskjeden. Dosering med fulvestrant I den kliniske dokumentasjonen er effekten av fulvestrant kun vist ved månedlig injeksjon av 250 mg fulvestrant. Effekt av fulvestrant i lavere dosering er ikke vist. Firmaet er av EMEA oppfordret til å undersøke effekt og sikkerhet av fulvestrant i høyere dosering. Resultater fra disse studiene vil kunne ha betydning for kostnadseffektiviteten til fulvestrant, og dermed også refusjonsverdigheten til preparatet. Legemiddelverket ber derfor refusjonssøker om at slike opplysninger sendes inn så snart de er tilgjengelige. 6.4 Legemiddelverkets vurdering av den helseøkonomiske analysen Generelt oppfatter Legemiddelverket den helseøkonomiske analysen som fullstendig og ove r- siktlig, men tidvis litt lite transparent. Dette gjelder særlig i avsnittene der kosnadseffektiviteten av fulvestrant er vist, og i sensitivitetsanalysene. Det fremkommer tydelig hvilke kos t- nadsparametere som inngår, men ikke hvilke faktiske priser/satser som er benyttet. Legemiddelverket oppfordrer derfor refusjonssøker ved en senere anledning til å vise utregningene som ligger til grunn for resultatene som er presentert. Uklarheter ved refusjonssøknaden er på forespørsel av Legemiddelverket, oppklart av refusjonssøker. Det er utført en direkte sammenligning av fulvestrant versus anastrozol. Refusjonssøker har utført en kostnad-effekt analyse hvor resultatene indikerer at behandling med fulvestrant synes å gi en mer-effekt i form av at gjennomsnittspasienten får flere levemåneder og økt helserelatert livskvalitet. Analysens tidsperspektiv Tidsperspektivet i den helseøkonomiske analysen er 10 år, mens effektdataene analysen bygger på er vesentlig kortere. Median oppfø lgingstid totalt var 15,1 måneder og 22,1 måneder for respondere. Legemiddelverket mener man generelt bør utvise forsiktighet ved å ekstrapolere effektdataene utover det som er dokumentert, og at dette kan medføre at analyseresultatene blir mer usikre. Dersom tidsperspektivet likevel utvides vesentlig, bør det gjennomføres sensitivitesanalyser der tidsperspektivet endres. Refusjonssøker har ikke utført en slik sensitivitetsanalyse. Indirekte bruk av QALY Fulvestrants mer-effekt uttrykt i QALY er etter Legemiddelverkets oppfatning svært usikker. Begrunnelsen for dette er at helsetilstandsmålene (utilities) for de ulike tilstandene i brys t- kreftbehandlingen (stabil, responder, progrediert) er hentet fra en undersøkelse av livskvalitet blant pasienter behandlet for brystkreft 13, der det ikke var mulig å benytte ekte pasienter. Derfor ble 30 britiske kreftsykepleiere (uten brystkreft) brukt som respondere (proxy patients). Flere studier har vist at slike spesialsykepleiere er mer egnet som proxy patients enn annet helsepersonell, da de har et nært forhold til den aktuelle pasientgruppen. Likevel er det vist at resultatene fra proxy pasienter varierer med ekte pasienter i livskvalitetsstudier 19.
19 19/21 Refusjonssøker begrunner valget av studie med at de ikke kjenner til andre publiserte studier med slike data. Legemiddelverket er av den oppfatning at dersom slike indirekte data benyttes bør det gjennomføres en validering av dataenes overførbarhet. Effektdata ved 3.linjebehandling I den helseøkonomiske analysen er effektdata av 3.linjebehandling med endokrine legemidler hentet fra en retrospektiv analyse av 55 pasienter med avansert brystkreft 14. Slik Legemidde l- verket oppfatter det er disse dataene ikke fullstendig sammenlignbare med effektdataene til 2.linjebehandling 8, verken med hensyn på studiedesign, pasientpopulasjon (kun 60% var postmenopausale), alder eller hormonreseptorstatus. Dataene kan kanskje også betraktes som noe gamle da de ble innsamlet i perioden Da effektdataene som er benyttet ikke kan oppfattes som sammenlignbare kan dette ha påvirket analyseresultatet. Oppsummering Det er knyttet usikkerheter rundt kostnadseffektiviteten ved bruk av fulvestrant til behandling av avansert brystkreft. Dette skyldes blant annet en usikkerhet vedrørende en eventuell mereffekt av fulvestrant sammenlignet med andre legemidler til behandling av avansert brys t- kreft. Brystkreft er en alvorlig sykdom der behandlingsmulighetene for avansert sykdom i dag er begrenset. Behandling med fulvestrant kan representere et nytt behandlingstilbud for denne gruppen pasienter.
20 20/21 7 VEDTAK Statens legemiddelverk vedtar at fulvestrant (Faslodex) innvilges refusjon etter 9 punkt 9, bokstav a) for indikasjonen behandling av: Postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastaserende brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling, eller ved sykdomsprogresjon under behandling med antiøstrogen. Med følgende refusjonsvilkår: - Postmenopausale kvinner med østrogenreseptorpositiv lokalavansert eller metastasternede brystkreft, ved tilbakefall under eller etter adjuvant antiøstrogenbehandling, eller ved sykdomsprogresjon under behandling med antiøstrogen. - Behandling kan kun igangsettes av spesialist i onkologi, eller spesialist i generell kirurgi ved sykehus som behandler pasienter med brystkreft - Før behandling med Faslodex (fulvestrant) igangsettes skal progresjon av sykdom under eller etter annen endokrin adjuvant behandling dokumenteres. Vedtaket er betinget i den forstand at det kan revurderes og endres dersom det tilkommer nye forhold som endrer grunnlaget eller premissene for refusjonsvedtaket. Det stilles derfor krav om at senest 1 år etter at oppfølgingsstudier av effekt og sikkerhet av fulvestrant i høyere dosering er avsluttet, skal refusjonssøker sende inn en ny helseøkonomisk analyse av fulvestrant, jf legemiddelforskriften Statens legemiddelverk vil da foreta en revurdering av refusjonsstatus for fulvestrant (Faslodex). STATENS LEGEMIDDELVERK Erik Hviding seksjonssjef Kristin Svanqvist forsker
21 21/21 8 REFERANSER 1 Brystkreft diagnostikk og behandling. Blåboka. Norsk Bryst Cancer Gruppe oppdatert versjon Lønning PE. Aromatasehemmere i behandling av brystkreft. Tidskr Nor Lægeforen 2005;125: Astri Vilberg (red). Norsk legemiddelhåndbok for helsepersonell Abe O, Abe R, Enomoto K et al. Polychemotherapy for early breast cancer: an overview of the randomised trials. Lancet 1998; 352: Early Breast Cancer Trialist Group. Tamoxifen for early breast cancer. An overview of the randomised trials. Lancet 1998; 351: Summary of Product Characteristics (SPC) for Faslodex. 7 Wakeling AE, Dukes M, Bowler J. A potent specific pure anti-estrogen with clinical potential. Cancer Res 1991;51: Robertson JFR, Osborne CK, Howell A, Jones SE, Mauriac L, Ellis M et al. Fulvestrant versus Anastrozole for the Treatment of Advanced Breast Carcinoma in Postmenopausal Women. Cancer 2003; 98: European Public Assesment Report, Scientific Discussion of Faslodex. European Medicines Agency Nasjonalt folkehelseinstitutt, WHO Collaboratoring Center for Drug Statistics Methodology Salgstall hentet fra Farmastat, mai Rikstrygdeverket, personlig meddelelse mai Hutton J, Brown R, Borowitz M, Abrams K, Rothman M, Shakespeare A. A New Decision Model for Costutility Comparisons of Chemotherapy in Recurrent Metastatic Breast Cancer. Pharmacoeconomics 1996; 9: Suppl 2: Iveson TJ, Ahern J, Smith IE. Response to Third-line Endocrine Treatment for Advanced Breast Cancer. Eur J Cancer 1993; 29 A: Veiledning i samfunnsøkonomiske analyser. Statens forvaltningstjeneste, Finansdepartementet, Oslo Statens legemiddelverk. Norske retningslinjer for legemiddeløkonomisk analyse til bruk ved refusjonssøknader. Runskriv av De hyppigste kreftformer Kreftregisteret, Institutt for populasjonsbasert kreftforskning Rothman ML, Hedrick SC, Bulcroft KA et al. The validity of proxy-generated scores as measures of patients health status. Med Care 1991; 29:115
Refusjonsrapport Aromasin (eksemestan), adjuvant behandling av brystkreft
 Refusjonsrapport Aromasin (eksemestan), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Aromasin (eksemestan) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport Aromasin (eksemestan), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Aromasin (eksemestan) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft
 Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Femar (letrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning
Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Femar (letrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning
Refusjonsrapport Arimidex (anastrozol), adjuvant behandling av brystkreft
 Refusjonsrapport Arimidex (anastrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Arimidex (anastrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport Arimidex (anastrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Arimidex (anastrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft
 Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Femar (letrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning
Refusjonsrapport Femar (letrozol), adjuvant behandling av brystkreft 1 Oppsummering Formål: Å vurdere Femar (letrozol) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH
 Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere darifenacin (Emselex) for pliktmessig refusjon
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-10-31 200506318 LØ/LR/ABH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere darifenacin (Emselex) for pliktmessig refusjon
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: / Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 21.10.2013 13/15074-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 21.10.2013 13/15074-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler LØ/LR/ABH/THH
 Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-01-31 200410133 LØ/LR/ABH/THH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere solifenacin (Vesicare) for pliktmessig refusjon
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2005-01-31 200410133 LØ/LR/ABH/THH Refusjonsrapport 1. OPPSUMMERING Formål: Å vurdere solifenacin (Vesicare) for pliktmessig refusjon
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
17. NBCGs anbefalinger til standard endokrin og behandling av metastatisk brystkreft
 17. NBCGs anbefalinger til standard endokrin og behandling av metastatisk brystkreft Endokrin behandling Målet med systemisk behandling av metastatisk/avansert brystkreftsykdom er å hindre sykdomsprogresjon
17. NBCGs anbefalinger til standard endokrin og behandling av metastatisk brystkreft Endokrin behandling Målet med systemisk behandling av metastatisk/avansert brystkreftsykdom er å hindre sykdomsprogresjon
Refusjonsrapport preparat til behandling gastrointestinal stromal tumor
 Refusjonsrapport preparat til behandling gastrointestinal stromal tumor 1 OPPSUMMERING Formål: Å vurdere Sutent (sunitinib) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport preparat til behandling gastrointestinal stromal tumor 1 OPPSUMMERING Formål: Å vurdere Sutent (sunitinib) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad
Refusjonsrapport insulin glulisine (Apidra) til behandling av diabetes
 Refusjonsrapport insulin glulisine (Apidra) til behandling av diabetes 1 Oppsummering Formål: Å vurdere insulin glulisine (Apidra) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om
Refusjonsrapport insulin glulisine (Apidra) til behandling av diabetes 1 Oppsummering Formål: Å vurdere insulin glulisine (Apidra) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om
Behandlingsmålet er å senke øyetrykket tilstrekkelig til å unngå synsfeltskader eller progresjon av slike skader.
 Refusjonsrapport Azarga til behandling av glaukom 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for Azarga (brinzolamid og timolol) etter forskrift av 28. juni 2007 nr. 814 om stønad til dekning
Refusjonsrapport Azarga til behandling av glaukom 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for Azarga (brinzolamid og timolol) etter forskrift av 28. juni 2007 nr. 814 om stønad til dekning
Refusjonsrapport. Vurdering av søknad om forhåndsgodkjent refusjon 2. 11-11-2013 Statens legemiddelverk
 Refusjonsrapport aflibercept (Eylea) til behandling av aldersrelatert våt makula-degenerasjon (våt AMD). Vurdering av søknad om forhåndsgodkjent refusjon 2 11-11-2013 Statens legemiddelverk Brev stiles
Refusjonsrapport aflibercept (Eylea) til behandling av aldersrelatert våt makula-degenerasjon (våt AMD). Vurdering av søknad om forhåndsgodkjent refusjon 2 11-11-2013 Statens legemiddelverk Brev stiles
Ashkan Kourdalipour, Jørgensen Kristian Samdal
 Zambon Zambon S.p.A., Italia Repr. Nigaard Pharma Storg. 8 B Postboks 373 2001 Lillestrøm Deres referanse Vår dato Vår referanse Seksjon/saksutredere LØ/LR/ Christina Kuljis/ Eivind 09/06/2016 15/16242
Zambon Zambon S.p.A., Italia Repr. Nigaard Pharma Storg. 8 B Postboks 373 2001 Lillestrøm Deres referanse Vår dato Vår referanse Seksjon/saksutredere LØ/LR/ Christina Kuljis/ Eivind 09/06/2016 15/16242
Kurs i legemiddeløkonomi 20. mai 2015
 Kurs i legemiddeløkonomi 20. mai 2015 Erik Sagdahl erik.sagdahl@legemiddelverket.no Morten Aaserud morten.aaserud@legemiddelverket.no Legemidler. Finansiering/betaling Blåresept Sykehus Forhåndsgodkjent
Kurs i legemiddeløkonomi 20. mai 2015 Erik Sagdahl erik.sagdahl@legemiddelverket.no Morten Aaserud morten.aaserud@legemiddelverket.no Legemidler. Finansiering/betaling Blåresept Sykehus Forhåndsgodkjent
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar Andreassen
 Alcon Nordic A/S Edvard Thomsens Vej 14 2300 København S Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar REFUSJONSVEDTAK
Alcon Nordic A/S Edvard Thomsens Vej 14 2300 København S Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Mikkel Bo Johansen 17.09.2014 14/08565-6 Seksjon for legemiddelrefusjon/ Einar REFUSJONSVEDTAK
Kort vurdering. Vurdering av innsendt dokumentasjon Statens legemiddelverk
 Kort vurdering ID-nr 2015_019: Bruk av bevacizumab (Avastin) ved avansert livmorhalskreft og ved tilbakefall av livmorhalskreft». Vurdering av innsendt dokumentasjon 29-08-2016 Statens legemiddelverk Brev
Kort vurdering ID-nr 2015_019: Bruk av bevacizumab (Avastin) ved avansert livmorhalskreft og ved tilbakefall av livmorhalskreft». Vurdering av innsendt dokumentasjon 29-08-2016 Statens legemiddelverk Brev
Denosumab (Xgeva) til forebygging av skjelettrelaterte. voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse
 Denosumab () til forebygging av skjelettrelaterte hendelser hos voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse 01-10-2014 Statens legemiddelverk 1 Innhold
Denosumab () til forebygging av skjelettrelaterte hendelser hos voksne med benmetastaser fra solide tumorer. Oppdatering av tidligere helseøkonomisk analyse 01-10-2014 Statens legemiddelverk 1 Innhold
Refusjonsrapport Xeloda til behandling av lokalavansert eller metastaserende brystkreft
 Refusjonsrapport Xeloda til behandling av lokalavansert eller metastaserende brystkreft OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for kapecitabine (Xeloda) etter forskrift av 28. juni 2007
Refusjonsrapport Xeloda til behandling av lokalavansert eller metastaserende brystkreft OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for kapecitabine (Xeloda) etter forskrift av 28. juni 2007
Bruk av forløpsdata i legemiddeløkonomiske analyser. Gyldig fra 13-04-2015 Statens legemiddelverk
 Notat Bruk av forløpsdata i legemiddeløkonomiske analyser Gyldig fra 13-04-2015 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst oppgi vår referanse. Statens legemiddelverk Telefon
Notat Bruk av forløpsdata i legemiddeløkonomiske analyser Gyldig fra 13-04-2015 Statens legemiddelverk Brev stiles til Statens legemiddelverk. Vennligst oppgi vår referanse. Statens legemiddelverk Telefon
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina Kvalheim
 NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina REFUSJONSVEDTAK Vi viser til Deres søknad
NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 12.03.2014 13/14033-6 Seksjon for legemiddelrefusjon/ Christina REFUSJONSVEDTAK Vi viser til Deres søknad
Forslag til nasjonal metodevurdering
 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig informasjon for utfylling av skjemaet
Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig informasjon for utfylling av skjemaet
Refusjonsrapport. Vurdering av søknad om forhåndsgodkjent refusjon 2. 12-12-2014 Statens legemiddelverk
 Refusjonsrapport Afinitor (Everolimus) til behandling av avansert hormonreseptorpositiv og HER2/neu-negativ brystkreft i kombinasjon med eksemestan. Vurdering av søknad om forhåndsgodkjent refusjon 2 12-12-2014
Refusjonsrapport Afinitor (Everolimus) til behandling av avansert hormonreseptorpositiv og HER2/neu-negativ brystkreft i kombinasjon med eksemestan. Vurdering av søknad om forhåndsgodkjent refusjon 2 12-12-2014
Vedlegg til vignette 58/11-2 Innføring av nye kreftlegemidler
 Stein Kaasa på vegne av arbeidsgruppen for utarbeidelse av nasjonale retningslinjer for behandling av sarkom Sykdom Bløtvevssarkom 1 Antall pasienter Usikre tall, mellom 160 og 300 diagnostiseres årlig
Stein Kaasa på vegne av arbeidsgruppen for utarbeidelse av nasjonale retningslinjer for behandling av sarkom Sykdom Bløtvevssarkom 1 Antall pasienter Usikre tall, mellom 160 og 300 diagnostiseres årlig
OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED IKKE-SMÅCELLET LUNGEKREFT AV TYPEN PLATEEPITELKARSINOM SOM IKKE UTTRYKKER PD-L1
 Helsedirektoratet Postboks 7000 St. Olavsplass 0130 OSLO Sekretariatet for nye metoder Deres ref.: Dato: Vår ref.: Saksbehandler: 23.11.2017 17/15899-1 BSt CH OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED
Helsedirektoratet Postboks 7000 St. Olavsplass 0130 OSLO Sekretariatet for nye metoder Deres ref.: Dato: Vår ref.: Saksbehandler: 23.11.2017 17/15899-1 BSt CH OPPDATERT NOTAT NIVOLUMAB TIL PASIENTER MED
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss / Seksjon for legemiddelomsetning/ Leung Ming Yu
 NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 26.10.2015 15/1182-4 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser
NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 26.10.2015 15/1182-4 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser
NOVARTIS NORGE AS Postboks 4284 Nydalen 0401 Oslo Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Petter Foss 30.04.2014 13/13693-3 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: / Seksjon for legemiddelomsetning/ Leung Ming Yu
 Wickstrøm & Langkilde ApS Hjulmagervej 4A DK-7100 Velje Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.01.2016 15/14643-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser til
Wickstrøm & Langkilde ApS Hjulmagervej 4A DK-7100 Velje Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.01.2016 15/14643-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK Vi viser til
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Carl Samuelsen / Seksjon for legemiddelomsetning/ Leung Ming Yu
 BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Carl Samuelsen 26.10.2015 15/10613-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK
BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Carl Samuelsen 26.10.2015 15/10613-5 Seksjon for legemiddelomsetning/ Leung Ming REFUSJONSVEDTAK
Metodevurdering for lungekreft og PD1-hemmere. Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi
 Metodevurdering for lungekreft og PD1-hemmere Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi Hva er hurtig metodevurderinger? Dette er en systematisk måte å
Metodevurdering for lungekreft og PD1-hemmere Kristin Svanqvist Seksjonssjef, refusjon og metodevurdering Avdeling for legemiddeløkonomi Hva er hurtig metodevurderinger? Dette er en systematisk måte å
Refusjonsrapport - 1 Oppsummering
 Refusjonsrapport - 1 Oppsummering Formål: Å vurdere preparat for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning av utgifter til viktige legemidler og spesielt medisinsk
Refusjonsrapport - 1 Oppsummering Formål: Å vurdere preparat for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning av utgifter til viktige legemidler og spesielt medisinsk
Oppdatering av hurtig metodevurdering
 Oppdatering av hurtig metodevurdering Bestilling ID2017_012 Nivolumab (Opdivo) til andrelinjebehandling av avansert nyrecellekarsinom Vurdering av oppdatert dokumentasjon av overlevelsesdata og helseøkonomiske
Oppdatering av hurtig metodevurdering Bestilling ID2017_012 Nivolumab (Opdivo) til andrelinjebehandling av avansert nyrecellekarsinom Vurdering av oppdatert dokumentasjon av overlevelsesdata og helseøkonomiske
Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler Carl Samuelsen /10249 LØ/LR/Leung Ming Yu
 Boehringer Ingelheim Norway KS Postboks 405 1373 Asker Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2015-07-16 Carl Samuelsen 2015-09-28 15/10249 LØ/LR/Leung Ming Yu REFUSJONSVEDTAK
Boehringer Ingelheim Norway KS Postboks 405 1373 Asker Deres dato Deres referanse Vår dato Vår referanse Seksjon/saksbehandler 2015-07-16 Carl Samuelsen 2015-09-28 15/10249 LØ/LR/Leung Ming Yu REFUSJONSVEDTAK
Introduksjon av nye legemidler i spesialisthelsetjenesten
 Introduksjon av nye legemidler i spesialisthelsetjenesten Gardermoen 10.mars 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Statens legemiddelverk Innhold i presentasjonen Tilgang til
Introduksjon av nye legemidler i spesialisthelsetjenesten Gardermoen 10.mars 2016 Kristin Svanqvist Seksjonssjef, Metodevurdering og refusjon Statens legemiddelverk Innhold i presentasjonen Tilgang til
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert / Seksjon for legemiddelrefusjon/ Helle Endresen
 Chiesi pharma AB Box 63 S-182 11 Danderyd Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert 16.10.2014 14/10880-5 Seksjon for legemiddelrefusjon/ Helle Endresen REFUSJONSVEDTAK Vi viser til
Chiesi pharma AB Box 63 S-182 11 Danderyd Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Eva Callert 16.10.2014 14/10880-5 Seksjon for legemiddelrefusjon/ Helle Endresen REFUSJONSVEDTAK Vi viser til
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: / Seksjon for legemiddelrefusjon/ Erik Sagdal
 Astellas Pharma A/S Kajakvej 2 DK-2770 Kastrup Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.04.2013 12/13664-5 Seksjon for legemiddelrefusjon/ Erik Sagdal REFUSJONSVEDTAK Vi viser til Deres søknad
Astellas Pharma A/S Kajakvej 2 DK-2770 Kastrup Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 26.04.2013 12/13664-5 Seksjon for legemiddelrefusjon/ Erik Sagdal REFUSJONSVEDTAK Vi viser til Deres søknad
Hurtig metodevurdering
 Hurtig metodevurdering Faslodex (fulvestrant) til behandling av endokrinnaive, postmenopausale kvinner med østrogenreseptorpositiv, lokalavansert eller metastatisk brystkreft Vurdering av søknad om forhåndsgodkjent
Hurtig metodevurdering Faslodex (fulvestrant) til behandling av endokrinnaive, postmenopausale kvinner med østrogenreseptorpositiv, lokalavansert eller metastatisk brystkreft Vurdering av søknad om forhåndsgodkjent
NORSK LOVTIDEND Avd. I Lover og sentrale forskrifter mv. Utgitt i henhold til lov 19. juni 1969 nr. 53.
 NORSK LOVTIDEND Avd. I Lover og sentrale forskrifter mv. Utgitt i henhold til lov 19. juni 1969 nr. 53. Kunngjort 19. september 2017 kl. 16.10 PDF-versjon 22. september 2017 15.09.2017 nr. 1408 Forskrift
NORSK LOVTIDEND Avd. I Lover og sentrale forskrifter mv. Utgitt i henhold til lov 19. juni 1969 nr. 53. Kunngjort 19. september 2017 kl. 16.10 PDF-versjon 22. september 2017 15.09.2017 nr. 1408 Forskrift
Plan. Innledning Prioriteringskriterier - hvorfor kostnadseffektivitet Hvordan måles og verdsettes kostnadseffektivitet, herunder
 Plan Innledning Prioriteringskriterier - hvorfor kostnadseffektivitet Hvordan måles og verdsettes kostnadseffektivitet, herunder ICER dvs merkostnad per mereffekt Effekt QALYs, kvalitetsjusterte leveår
Plan Innledning Prioriteringskriterier - hvorfor kostnadseffektivitet Hvordan måles og verdsettes kostnadseffektivitet, herunder ICER dvs merkostnad per mereffekt Effekt QALYs, kvalitetsjusterte leveår
Brystkreft. Informasjon fra Kreftforeningen
 Brystkreft Informasjon fra Kreftforeningen Hensikten med dette faktaarket er å gi en kortfattet, generell informasjon til pasienter, pårørende og andre som er berørte av brystkreft. De det gjelder vil
Brystkreft Informasjon fra Kreftforeningen Hensikten med dette faktaarket er å gi en kortfattet, generell informasjon til pasienter, pårørende og andre som er berørte av brystkreft. De det gjelder vil
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
REFUSJONSVEDTAK FOR JANUVIA I STYRKENE 25 OG 50 MG
 MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 08-08-2013 12/07838-18 Seksjon for legemiddelrefusjon/ REFUSJONSVEDTAK FOR JANUVIA I STYRKENE 25 OG
MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 08-08-2013 12/07838-18 Seksjon for legemiddelrefusjon/ REFUSJONSVEDTAK FOR JANUVIA I STYRKENE 25 OG
Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3 511.1 Seksjon for legemiddelrefusjon/ Enrique Ji~ez
 Statens legemiddelverk Norwegian Medicines Agency Novartis Norge AS Postboks 237 Økern 0510 OSLO Norge DAGSPOST Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3
Statens legemiddelverk Norwegian Medicines Agency Novartis Norge AS Postboks 237 Økern 0510 OSLO Norge DAGSPOST Deres ref. Dato Vår ref. Arkivkode Seksjon/Saksbehandler Petter Foss 15-02-2011 11/01145-3
RAPPORT FRA UANMELDT TILSYN DER JARDIANCE VAR TEMA. Hovedformålet med tilsyn er at vi ønsker å bidra til å sikre:
 BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 05.11.2015 15/13231-11 Legemiddelinformasjon Stab/ Christel Nyhus Bø RAPPORT FRA UANMELDT TILSYN
BOEHRINGER INGELHEIM NORWAY KS Postboks 405 1373 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 05.11.2015 15/13231-11 Legemiddelinformasjon Stab/ Christel Nyhus Bø RAPPORT FRA UANMELDT TILSYN
181: Behandling skal kun startes av spesialist i indremedisin, barnesykdommer eller ved sykehusavdeling med tilsvarende spesialitet
 Novo Nordisk Scandinavia AS Baker Østbys vei 5Postboks 24 1309 RUD Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 29.01.2016 15/16181-3 Seksjon for legemiddelrefusjon/ Pilar martin Vivaldi/ Anne
Novo Nordisk Scandinavia AS Baker Østbys vei 5Postboks 24 1309 RUD Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 29.01.2016 15/16181-3 Seksjon for legemiddelrefusjon/ Pilar martin Vivaldi/ Anne
Kapittel 14. Forhåndsgodkjent refusjon etter folketrygdloven 5-14
 Page 1 of 10 Forskrift om legemidler (legemiddelforskriften) Kapittel 14. Forhåndsgodkjent refusjon etter folketrygdloven 5-14 14-1. Søknad om forhåndsgodkjent refusjon Søknad om godkjenning av legemiddel
Page 1 of 10 Forskrift om legemidler (legemiddelforskriften) Kapittel 14. Forhåndsgodkjent refusjon etter folketrygdloven 5-14 14-1. Søknad om forhåndsgodkjent refusjon Søknad om godkjenning av legemiddel
Refusjon er søkt med følgende informasjon: Refusjonskode C22: Ondartet svulst i lever og intrahepatiske galleganger
 Refusjonsrapport Nexavar til behandling av leverkreft Etter avslaget på refusjonssøknaden har Bayer og Legemiddelverket vært i diskusjon rundt enkelte forhold i refusjonsrapporten. Dette hadde ingen konsekvenser
Refusjonsrapport Nexavar til behandling av leverkreft Etter avslaget på refusjonssøknaden har Bayer og Legemiddelverket vært i diskusjon rundt enkelte forhold i refusjonsrapporten. Dette hadde ingen konsekvenser
Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler
 Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi Eventuelle interessekonflikter Ansatt ved Statens
Metodevurderinger til hjelp for prioriteringer - erfaringer fra vurdering av kreftlegemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi Eventuelle interessekonflikter Ansatt ved Statens
Erfaringer med blåreseptordningen Elisabeth Bryn Avdelingsdirektør Avdeling for legemiddeløkonomi
 Erfaringer med blåreseptordningen Elisabeth Bryn Avdelingsdirektør Avdeling for legemiddeløkonomi 10.06.2013 Plan 1. Innledning 2. Blåreseptordningen 3. Erfaringer og eksempler 4. Konklusjon Legemiddelpolitiske
Erfaringer med blåreseptordningen Elisabeth Bryn Avdelingsdirektør Avdeling for legemiddeløkonomi 10.06.2013 Plan 1. Innledning 2. Blåreseptordningen 3. Erfaringer og eksempler 4. Konklusjon Legemiddelpolitiske
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Bakgrunnsstoff om lungekreft og Iressa til pressen på forespørsel
 Utl fakta Bakgrunnsstoff om lungekreft og Iressa til pressen på forespørsel Lungekreft er en av våre vanligste kreftformer, og er den kreftsykdommen som dreper flest mennesker i Norge. I løpet av dette
Utl fakta Bakgrunnsstoff om lungekreft og Iressa til pressen på forespørsel Lungekreft er en av våre vanligste kreftformer, og er den kreftsykdommen som dreper flest mennesker i Norge. I løpet av dette
Innføring av nye kreftlegemidler Et likeverdig tilbud i Norge
 Innføring av nye kreftlegemidler Et likeverdig tilbud i Norge Stein Kaasa, prosjektdirektør Kjell M Tveit,avdelingsleder OUS Figur 1. Antall krefttilfeller i Norge, 2000-2009. Med kreftregisterets fremskrivning
Innføring av nye kreftlegemidler Et likeverdig tilbud i Norge Stein Kaasa, prosjektdirektør Kjell M Tveit,avdelingsleder OUS Figur 1. Antall krefttilfeller i Norge, 2000-2009. Med kreftregisterets fremskrivning
Brystkreft: hyppigheten øker men dødeligheten går ned hvorfor? Lars Vatten, dr med Professor i epidemiologi. Det medisinske fakultet NTNU, Trondheim
 Brystkreft: hyppigheten øker men dødeligheten går ned hvorfor? Lars Vatten, dr med Professor i epidemiologi Det medisinske fakultet NTNU, Trondheim 1 Dødelighetskurven for brystkreft viste en svakt økende
Brystkreft: hyppigheten øker men dødeligheten går ned hvorfor? Lars Vatten, dr med Professor i epidemiologi Det medisinske fakultet NTNU, Trondheim 1 Dødelighetskurven for brystkreft viste en svakt økende
Brystkreft. Informasjon fra Kreftforeningen
 Brystkreft Informasjon fra Kreftforeningen Hensikten med dette faktaarket er å gi en kortfattet, generell informasjon til pasienter, pårørende og andre som er berørte av brystkreft. De det gjelder vil
Brystkreft Informasjon fra Kreftforeningen Hensikten med dette faktaarket er å gi en kortfattet, generell informasjon til pasienter, pårørende og andre som er berørte av brystkreft. De det gjelder vil
Om persontilpasset medisin
 Om persontilpasset medisin Giske Ursin Kreftregisteret Eldre legers forenings høstmøte, Soria Moria Hotell, 4. nov 2018 Hva er persontilpasset medisin? «... forebygging, diagnostikk, behandling og oppfølging
Om persontilpasset medisin Giske Ursin Kreftregisteret Eldre legers forenings høstmøte, Soria Moria Hotell, 4. nov 2018 Hva er persontilpasset medisin? «... forebygging, diagnostikk, behandling og oppfølging
SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft
 SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft Hvordan virker SUTENT for pasienter som er eldre sammenlignet med yngre pasienter? Hvordan optimalisere doseringen med Sutent?
SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft Hvordan virker SUTENT for pasienter som er eldre sammenlignet med yngre pasienter? Hvordan optimalisere doseringen med Sutent?
Onkologisk Forum, Espen Movik, forsker
 Onkologisk Forum, 19.11.09 Metylnaltrekson Kunnskapsesenterets ved obstipasjon hos palliative nye PPT-mal pasienter Espen Movik, forsker Om rapporten Kunnskapssenterets rapport publisert i oktober 09.
Onkologisk Forum, 19.11.09 Metylnaltrekson Kunnskapsesenterets ved obstipasjon hos palliative nye PPT-mal pasienter Espen Movik, forsker Om rapporten Kunnskapssenterets rapport publisert i oktober 09.
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
200700549-6 LØ/LR/KHS 2007-02-26 side 3/5
 Referat fra møte i Blåreseptnemnda 31.januar 2007 Tilstede fra Blåreseptnemnda: Kristian Hagestad (leder), Anne Elise Eggen, Hans Arne Melleby, Eline Aas, Trine Bjørner, Sigurd Hortemo, Bjarne Robberstad
Referat fra møte i Blåreseptnemnda 31.januar 2007 Tilstede fra Blåreseptnemnda: Kristian Hagestad (leder), Anne Elise Eggen, Hans Arne Melleby, Eline Aas, Trine Bjørner, Sigurd Hortemo, Bjarne Robberstad
11.05.2012. Mammografiscreening med fokus på Norge. Kreftscreening. Grunnlag for screening i en befolkningen. Mammografi screening
 Kreftscreening Mammografiscreening med fokus på Norge Mette Kalager Lege og postdoc Tidlig deteksjon Prevensjon Blanding av de to 3 Grunnlag for screening i en befolkningen Vanlig sykdom Høy dødelighet
Kreftscreening Mammografiscreening med fokus på Norge Mette Kalager Lege og postdoc Tidlig deteksjon Prevensjon Blanding av de to 3 Grunnlag for screening i en befolkningen Vanlig sykdom Høy dødelighet
Endringer i refusjonslisten 15. november og 1. desember 2015
 Endringer i refusjonslisten 15. november og 1. desember 2015 1. Nye virkestoff A06AH03_1 Naloksegol Refusjonsberettiget bruk: Behandling av opioidindusert forstoppelse hos voksne pasienter når respons
Endringer i refusjonslisten 15. november og 1. desember 2015 1. Nye virkestoff A06AH03_1 Naloksegol Refusjonsberettiget bruk: Behandling av opioidindusert forstoppelse hos voksne pasienter når respons
Blåreseptordningen. Arne Helland Overlege/universitetslektor Reseptkurs stadium IIIA/B 2016
 Blåreseptordningen Arne Helland Overlege/universitetslektor Reseptkurs stadium IIIA/B 2016 1 Hvorfor blåreseptordningen? Sosial trygghet og likhet alle skal ha tilgang til viktige legemidler og medisinsk
Blåreseptordningen Arne Helland Overlege/universitetslektor Reseptkurs stadium IIIA/B 2016 1 Hvorfor blåreseptordningen? Sosial trygghet og likhet alle skal ha tilgang til viktige legemidler og medisinsk
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Deres ref.: Dato: Vår ref.: Saksbehandler: / Christina Sivertsen
 MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Saksbehandler: 01.06.2018 18/04022-3 Christina Sivertsen REFUSJONSVEDTAK Statens legemiddelverk viser til deres dokumentasjon
MSD (NORGE) AS Postboks 458 Brakerøya 3002 Drammen Deres ref.: Dato: Vår ref.: Saksbehandler: 01.06.2018 18/04022-3 Christina Sivertsen REFUSJONSVEDTAK Statens legemiddelverk viser til deres dokumentasjon
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Hurtig metodevurdering
 Hurtig metodevurdering Ibrance (palbociklib) til behandling av HR+/HER2 negativ lokalavansert/ metastatisk brystkreft Del 1: i kombinasjon med en aromatasehemmer Del 2: i kombinasjon med fulvestrant hos
Hurtig metodevurdering Ibrance (palbociklib) til behandling av HR+/HER2 negativ lokalavansert/ metastatisk brystkreft Del 1: i kombinasjon med en aromatasehemmer Del 2: i kombinasjon med fulvestrant hos
Brystkreft Diagnose Behandling Kontroller
 Brystkreft Diagnose Behandling Kontroller SØ-9110 Innhold 3 4 5-7 8-9 10-11 12-13 14 15 16 Forord Brystkreftsykdommen Behandlingsformer Mulige komplikasjoner etter operasjonen Oppfølging etter operasjonen
Brystkreft Diagnose Behandling Kontroller SØ-9110 Innhold 3 4 5-7 8-9 10-11 12-13 14 15 16 Forord Brystkreftsykdommen Behandlingsformer Mulige komplikasjoner etter operasjonen Oppfølging etter operasjonen
Refusjonsrapport. Vurdering av søknad om fortsatt forhåndsgodkjent refusjon Statens legemiddelverk
 Refusjonsrapport Sutent (sunitinib) til behandling av avansert og/ eller metastatisk nyrecellekarsinom. Vurdering av søknad om fortsatt forhåndsgodkjent refusjon 2 21-03-2011 Statens legemiddelverk Brev
Refusjonsrapport Sutent (sunitinib) til behandling av avansert og/ eller metastatisk nyrecellekarsinom. Vurdering av søknad om fortsatt forhåndsgodkjent refusjon 2 21-03-2011 Statens legemiddelverk Brev
Forslag om nasjonal metodevurdering
 Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag om nasjonal metodevurdering Viktig informasjon se på dette først! Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
LEGEMIDDELINDUSTRIENS SYN PÅ HELSEØKONOMI
 LEGEMIDDELINDUSTRIENS SYN PÅ HELSEØKONOMI Petter Foss, Leder av helseøkonomiske utvalg i LMI og Head of Market Access Oncology, Norvatis Oslo, 3 mai 2016 Interesse(konflikter) & Disclaimer Leder for LMI
LEGEMIDDELINDUSTRIENS SYN PÅ HELSEØKONOMI Petter Foss, Leder av helseøkonomiske utvalg i LMI og Head of Market Access Oncology, Norvatis Oslo, 3 mai 2016 Interesse(konflikter) & Disclaimer Leder for LMI
Hurtig metodevurdering
 Hurtig metodevurdering Enzalutamid (Xtandi) til 2. linjebehandling av metastaserende kastrasjonsresistent prostatakreft (mcrpc) 25-04-2014 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Hurtig metodevurdering Enzalutamid (Xtandi) til 2. linjebehandling av metastaserende kastrasjonsresistent prostatakreft (mcrpc) 25-04-2014 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 25.03.2015 14/12582-5 Seksjon for legemiddelrefusjon/ Kirsti Hjelme
 Amgen AB Norge, NUF Postboks 1532 Vika 0117 OSLO Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 25.03.2015 14/12582-5 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
Amgen AB Norge, NUF Postboks 1532 Vika 0117 OSLO Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 25.03.2015 14/12582-5 Seksjon for legemiddelrefusjon/ Kirsti Hjelme REFUSJONSVEDTAK Vi viser til Deres
Refusjon av legemidler i Norge
 Refusjon av legemidler i Norge Seniorrådgiver Morten Aaserud Statens legemiddelverk Møte i Norsk Biotekforum 22.september 2011 Plan del 1 Folketrygdens refusjon av legemidler målsetting og system Vurdering
Refusjon av legemidler i Norge Seniorrådgiver Morten Aaserud Statens legemiddelverk Møte i Norsk Biotekforum 22.september 2011 Plan del 1 Folketrygdens refusjon av legemidler målsetting og system Vurdering
Hurtig metodevurdering
 Hurtig metodevurdering Kisqali (ribociclib) til behandling av metastatisk brystkreft. Vurdering av innsendt dokumentasjon 11-12-2017 Statens legemiddelverk 2017-05433 LØ/LR/ 11-12-2017 side 2/65 FORORD
Hurtig metodevurdering Kisqali (ribociclib) til behandling av metastatisk brystkreft. Vurdering av innsendt dokumentasjon 11-12-2017 Statens legemiddelverk 2017-05433 LØ/LR/ 11-12-2017 side 2/65 FORORD
Kolesterolsenkende behandling en oppdatering
 Kolesterolsenkende behandling en oppdatering Steinar Madsen medisinsk fagdirektør og avtalespesialist Helse Sør-Øst Legemiddelkostnader i Norge Milliarder NOK 30,0 25,0 Nye legemidler, nye behandlingsmuligheter
Kolesterolsenkende behandling en oppdatering Steinar Madsen medisinsk fagdirektør og avtalespesialist Helse Sør-Øst Legemiddelkostnader i Norge Milliarder NOK 30,0 25,0 Nye legemidler, nye behandlingsmuligheter
Refusjonsrapport preparat til behandling av avansert og/eller metastatisk nyrecellekarsinom (MRCC)
 Refusjonsrapport preparat til behandling av avansert og/eller metastatisk nyrecellekarsinom (MRCC) 1 OPPSUMMERING Formål: Å vurdere sunitinib (Sutent) for pliktmessig refusjon etter forskrift av 18. april
Refusjonsrapport preparat til behandling av avansert og/eller metastatisk nyrecellekarsinom (MRCC) 1 OPPSUMMERING Formål: Å vurdere sunitinib (Sutent) for pliktmessig refusjon etter forskrift av 18. april
Refusjonsrapport Eslikarbazepinacetat (Zebinix) til tilleggsbehandling av partiell epilepsi med eller uten sekundær generalisering
 Refusjonsrapport Eslikarbazepinacetat (Zebinix) til tilleggsbehandling av partiell epilepsi med eller uten sekundær generalisering 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for eslikarbazepinacetat
Refusjonsrapport Eslikarbazepinacetat (Zebinix) til tilleggsbehandling av partiell epilepsi med eller uten sekundær generalisering 1 OPPSUMMERING Formål: Å vurdere forhåndsgodkjent refusjon for eslikarbazepinacetat
Offentlig finansiering av legemidler i Norge. Kristin Svanqvist Enhetsleder Metodevurdering og refusjon
 Offentlig finansiering av legemidler i Norge Kristin Svanqvist Enhetsleder Metodevurdering og refusjon Godkjenning av legemidler hva er hva? Markedsføringstillatelse Europeisk tillatelse for å markedsføre
Offentlig finansiering av legemidler i Norge Kristin Svanqvist Enhetsleder Metodevurdering og refusjon Godkjenning av legemidler hva er hva? Markedsføringstillatelse Europeisk tillatelse for å markedsføre
Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 24.04.2014 14/00932-4 Seksjon for legemiddelrefusjon/ Helle Endresen/ Pilar Martin Vivaldi
 TAKEDA NYCOMED AS Postboks 205 1372 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 24.04.2014 14/00932-4 Seksjon for legemiddelrefusjon/ Helle Endresen/ Pilar Martin Vivaldi REFUSJONSVEDTAK Vi
TAKEDA NYCOMED AS Postboks 205 1372 Asker Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: 24.04.2014 14/00932-4 Seksjon for legemiddelrefusjon/ Helle Endresen/ Pilar Martin Vivaldi REFUSJONSVEDTAK Vi
Prioriteringsdebatten i Norge utvikling og sentrale spørsmål
 U N I V E R S I T Y O F B E R G E N Prioriteringsdebatten i Norge utvikling og sentrale spørsmål Bjarne Robberstad Atorvastatin 40 mg (AUP): Kr 149.40 39 % Pasient 61 % Folketrygd Zopiclone 7,5 mg (AUP):
U N I V E R S I T Y O F B E R G E N Prioriteringsdebatten i Norge utvikling og sentrale spørsmål Bjarne Robberstad Atorvastatin 40 mg (AUP): Kr 149.40 39 % Pasient 61 % Folketrygd Zopiclone 7,5 mg (AUP):
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Refusjonsrapport preparat til behandling av avansert nyrecellekreft
 Refusjonsrapport preparat til behandling av avansert nyrecellekreft 1 Oppsummering Formål: Å vurdere sorafenib (Nexavar) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til
Refusjonsrapport preparat til behandling av avansert nyrecellekreft 1 Oppsummering Formål: Å vurdere sorafenib (Nexavar) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til
Refusjonsinformasjonen skal fremkomme tydelig i alt markedsføringsmateriell.
 Takeda Nycomed AS Postboks 205 1372 ASKER Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Fredrik Arneberg 20.03.2015 14/12506-7 Seksjon for legemiddelrefusjon/ Kristian Samdal/Pilar Martin Vivaldi
Takeda Nycomed AS Postboks 205 1372 ASKER Norge Deres ref.: Dato: Vår ref.: Seksjon/saksbehandler: Fredrik Arneberg 20.03.2015 14/12506-7 Seksjon for legemiddelrefusjon/ Kristian Samdal/Pilar Martin Vivaldi
Status metodevurderinger i Legemiddelverket. LIS-seminar onkologi 2018 Kristin Svanqvist Metodevurdering og refusjon
 Status metodevurderinger i Legemiddelverket LIS-seminar onkologi 2018 Kristin Svanqvist Metodevurdering og refusjon Hva jeg skal snakke om Introduksjon til metodevurdering Metodevarsler status Metodevurderinger
Status metodevurderinger i Legemiddelverket LIS-seminar onkologi 2018 Kristin Svanqvist Metodevurdering og refusjon Hva jeg skal snakke om Introduksjon til metodevurdering Metodevarsler status Metodevurderinger
Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging?
 Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging? Notat fra en tverretatlig arbeidsgruppe 1 31.01.2019 1 Bestående
Beregning av absolutt prognosetap i hurtig metodevurderinger av legemidler bruke beregningsprinsippet for behandling eller forebygging? Notat fra en tverretatlig arbeidsgruppe 1 31.01.2019 1 Bestående
Utviklingstrekk og prioriteringsutfordringer på kreftområdet. Cecilie Daae, divisjonsdirektør, Helsedirektoratet
 Utviklingstrekk og prioriteringsutfordringer på kreftområdet Cecilie Daae, divisjonsdirektør, Helsedirektoratet Interessekonflikter.. Ansvar for kreftstrategiområdet i Helsedirektoratet Medlem i Nasjonalt
Utviklingstrekk og prioriteringsutfordringer på kreftområdet Cecilie Daae, divisjonsdirektør, Helsedirektoratet Interessekonflikter.. Ansvar for kreftstrategiområdet i Helsedirektoratet Medlem i Nasjonalt
HØRINGSNOTAT. Endringer i blåreseptforskriften stønad til legemidler for behandling av hepatitt C
 Helse- og omsorgsdepartementet HØRINGSNOTAT Endringer i blåreseptforskriften stønad til legemidler for behandling av hepatitt C April 2015 1. Høringsnotatets hovedinnhold Helse- og omsorgsdepartementet
Helse- og omsorgsdepartementet HØRINGSNOTAT Endringer i blåreseptforskriften stønad til legemidler for behandling av hepatitt C April 2015 1. Høringsnotatets hovedinnhold Helse- og omsorgsdepartementet
Disposisjon. Demografi og epidemologi. Kreftomsorg. Økningen i antall nye krefttilfeller
 Disposisjon Kreftomsorg og lindrende behandling: Hva kjennetegner fagfeltet og hva kjennetegner den palliative pasienten? Introduksjonskurs 04.09.2018 Ann-Kristin Øren Kompetansesenter i lindrande behandling
Disposisjon Kreftomsorg og lindrende behandling: Hva kjennetegner fagfeltet og hva kjennetegner den palliative pasienten? Introduksjonskurs 04.09.2018 Ann-Kristin Øren Kompetansesenter i lindrande behandling
SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft
 SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft Hvordan virker SUTENT for pasienter som er eldre sammenlignet med yngre pasienter? Hvordan optimalisere doseringen med Sutent?
SUTENT (sunitinib) til behandling for dine pasienter med metastatisk nyrekreft Hvordan virker SUTENT for pasienter som er eldre sammenlignet med yngre pasienter? Hvordan optimalisere doseringen med Sutent?
Kadcyla. (trastuzumabemtansin) Viktig sikkerhetsinformasjon og veiledning til helsepersonell
 Kadcyla (trastuzumabemtansin) Viktig sikkerhetsinformasjon og veiledning til helsepersonell Versjon 6.0.0 Akseptert av Statens legemiddelverk 29.10.2018 1 Kadcyla: Kadcyla er et antistoff-cytostatikakonjugat
Kadcyla (trastuzumabemtansin) Viktig sikkerhetsinformasjon og veiledning til helsepersonell Versjon 6.0.0 Akseptert av Statens legemiddelverk 29.10.2018 1 Kadcyla: Kadcyla er et antistoff-cytostatikakonjugat
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslag til nasjonal metodevurdering
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener det er nødvendig
Legemiddeløkonomisk vurdering
 Legemiddeløkonomisk vurdering Ipilimumab (Yervoy) til behandling av avansert malignt melanom hos voksne som er tidligere behandlet. 19-10-2012 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Legemiddeløkonomisk vurdering Ipilimumab (Yervoy) til behandling av avansert malignt melanom hos voksne som er tidligere behandlet. 19-10-2012 Statens legemiddelverk Brev stiles til Statens legemiddelverk.
Refusjonsrapport. Abirateronacetat (Zytiga) til 2.linjebehandling av metastaserende kastrasjonsresistent prostatakreft (mcrpc)
 Refusjonsrapport Abirateronacetat (Zytiga) til 2.linjebehandling av metastaserende kastrasjonsresistent prostatakreft (mcrpc) Vurdering av søknad om forhåndsgodkjent refusjon 2 23-11-2012 Statens legemiddelverk
Refusjonsrapport Abirateronacetat (Zytiga) til 2.linjebehandling av metastaserende kastrasjonsresistent prostatakreft (mcrpc) Vurdering av søknad om forhåndsgodkjent refusjon 2 23-11-2012 Statens legemiddelverk
Refusjonsrapport. Von Willebrands faktor og human koagulasjonsfaktor VIII (Haemate) til behandling av von Willebrands sykdom og Hemofili A.
 Refusjonsrapport Von Willebrands faktor og human koagulasjonsfaktor VIII (Haemate) til behandling av von Willebrands sykdom og Hemofili A. Vurdering av søknad om forhåndsgodkjent refusjon 2 02-11-2012
Refusjonsrapport Von Willebrands faktor og human koagulasjonsfaktor VIII (Haemate) til behandling av von Willebrands sykdom og Hemofili A. Vurdering av søknad om forhåndsgodkjent refusjon 2 02-11-2012
Refusjonsrapport. Everolimus (Afinitor) til behandling av pankreatiske nevroendokrine tumorer (pnet)
 Refusjonsrapport Everolimus (Afinitor) til behandling av pankreatiske nevroendokrine tumorer (pnet) Vurdering av søknad om forhåndsgodkjent refusjon 2 03-11-2015 Statens legemiddelverk Forord Statens legemiddelverk
Refusjonsrapport Everolimus (Afinitor) til behandling av pankreatiske nevroendokrine tumorer (pnet) Vurdering av søknad om forhåndsgodkjent refusjon 2 03-11-2015 Statens legemiddelverk Forord Statens legemiddelverk
Anbefalinger om bruk av HPV vaksine. Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt
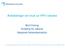 Anbefalinger om bruk av HPV vaksine Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt FHI anbefaler at HPV-vaksinen innføres i vaksinasjonsprogrammet Anbefalingen fra FHI bygger på flere
Anbefalinger om bruk av HPV vaksine Berit Feiring Avdeling for vaksine Nasjonalt folkehelseinstitutt FHI anbefaler at HPV-vaksinen innføres i vaksinasjonsprogrammet Anbefalingen fra FHI bygger på flere
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten
 Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2019_005 og ID2019_007 Ribosiklib i kombinasjon med aromatasehemmer eller fulvestrant til første- og andrelinjebehandling av
Hurtig metodevurdering for legemidler finansiert i spesialisthelsetjenesten ID2019_005 og ID2019_007 Ribosiklib i kombinasjon med aromatasehemmer eller fulvestrant til første- og andrelinjebehandling av
Pertuzumab (Perjeta) til behandling av tidligere ubehandlet HER2-positiv metastatisk brystkreft
 Pertuzumab (Perjeta) til behandling av tidligere ubehandlet HER2-positiv metastatisk brystkreft Oppdatering av hurtig metodevurdering av 08-04-2014: Hva er oppdatert? Dokumentasjon av effekt Kostnadseffektivitetsanalyser
Pertuzumab (Perjeta) til behandling av tidligere ubehandlet HER2-positiv metastatisk brystkreft Oppdatering av hurtig metodevurdering av 08-04-2014: Hva er oppdatert? Dokumentasjon av effekt Kostnadseffektivitetsanalyser
Indikasjon: Tilleggsbehandling ved behandling av voksne pasienter med partielle anfall, med eller uten sekundær generalisering.
 Refusjonsrapport preparat til behandling av epilepsi 1 Oppsummering Formål: Å vurdere Zonegran (zonisamid) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning av utgifter
Refusjonsrapport preparat til behandling av epilepsi 1 Oppsummering Formål: Å vurdere Zonegran (zonisamid) for pliktmessig refusjon etter forskrift av 18. april 1997 nr. 330 om stønad til dekning av utgifter
