VEDLEGG I PREPARATOMTALE
|
|
|
- Viggo Arnesen
- 7 år siden
- Visninger:
Transkript
1 VEDLEGG I PREPARATOMTALE 1
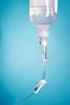
2 1. LEGEMIDLETS NAVN Scintimun 1 mg preparasjonssett til radioaktive legemidler 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hvert hetteglass med Scintimun inneholder 1 mg besilesomab. Besilesomab er et monoklonalt antistoff mot granulocytter (BW 250/183), produsert i museceller. Radionukliden er ikke med i settet. Hjelpestoffer med kjent effekt: Hvert hetteglass med Scintimun inneholder 2 mg sorbitol. Én ml av den radiomerkede oppløsningen inneholder mindre enn 4 mg natrium. For fullstendig liste over hjelpestoffer, se pkt LEGEMIDDELFORM Preparasjonssett til radioaktive legemidler Scintimun: hvitt pulver Oppløsningsmiddel for Scintimun: hvitt pulver 4. KLINISKE OPPLYSNINGER 4.1 Indikasjoner Dette legemidlet er kun til bruk ved diagnostiske formål. Technetium( 99m Tc)-besilesomab oppnås etter radioaktiv merking av besilesomab med natriumpertechnetat( 99m Tc)-oppløsning. Technetium( 99m Tc)-besilesomab oppløsningen er indisert til voksne for scintigrafi sammen med andre egnede bildediagnostiske modaliteter, for å bestemme lokaliseringen av en inflammasjon/infeksjon i det perifere skjelettet hos voksne ved mistanke om osteomyelitt. Scintimun må ikke brukes til å påvise diabetisk fotinfeksjon. 4.2 Dosering og administrasjonsmåte Dette legemidlet skal bare brukes ved godkjente nukleærmedisinske institusjoner, og må bare håndteres av autorisert personell. Dosering Voksne Anbefalt aktivitet av technetium( 99m Tc)-besilesomab bør være mellom 400 MBq og 800 MBq. Dette tilsvarer en dose på 0,25 til 1 mg besilesomab. Dosering for flergangsbruk finnes i pkt
3 Eldre Ingen dosejustering er nødvendig. Nedsatt nyrefunksjon / Nedsatt leverfunksjon Det er ikke utført formelle undersøkelser av pasienter med nedsatt nyre- eller leverfunksjon. På grunn av molekylets egenskaper og den korte halveringstiden til technetium( 99m Tc)-besilesomab, er det ikke nødvendig å justere doseringen for slike pasienter. Pediatrisk populasjon Sikkerhet og effekt av Scintimun hos barn og unge har ikke blitt fastslått. Ingen data er tilgjengelige. Administreringsmåte Den radioaktivt merkede oppløsningen må gis intravenøst bare som en enkelt dose. Dette legemidlet skal rekonstitueres og merkes radioaktivt før det administreres til pasienten. Instruksjoner for rekonstitusjon og radioaktiv merking av dette legemidlet finnes i pkt. 12. For klargjøring av pasienter, se pkt Bildeopptak Bildeopptak bør utføres 3 til 6 timer etter at legemidlet er gitt. Det anbefales å ta et nytt opptak 24 timer etter den første injeksjonen. Bildeopptaket kan gjøres ved planar avbilding. 4.3 Kontraindikasjoner Overfølsomhet overfor virkestoffet eller overfor andre museantistoffer eller noen av hjelpestoffene listet opp i pkt. 6.1 eller noen av komponentene i det merkede radioaktive legemidlet. Positiv test for humant antistoff mot mus (HAMA). Graviditet (se punkt 4.6). 4.4 Advarsler og forsiktighetsregler Potensial for overfølsomhet eller anafylaktiske reaksjoner Ved overfølsomhet eller anafylaktiske reaksjoner, må administrasjonen av legemidlet seponeres omgående. Intravenøs behandling startes om nødvendig. For å muliggjøre øyeblikkelige tiltak i nødstilfeller, må nødvendige legemidler og utstyr, som for eksempel endotrakealtube og ventilator, være tilgjengelige umiddelbart. Da allergiske reaksjoner på museproteiner ikke kan utelukkes, må utstyr for kardiovaskulær behandling, kortikosteroider og antihistaminer være tilgjengelige under administrasjon av legemidlet. Individuell nytte/risikovurdering For hver pasient må eksponering overfor stråling vurderes i forhold til forventet nytte for pasienten. Radioaktiviteten som administreres må i hvert tilfelle være slik at stråledosen blir så lav som mulig samtidig som den dekker behovet for å oppnå den nødvendige diagnostiske informasjonen. Klargjøring av pasienter Scintimun må gis til pasienter som er i en tilfredstillende hydreringstilstand. For å oppnå best mulige bilder og redusere strålingseksponeringen i urinblæren, må pasienten anmodes om å drikke tilstrekkelig med væske og tømme urinblæren før og etter scintigrafiundersøkelsen. Pause på minst 2 dager etter eventuell annen scintigrafi med andre technetium( 99m Tc)-merkede midler må tas før det gis Scintimun. 3
4 Tolking av bildene For tiden finnes ingen kriterier for å skille mellom infeksjon og inflammasjon ved hjelp av Scintimunbilder. Scintimun-bilder bør tolkes i sammenheng med andre passende anatomiske og/eller funksjonelle bildediagnostiske undersøkelser. Det foreligger bare begrensede data om binding av technetium( 99m Tc)-besilesomab til svulster som uttrykker karsinoembryonisk antigen (CEA) in vivo. In vitro kryssreagerer besilesomab med CEA. Falske positive funn hos pasienter med svulster som uttrykker CEA kan ikke utelukkes. Det kan fås feilaktige resultater hos pasienter med sykdommer med defekter i nøytrofilgranulocyttene og for pasienter med hematologisk kreft, deriblant myelom. Etter prosedyren Nærkontakt med spedbarn og gravide kvinner bør begrenses i løpet av de første 12 timene etter injeksjonen. Spesielle advarsler Fruktoseintoleranse Scintimun inneholder sorbitol, og bør derfor ikke gis til pasienter med den sjeldne arvelige lidelsen fruktoseintoleranse. Dette legemidlet inneholder mindre enn 1 mmol natrium (23 mg) for hver administrert dose, altså nesten natriumfritt. Humane antistoffer mot mus (HAMA) Administrering av monoklonale antistoffer fra mus kan føre til at det utvikles humane antistoffer mot mus (HAMA, human anti-mouse antibodies). Pasienter som er HAMA-positive kan ha større risiko for overfølsomhetsreaksjoner. Det må undersøkes om pasienten tidligere er eksponert for monoklonale antistoffer fra mus, og det må tas en HAMA-test før det gis Scintimun. Positivt svar kontraindiserer Scintimun (se punkt 4.3). Flergangsbruk Det foreligger svært få data om flergangsdosering med Scintimun. Scintimun skal bare gis én gang i en pasients levetid. 4.5 Interaksjon med andre legemidler og andre former for interaksjon Virkestoffer som hemmer inflammasjon eller virker inn på det hematopoetiske systemet (som antibiotika og kortikosteroider) kan gi falske negative resultater. Slike stoffer må derfor ikke gis sammen med eller like før injeksjonen med Scintimun. 4.6 Fertilitet, graviditet og amming Kvinner i fertil alder Når administrasjon av radiofarmaka til en fertil kvinne er indisert, er det viktig å fastslå hvorvidt hun er gravid.. Alle kvinner som ikke har fått menstruasjon til riktig tid må antas å være gravide med mindre noe annet er påvist. Dersom det finnes tvil om en mulig graviditet (uteblitt eller uregelmessig menstruasjon osv.), bør pasienten tilbys alternative teknikker som ikke bruker ioniserende stråling (hvis tilgjengelig). Graviditet Bruk av besilesomab er kontraindisert hos gravide kvinner (se punkt 4.3). 4
5 Amming Det er ikke kjent om produktet skilles ut i menneskelig morsmelk. Det kan ikke utelukkes en risiko for diende barn. Før det gis radiofarmaka til en mor som ammer, må det vurderes om det er mulig å utsette administrasjonen av radionuklid til etter at moren har sluttet å amme, og hva som er det best egnede radiofarmaka med hensyn til utskilling av aktivitet i morsmelk. Hvis det regnes som nødvendig å bruke produktet, bør ammingen opphøre i tre dager og den produserte melken kastes. Disse tre dagene tilsvarer 10 halveringstider for technetium( 99m Tc) (60 timer). På det tidspunktet utgjør den resterende aktiviteten omtrent 1/1000 av den opprinnelige aktiviteten i kroppen. Nærkontakt med spedbarn bør begrenses i løpet av de første 12 timene etter injeksjonen. 4.7 Påvirkning av evnen til å kjøre bil og bruke maskiner Scintimun har ingen eller ubetydelig påvirkning på evnen til å kjøre bil og bruke maskiner. 4.8 Bivirkninger Under de nyeste kliniske undersøkelsene der 123 pasienter fikk Scintimun, var den hyppigst rapporterte bivirkningen at det ble utviklet antistoffer mot mus (HAMA) hos 14 % av pasientene etter engangsadministrering (16 positive av 116 undersøkt en og/eller tre måneder etter administreringen). Tabellen nedenfor rapporterer bivirkninger for organklassene i MedDRA-systemet. Bivirkningsfrekvensen er basert på det nyeste kliniske forsøket og ikke-intervensjonelle sikkerhetsundersøkelsen. Bivirkningsfrekvensen nedenfor er definert etter den følgende konvensjonen: Svært vanlige ( 1/10), vanlige ( 1/100 til < 1/10), mindre vanlige ( 1/1000 til < 1/100), sjeldne ( 1/ til < 1/1000). Innenfor hver frekvensgruppering er bivirkninger presentert etter synkende alvorlighetsgrad. MedDRA-database for organklassesystem Forstyrrelser i immunsystemet Bivirkninger Anafylaktisk/anafylaktoid reaksjon Overfølsomhet, herunder angioødem, urtikaria Hyppighet Sjeldne Mindre vanlige Karsykdommer Lavt blodtrykk Vanlige Sykdommer i muskler, bindevev Myalgi, artralgi Sjeldne og skjelett Undersøkelser Positiv for menneskelige antistoffer mot mus Svært vanlige Ioniserende stråling kan framkalle kreft og skade arvestoffet. For nukleærmedisinske diagnoseundersøkelser er hyppigheten av disse bivirkningene ukjent. Da den effektive dosen er 6,9 msv når den maksimalt anbefalte aktiviteten på 800 MBq blir administrert, er det lav sannsynlighet for at disse bivirkningene skal forekomme. Melding av mistenkte bivirkninger Melding av mistenkte bivirkninger etter godkjenning av legemidlet er viktig. Det gjør det mulig å overvåke forholdet mellom nytte og risiko for legemidlet kontinuerlig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Dette gjøres via det nasjonale meldesystemet som beskrevet i Appendix V. 5
6 4.9 Overdosering Det er ingen rapporterte tilfeller av overdosering. I tilfelle av en strålingsoverdose med technetium( 99m Tc)-besilesomab, bør den absorberte dosen til pasienten reduseres hvis mulig ved å øke eliminasjonen av radionukliden fra kroppen så mye som mulig ved igangsatt diurese med hyppige blæretømminger og ved å framskynde avføringen med avføringsmiddel. 5. FARMAKOLOGISKE EGENSKAPER 5.1 Farmakodynamiske egenskaper Farmakoterapeutisk gruppe: Diagnostiske radiofarmaka, for påvisning av inflammasjon og infeksjon, Technetium ( 99m Tc) compounds. ATC-kode: V09 HA 03 Virkningsmekanisme Besilesomab er en IgG1-isotype av murint immunoglobulin som bindes spesifikt til NCA-95 (ikkespesifikt reagerende antigen 95), en epitop som uttrykkes ved cellemembranen til granulocytter og granulocyttforløpere. Besilesomab reagerer også med svulster som uttrykker karsinoembryonisk antigen (CEA). Besilesomab er uten virkning på komplementaktiveringen, granulocyttfunksjonen eller blodplatene. Farmakodynamiske effekter Ved de anbefalte aktivitetene har den ikke noen klinisk relevante farmakodynamiske virkninger. Klinisk effekt I en randomisert crossoverundersøkelse med blindlesing av Scintimun- og 99m Tc-leukocyttbilder fra 119 pasienter der det forelå mistanke om osteomyelitt, var overensstemmelsen mellom de to metodene 83 % (nedre 95 % konfidensintervallgrense: 80 %). Imidlertid hadde Scintimun i henhold til forskerens diagnose etter en måneds oppfølging litt lavere spesifisitet (71,8 %) enn 99m Tc-leukocyttene (79,5 %). Det foreligger ikke tilstrekkelige data om bruk av Scintimun til å påvise diabetisk fotinfeksjon. 5.2 Farmakokinetiske egenskaper Distribusjon Grafiske kurver over radioaktivitetskonsentrasjon/tid i helblod viser et forløp med to faser, som kan deles opp i en tidlig (0-2 timer) og en sen fase (5-24 timer). Etter korreksjon for nedbrytning av radionukliden er den beregnede halveringstiden for den tidlige fasen 0,5 timer, mens den sene fasen har utskillingshalveringstid på 16 timer. Organopptak Av all radioaktiviteten finnes omtrent 1,5 % i leveren og omtrent 3,0 % i milten seks timer etter injeksjonen. Tjuefire timer etter injeksjonen er disse prosentandelene av radioaktiviteten 1,6 % i leveren og 2,3 % i milten. Det kan observeres uvanlige ikke-patologiske akkumuleringer i milten (opptil 6 % av pasientene), i tarmen (opptil 4 % av pasientene), i leveren og beinmargen (opptil 3 % av pasientene) og i skjoldbruskkjertelen og nyrene (opptil 2 % av pasientene). 6
7 Eliminasjon Måling av radioaktiviteten i urinen viser at opptil 14 % av den tilførte aktiviteten skilles ut via urinblæren i løpet av de 24 timene etter injeksjonen. Den lave utskillingen av aktivitet i nyrene (0,2 l/t ved glomerulær filtreringshastighet på rundt 7 l/t) viser at nyrene ikke er det viktigste organet for utskilling av besilesomab. 5.3 Prekliniske sikkerhetsdata De prekliniske toksisitets- og sikkerhetsundersøkelsene er gjort med kommersielle kit rekonstituert med nedbrutt technetium ( 99m Tc), og effekten av strålingen er derfor ikke analysert. Prekliniske data med den ikke-radioaktive forbindelsen viser ikke noen spesiell fare for mennesker basert på konvensjonelle studier av sikkerhetsfarmakologi, giftighet ved enkeltdoser eller flere doser, men antistoff mot mus ble funnet i alle dosegruppene (også kontrollene) i en flerdoseundersøkelse på aper. Gentoksikologiske undersøkelser som ble gjort for å teste nærvær av potensielt gentoksikologiske forurensninger var også negative. Langtidsstudier av karsinogenitet er ikke utført. 6. FARMASØYTISKE OPPLYSNINGER 6.1 Fortegnelse over hjelpestoffer Scintimun hetteglass: Natriumdihydrogenfosfat, vannfritt Ninatriummonohydrogenfosfat, vannfritt Sorbitol E420 Under nitrogenatmosfære Oppløsningsmiddel for Scintimun hetteglass: 1,1,3,3-propantetrafosfonsyre, tetranatriumsalt-dihydrat (PTP) Tinn(II)klorid-dihydrat Natriumhydroksid/saltsyre (til ph-justering) Nitrogen 6.2 Uforlikeligheter Dette legemidlet må ikke blandes med andre legemidler enn de som er angitt under pkt Holdbarhet 3 år. Etter radioaktiv merking: 3 timer. Oppbevares ved høyst 25 ºC etter radioaktiv merking. 6.4 Oppbevaringsbetingelser Oppbevares i kjøleskap (2 8 ºC). Oppbevar hetteglasset i ytterkartongen for å beskytte det mot lys. Oppbevaringsbetingelser etter rekonstitusjon og radioaktiv merking av legemidlet, se pkt Oppbevaring av radiofarmaka skal være i samsvar med nasjonale forskrifter om radioaktive materialer. 7
8 6.5 Emballasje (type og innhold) Scintimun hetteglass: 10 ml, fargeløst glass type I, med propp av klorbutylgummi og forseglet aluminiumskapsel (grønn) som inneholder 5,02 mg pulver. Oppløsningsmiddel for Scintimun hetteglass: 6 ml fargeløst hetteglass type I, med propp av klorbutylgummi og forseglet aluminiumskapsel (gul) som inneholder 2,82 mg pulver. Pakningsstørrelser: Kit med ett hetteglass Scintimun til flere doser og ett hetteglass med oppløsningsmiddel for Scintimun. Kit med to hetteglass Scintimun til flere doser og to hetteglass med oppløsningsmiddel for Scintimun. Ikke alle pakningsstørrelser vil nødvendigvis bli markedsført. 6.6 Spesielle forholdsregler for destruksjon og annen håndtering Generell advarsel Radiofarmaka bør kun mottas, brukes og administreres av autoriserte personer i egnet klinisk setting. Mottak, oppbevaring, bruk, overføring og destruksjon er underlagt reguleringer og/eller egnede lisenser fra kompetente offentlige organer. Radiofarmaka skal tilberedes på en måte som tilfredsstiller både strålesikkerheten og de kravene som stilles til farmasøytisk kvalitet. Egnede tiltak med hensyn på aseptiske forhold må iverksettes. Innholdet i hetteglasset er kun ment for bruk ved tilberedning av technetium( 99m Tc)-besilesomab og skal ikke administreres direkte til pasienten uten først å ha gjennomgått den klargjørende prosedyren. For instruksjoner vedrørende rekonstituering og radioaktiv merking av dette legemidlet før administrasjon, se pkt. 12. Dersom hetteglassets integritet skades på noe tidspunkt av tilberedningen, skal legemidlet ikke brukes. Administreringen skal utføres på en måte som minimerer risikoen for kontaminering av legemidlet og strålingseksponering ovenfor operatøren. Tilfredsstillende skjerming er obligatorisk. Innholdet i settet er ikke radioaktivt før rekonstitusjon. Etter at det er tilsatt natriumpertechnetat( 99m TC) må det imidlertid sørges for tilfredstillende skjerming av legemidlet. Bruk av radiofarmaka utsetter andre personer for fare fra ekstern stråling eller kontaminering fra spilt urin, oppkast etc. Det må derfor treffes tiltak for strålevern i samsvar med nasjonale forskrifter. Ikke anvendt legemiddel samt avfall bør destrueres i overensstemmelse med lokale krav. 7. INNEHAVER AV MARKEDSFØRINGSTILLATELSEN CIS bio international B.P.32 F Gif-sur-Yvette Cedex Frankrike 8
9 8. MARKEDSFØRINGSTILLATELSESNUMMER (NUMRE) EU/1/09/602/001/NO-002/NO 9. DATO FOR FØRSTE MARKEDSFØRINGSTILLATELSE / SISTE FORNYELSE Dato for første markedsføringstillatelse: 11 januar 2010 Dato for siste fornyelse: 26 august OPPDATERINGSDATO {MM/ÅÅÅÅ} 11. DOSIMETRI Technetium( 99m Tc) produseres ved hjelp av en ( 99 Mo/ 99m Tc)-generator og brytes ned ved at det sender ut gammastråling med gjennomsnittsenergi 140 kev og halveringstid 6,02 timer til ( 99 Tc)technetium, som med sin lange halveringstid (2,13 x 10 5 år) kan regnes som kvasistabil. For hvert organ eller hver organgruppe er de opptatte dosene beregnet med en metodikk som er utviklet av MIRD (Medical Internal Radiation Dose). Den effektive dosen er beregnet ved å bruke de opptatte dosene bestemt for hvert enkelt organ og de vektingsfaktorene (stråling og vev) som skal brukes i henhold til anbefalingene fra ICRP (International Commission of Radiological Protection, publikasjon 103). 9
10 Tabell 1: verdier for opptatte doser beregnet for den mannlige og kvinnelige referansen. Organ msv/mbq Referansemann Referansekvinne Hjerne 0, ,00312 Hjerte 0, ,00597 Tykktarm 0, ,00576 Magesekk 0, ,00535 Lever 0,0100 0,0126 Tynntarm 0, ,00575 Beinmarg (rød) 0,0242 0,0229 Muskulatur 0, ,00391 Eggstokk 0,00594 Milt 0, ,00826 Hud 0, ,00216 Lunge 0,0125 0,0160 Milt 0,0271 0,0324 Nyre 0,0210 0,0234 Bryst 0,00301 Binyre 0, ,00937 Testikkel 0,00182 Brissel 0, ,00423 Skjoldbruskkjertel 0, ,00321 Skjelett 0,0177 0,0227 Livmor 0,00501 Galleblære 0, ,00681 Urinblære 0, ,00380 Hele kroppen 0, ,00552 Effektiv dose 0,00863 msv/mbq Den effektive dosen som følge av administrasjon av aktivitet på 800 MBq for en voksen som veier 70 kg er 6,9 msv. For en administrert aktivitet på 800 MBq er den typiske strålingsdosen til målorganet (benstrukturen) på 14,2 mgy. De typiske strålingsdosene til de kritiske organene benmarg, milt og nyrer er ved en administrert dose på 800 mbq, på henholdsvis 19,4 mgy, 21,7 mgy og 16,8 mgy. 12. INSTRUKSJONER FOR TILBEREDELSE AV RADIOFARMAKA Scintimun er et sterilt pulver som inneholder 1 mg besilesomab per hetteglass Scintimun. Uttak skal utføres under aseptiske forhold. Hetteglassene må ikke åpnes. Etter desinfeksjon av proppen skal oppløsningen trekkes opp gjennom proppen ved bruk av endosesprøyte utstyrt med egnet beskyttende skjerming og en steril engangsnål eller ved bruk av et godkjent automatisk applikasjonssystem. Dersom hetteglassets integritet skades så skal ikke produktet brukes. Tilberedningsmåte For å sikre mest mulig effektiv merking: - utføres merkingen med nyeluert natriumpertechnetat( 99m Tc). - Eluatene må tas fra en technetium( 99m Tc)-generator som er eluert i løpet av de siste 24 timene (dvs. med mindre enn 24 timers tilvekst av technetium). - Det første eluatet fra en technetium( 99m Tc)-generator som ikke er eluert over helgen må IKKE brukes. 10
11 Framgangsmåte 1. Ta et hetteglass med oppløsningsmiddel for Scintimun (gul påkrympet aluminiumskapsel) fra kitet. Desinfiser proppen og la den tørke. Før 5 ml av en 0,9 % natriumkloridoppløsning inn gjennom gummiproppen med en sprøyte. Før sprøyten tas ut, skal det trekkes ut et tilsvarende volum luft for å unngå overtrykk i hetteglasset. Rist forsiktig. 2. Desinfiser proppen igjen når alt er løst og la den tørke. Overfør 1 ml av denne oppløsningen med en hypodermisk sprøyte til et hetteglass Scintimun (grønn påkrympet aluminiumskapsel). Før sprøyten tas ut, skal det trekkes ut et tilsvarende volum luft for å unngå overtrykk i hetteglasset. Sett innholdet i rolig rotasjon med forsiktige handbevegelser. Innholdet av Scintimun-glasset løses i løpet av et minutt. (Må IKKE ristes.) 3. Se etter at innholdet i Scintimun-glasset er fullstendig løst etter 1 minutt. Sett Scintimun-glasset i en passende blyskjermet beholder. Desinfiser hinnen og la den tørke. Før 2-7 ml pertechnetat( 99m Tc) inn gjennom gummiproppen med en sprøyte (eluatet tilfredsstiller kravene til dagens europeiske farmakopé). Før sprøyten tas ut, skal det trekkes ut et tilsvarende volum luft for å unngå overtrykk i hetteglasset. Sett innholdet i forsiktig rotasjon for å blande hele oppløsningen (må IKKE ristes). Aktiviteten må være mellom 400 og 1800 MBq avhengig av pertechnetat( 99m Tc)-volumet. Hele volumet av Scintimun-glasset er 3 til 8 ml. 4. Fyll ut den vedlagte merkelappen og fest den på den radioaktivt merkede oppløsningen minutter etter at pertechnetatet( 99m Tc) er tilsatt, er oppløsningen klar for injeksjon. Merknader om instruksjonene - Oppløsningsmidlet for Scintimun må ALDRI merkes radioaktivt før det tilsettes til Scintimun. - Den endelige radioaktivt merkede oppløsningen må beskyttes mot oksygen. Etter rekonstitusjon med oppløsningsmidlet vedlagt pakningen og deretter radioaktiv merking med natriumpertechnetat( 99m Tc) for injeksjon, har den klare og fargeløse technetium( 99m Tc)-besilesomab oppløsningen for injeksjon en ph på 6,5 7,5. Kvalitetskontroll Den radiokjemiske renheten til det endelige merkede preparatet kan testes etter følgende framgangsmåte: Metode Hurtig tynnsjiktkromatografi (ITLC) eller papir kromatografi Materiell og reagenser - Adsorpsjonsmiddel: strimler (2,5 x 20 cm) for tynnsjiktkromatografi overtrukket med silikagel (ITLC-SG ) eller for papir kromatografi (RBM-1). Merk en startstrek 2,5 cm fra bunnen av papirstrimmelen. - Oppløsningsmiddel: metyletylketon (MEK) - Beholdere: Passende beholdere som kromatografitanker eller 1000 ml erlenmeyerkolber. - Diverse: tenger, sakser, sprøyter, passende telleapparat. Framgangsmåte Ikke la det komme luft til glasset som skal testes. Lagre alle glass som inneholder radioaktiv løsning i blyskjerming. 1. Før oppløsningen inn i kromatografitanken til omtrent 2 cm dybde. Dekk tanken til og vent minst 5 minutter på innstilling av likevekt. 2. Påfør en flekk (2 µl) av den radioaktivt merkede oppløsningen ved startstreken på kromatografistrimmelen med sprøyte og nål. 3. For å unngå at det dannes pertechnetat( 99m Tc) på grunn av oksygen, føres kromatografistrimmelen straks ned i tanken med tang. IKKE la flekken tørke. 11
12 4. Når oppløsningsmidlet har nådd toppen av strimmelen (omtrent 10 minutter), tas strimmelen ut med pinsetten til tørking i luft. 5. Kutt strimmelen i to atskilte deler ved Rf = 0,5. 6. Tell de to delene av strimmelen hver for seg og noter tellingene (bruk passende detekteringsutstyr med konstant telletid, kjent geometri og bakgrunnsstøy). 7. Beregninger Den radiokjemiske renheten svarer til prosentandelen bundet technetium( 99m Tc), og beregnes som følger etter at dataene er korrigert for bakgrunnsstøy. % bundet technetium( 99m Tc) = 100 % - % fritt technetium( 99m Tc) Der % fritt technetium( 99m Tc) = Aktivitet i den kuttede strimmelen fra Rf 0,5 til Rf 1,0 Total aktivitet i strimmelen x Den radiokjemiske renheten (prosent bundet technetium( 99m Tc)) må være høyere enn eller lik 95 %. 9. Oppløsningen må inspiseres visuelt før bruk. Ikke bruk annet enn klare oppløsninger som er frie for synlige partikler. Ikke anvendt legemiddel samt avfall bør destrueres i overensstemmelse med lokale krav. Detaljert informasjon om dette legemidlet er tilgjengelig på nettstedet til Det europeiske legemiddelkontoret (The European Medicines Agency) 12
13 VEDLEGG II A. TILVIRKER AV BIOLOGISK VIRKESTOFF OG TILVIRKER ANSVARLIG FOR BATCH RELEASE B. VILKÅR ELLER RESTRIKSJONER VEDRØRENDE LEVERANSE OG BRUK C. ANDRE VILKÅR OG KRAV TIL MARKEDSFØRINGSTILLATELSEN D. VILKÅR ELLER RESTRIKSJONER VEDRØRENDE SIKKER OG EFFEKTIV BRUK AV LEGEMIDLET 13
14 A. TILVIRKER AV BIOLOGISK VIRKESTOFF OG TILVIRKER ANSVARLIG FOR BATCH RELEASE Navn og adresse til tilvirker av det biologisk aktive virkestoffet GLYCOTOPE Biotechnology GmbH Czerny-Ring, Heidelberg TYSKLAND Navn og adresse til tilvirker ansvarlig for batch release CIS bio international B.P. 32 F Gif-sur-Yvette Cedex Frankrike B. VILKÅR ELLER RESTRIKSJONER VEDRØRENDE LEVERANSE OG BRUK Legemiddel underlagt reseptplikt (se vedlegg I: Preparatomtale, pkt. 4.2.). C. ANDRE VILKÅR OG KRAV TIL MARKEDSFØRINGSTILLATELSEN Periodiske sikkerhetsoppdateringsrapporter (PSUR) Kravene for innsendelse av periodiske sikkerhetsoppdateringsrapporter for dette legemidlet er angitt i EURD-listen (European Union Reference Date list), som gjort rede for i Artikkel 107c(7) av direktiv 2001/83/EF og i enhver oppdatering av EURD-listen som publiseres på nettstedet til Det europeiske legemiddelkontoret (The European Medicines Agency). D. VILKÅR ELLER RESTRIKSJONER VEDRØRENDE SIKKER OG EFFEKTIV BRUK AV LEGEMIDLET Risikohåndteringsplan (RMP) Innehaver av markedsføringstillatelsen skal gjennomføre de nødvendige aktiviteter og intervensjoner vedrørende legemiddelovervåkning spesifisert i godkjent RMP presentert i Modul i markedsføringstillatelsen samt enhver godkjent påfølgende oppdatering av RMP. En oppdatert RMP skal sendes inn: på forespørsel fra Det europeiske legemiddelkontoret (The European Medicines Agency); når risikohåndteringssystemet er modifisert, spesielt som resultat av at det fremkommer ny informasjon som kan lede til en betydelig endring i nytte/risiko profilen eller som resultat av at en viktig milepel (legemiddelovervåkning eller risikominimering) er nådd. 14
15 Andre risikominimeringsaktiviteter Innehaveren av markedsføringstillatelsen skal sørge for at når Scintimun markedsføres, at alle leger som har erfaring fra nukleærmedisin og kan forventes å forskrive eller bruke Scintimun, får en direkte kommunikasjon til helsearbeidere som omfatter opplysninger om potensiell risiko for at det dannes humane antistoffer mot mus (HAMA), for overfølsomhetsreaksjoner og fare for akutt hypotensjon, som vedtatt av CHMP. DHPC omfatter også 3 kopier av et varselkort for pasienter, utfylt av helesepersonell og utdelt til hver pasient. 15
16 VEDLEGG III MERKING OG PAKNINGSVEDLEGG 16
17 A. MERKING 17
18 OPPLYSNINGER SOM SKAL ANGIS PÅ DEN YTRE EMBALLASJEN KARTONG (kit med 1 hetteglass Scintimun og 1 hetteglass med oppløsningsmiddel for Scintimun eller kit med 2 hetteglass Scintimun og 2 hetteglass med oppløsningsmiddel for Scintimun) inneholder Blue Box 1. LEGEMIDLETS NAVN Scintimun 1 mg preparasjonssett til radioaktive legemidler besilesomab 2. DEKLARASJON AV VIRKESTOFF Hvert hetteglass med Scintimun inneholder 1 mg besilesomab 3. LISTE OVER HJELPESTOFFER Scintimun Hjelpestoffer: Vannfritt natriumdihydrogenfosfat, vannfritt dinatriummonohydrogenfosfat, sorbitol, under nitrogenatmosfære. Oppløsningsmiddel for Scintimun 1,1,3,3-propantetrafosfonsyretetranatriumsalt-dihydrat, tinn(ii)klorid-dihydrat, natriumhydroksid, saltsyre, nitrogen. Les pakningsvedlegget før bruk hvis du vil ha flere opplysninger. 4. LEGEMIDDELFORM OG INNHOLD Preparasjonssett til radioaktive legemidler Inneholder ett hetteglass Scintimun til flere doser og ett glass med oppløsningsmiddel for Scintimun Inneholder to hetteglass Scintimun til flere doser og to glass med oppløsningsmiddel for Scintimun 5. ADMINISTRASJONSMÅTE OG ADMINISTRASJONSVEI Intravenøs bruk Rekonstituer Scintimun med oppløsningsmidlet først og innfør så radioaktiv merking med oppløsning av natriumpertechnetat( 99m Tc). Les pakningsvedlegget før bruk. 18
19 6. ADVARSEL OM AT LEGEMIDLET SKAL OPPBEVARES UTILGJENGELIG FOR BARN 7. EVENTUELLE ANDRE SPESIELLE ADVARSLER 8. UTLØPSDATO Utløpsdato Brukes innen 3 timer etter radiomerkingen. 9. OPPBEVARINGSBETINGELSER Lagres i kjøleskap (2 8 ºC). Oppbevar hetteglasset i ytterkartongen for å beskytte det mot lys. Det rekonstituerte og radioaktivt merkede produktet lagres ved høyst 25 ºC. 10. EVENTUELLE SPESIELLE FORHOLDSREGLER VED DESTRUKSJON AV UBRUKTE LEGEMIDLER ELLER AVFALL Radioaktivt avfall må kasseres i samsvar med lokale forskrifter. 11. NAVN OG ADRESSE PÅ INNEHAVEREN AV MARKEDSFØRINGSTILLATELSEN CIS bio international B.P. 32 F Gif-sur-Yvette Cedex Frankrike 12. MARKEDSFØRINGSTILLATELSESNUMMER EU/1/09/602/001/NO-002/NO - ett hetteglass Scintimun til flere doser og ett hetteglass med oppløsningsmiddel for Scintimun. - to hetteglass Scintimun til flere doser og to hetteglass med oppløsningsmiddel for Scintimun. 13. PRODUKSJONSNUMMER Serie: 19
20 14. GENERELL KLASSIFIKASJON FOR UTLEVERING Reseptpliktig legemiddel 15. BRUKSANVISNING 16. INFORMASJON PÅ BLINDESKRIFT Fritatt fra krav om blindeskrift 20
21 MINSTEKRAV TIL OPPLYSNINGER SOM SKAL ANGIS PÅ SMÅ INDRE EMBALLASJER HETTEGLASS AV GLASS Scintimun Blue Box er ikke inkludert 1. LEGEMIDLETS NAVN OG ADMINISTRASJONSVEI Scintimun 1 mg preparasjonssett til radioaktive legemidler Besilesomab Intravenøs bruk 2. ADMINISTRASJONSMÅTE Les pakningsvedlegget før bruk. 3. UTLØPSDATO EXP Brukes innen 3 timer etter radiomerkingen. 4. PRODUKSJONSNUMMER Serie: 5. INNHOLD ANGITT ETTER VEKT, VOLUM ELLER ANTALL DOSER 1 mg 6. ANNET CIS bio international 21
22 MINSTEKRAV TIL OPPLYSNINGER SOM SKAL ANGIS PÅ SMÅ INDRE EMBALLASJER HETTEGLASS AV GLASS Oppløsningsmiddel for Scintimun Blue Box er ikke inkludert 1. LEGEMIDLETS NAVN OG ADMINISTRASJONSVEI Oppløsningsmiddel for Scintimun 2. ADMINISTRASJONSMÅTE Skal ikke brukes på pasienten direkte. 3. UTLØPSDATO EXP 4. PRODUKSJONSNUMMER Serie: 5. INNHOLD ANGITT ETTER VEKT, VOLUM ELLER ANTALL DOSER 2,82 mg 6. ANNET CIS bio international 22
23 MINSTEKRAV TIL OPPLYSNINGER SOM SKAL ANGIS PÅ SMÅ INDRE EMBALLASJER Ekstra merkelapp til bruk etter rekonstituering og merking med oppløsning av natriumpertechnetat( 99m Tc) 1. LEGEMIDLETS NAVN OG ADMINISTRASJONSVEI ( 99m Tc)-Scintimun 2. ADMINISTRASJONSMÅTE 3. UTLØPSDATO 4. PRODUKSJONSNUMMER 5. INNHOLD ANGITT ETTER VEKT, VOLUM ELLER ANTALL DOSER 99m Tc MBq ml time/dato 6. ANNET CIS bio international 23
24 B. PAKNINGSVEDLEGG 24
25 Pakningsvedlegg: Informasjon til pasienten Scintimun 1 mg preparasjonssett til radioaktive legemidler besilesomab Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon som er viktig for deg. - Ta vare på dette pakningsvedlegget. Du kan få behov for å lese det igjen. - Hvis du har flere spørsmål, kan du ta kontakt med legen din, apoteket eller spesialisten i nukleærmedisin som skal utføre undersøkelsen. - Kontakt lege eller apotek dersom du opplever bivirkninger, inkludert mulige bivirkninger som ikke er nevnt i dette pakningsvedlegget. Se avsnitt 4. I dette pakningsvedlegget finner du informasjon om: 1. Hva Scintimun er og hva det brukes mot 2. Hva du må vite før du bruker Scintimun 3. Hvordan du vil få Scintimun 4. Mulige bivirkninger 5 Hvordan Scintimun skal oppbevares 6. Innholdet i pakningen og ytterligere informasjon 1. Hva Scintimun er og hva det brukes mot Scintimun er et legemiddel som inneholder et antistoff (besilesomab) og brukes til å målsøke spesifikke celler som kalles granulocytter (en type hvite blodlemener som er involvert i inflammasjonsprosessen) i kroppen din. Scintimun brukes til å tillage en radioaktiv oppløsning for injeksjon av technetium( 99m Tc)-besilesomab. Technetium( 99m Tc) er et radioaktivt grunnstoff som gjør det mulig å se organer der besilesomab samler seg ved hjelp av et spesialkamera. Dette legemiddel er et radiofarmaka kun til bruk ved diagnostiske formål hos voksne. Etter at det er sprøytet inn i en blodåre, kan legen din lage bilder av organene dine for å finne inflammerte og/eller infiserte steder. Scintimun må ikke brukes til å påvise diabetisk fotinfeksjon. Bruken av Scintimun innebærer eksponering overfor små mengder av radioaktivitet. Legen din og spesialisten i nukleærmedisin har vurdert at den kliniske fordelen du vil ha av undersøkelsen med et radiofarmaka er større enn risikoen forbundet med strålingseksponeringen. 2. Hva du må vite før du bruker Scintimun Bruk ikke Scintimun: - dersom du er allergisk overfor besilesomab, antistoffer fra mus eller noen andre antistoffer eller overfor natriumpertechnetat( 99m Tc)-oppløsning eller noen av de andre innholdsstoffene i dette legemidlet (listet opp i avsnitt 6). - dersom du har positiv reaksjon fra en test på antistoff mot mus (HAMA-test). Spør legen din hvis du ikke er sikker. - dersom du er gravid. 25
26 Advarsler og forsiktighetsregler Rådfør deg med spesialisten i nukleærmedisin før du bruker Scintimun: - dersom du tidligere har fått Scintimun, for du bør ikke ta Scintimun mer enn én gang i livet. Du må også informere legen hvis du ikke er sikker på om du har fått dette legemidlet før. - dersom du har hatt scintigrafi med technetium i løpet av de 2 siste dagene. - dersom du har en tumoral patologi som innebærer det skilles ut karsinoembryonisk antigen (CEA), noe som kan forstyrre denne undersøkelsen. - dersom du har en hvilken som helst blodsykdom. - dersom du ammer. Før du får Scintimun For å oppnå best mulige bilder og redusere strålingen i urinblæren, må du drikke tilstrekkelig med væske og tømme blæren før og etter scintigrafiundersøkelsen. Barn og ungdom Dette produktet anbefales ikke for pasienter under 18 år fordi sikkerhet og effekt ikke er klarlagt. Andre legemidler og Scintimun Rådfør deg med spesialisten i nukleærmedisin dersom du bruker, nylig har brukt eller planlegger å bruke andre legemidler, også reseptfrie legemidler da de kan påvirke tolkningen av bildene. Legemidler som reduserer inflammasjon og legemidler som innvirker på produksjonen av blodceller (som kortikosteroider og antibiotika) kan innvirke på resultatene av undersøkelsen. Graviditet og amming Rådfør deg med spesialisten i nukleærmedisin før du tar dette legemidlet dersom du er gravid eller ammer, tror at du kan være gravid eller planlegger å bli gravid. Du må informere spesialisten i nukleærmedisin før du bruker Scintimun hvis det er en mulighet for at du kan være gravid, hvis menstruasjonen har uteblitt eller hvis du ammer. Hvis du er i tvil, er det viktig å kontakte spesialisten i nukleærmedisin som vil overvåke undersøkelsen. Du må ikke bruke Scintimun hvis du er gravid. Nukleærmedisinske undersøkelser kan innebære fare for fosteret. Hvis du ammer, må du holde opp med ammingen i 3 dager etter injeksjonen, og den produserte melka må kastes. Hvis du vil, kan du produsere og lagre morsmelk før injeksjonen. Dette vil beskytte barnet ditt mot stråling som kan finnes i morsmelk. Spør spesialisten i nukleærmedisin når du kan begynne å amme igjen. Du må også unngå nærkontakt med barnet ditt i løpet av de første 12 timene etter injeksjonen. Kjøring og bruk av maskiner Scintimun vil sannsynligvis ikke påvirke din evne til å kjøre bil eller bruke maskiner. Scintimun inneholder sorbitol Hvis du har overfølsomhet for visse sukkerarter (for eksempel fruktose eller sorbitol), må du informere legen før du får Scintimun. Scintimun inneholder mindre enn 1 mmol natrium (23 mg) pr. hetteglass, dvs. at det er i praksis «natriumfritt». 26
27 3. Hvordan du vil få Scintimun Det er strenge lover for bruk, håndtering og destruksjon av radiofarmaka. Scintimun kommer kun til å bli brukt i spesielle, kontrollerte områder. Dette legemidlet kommer kun til å bli håndtert og gitt til deg av personer som har fått opplæring og er kvalifiserte til å bruke det på en sikker måte. Disse personene kommer til å utvise spesiell forsiktighet med hensyn til sikker bruk av dette produktet, og vil holde deg oppdatert om sine handlinger. Spesialisten i nukleærmedisin som overvåker undersøkelsen vil bestemme hvor mye technetium( 99m Tc)-besilesomab som skal brukes i ditt tilfelle. Det vil være den minste nødvendige dosen for å få de ønskede opplysningene. Mengden som vanligvis anbefales til en voksen person ligger i området 400 til 800 MBq (megabecquerel, måleenheten som brukes til å uttrykke radioaktivitet). Administrasjon av Scintimun og utførelse av undersøkelsen Scintimun tilføres intravenøst. Én enkelt injeksjon inn i en vene (blodåre) er tilstrekkelig til å utføre den testen legen din trenger. Varighet av undersøkelsen Spesialisten i nukleærmedisin vil informere deg om den vanlige varigheten av undersøkelsen. Etter at du har fått Scintimun Fordi du kan slippe ut stråling som kan være særlig skadelig for små barn i de første 12 timene etter injeksjonen skal du unngå nærkontakt med små barn og gravide kvinner i løpet av denne tidsperioden. Spesialisten i nukleærmedisin vil informere deg dersom du er nødt til å ta noen forhåndsregler etter å ha fått dette legemidlet. Kontakt spesialisten i nukleærmedisin dersom du har noen spørsmål. Hvis du får for mye Scintimun En overdose er lite sannsynlig fordi injeksjonen framstilles som en enkeltdose av sykehuspersonalet under strengt kontrollerte forhold. I tilfelle av en overdose vil du bli bedt om å drikke rikelig med vann og ta avføringsmidler for å skille produktet raskere ut fra kroppen. Spør spesialisten i nukleærmedisin som leder undersøkelsen dersom du har noen spørsmål om bruk av dette legemidlet. 4. Mulige bivirkninger Som alle legemidler kan dette legemidlet forårsake bivirkninger, men ikke alle får det. Dette radioaktive legemidlet vil gi lave mengder av ioniserende stråling som er forbundet med minimal risiko for kreft og arvelige defekter. Det er funnet at omtrent 14 av 100 pasienter som får denne injeksjonen, danner antistoffer i blodet som reagerer mot antistoffet i Scintimun. Dette kan øke risikoen for allergiske reaksjoner hvis Scintimun blir gitt flere ganger. Derfor skal du ikke få Scintimun mer enn én gang. Ved allergisk reaksjon vil du få passende behandling av legen. De mulige bivirkningene er omtalt nedenfor med de vanligste først: Svært vanlige (kan ramme mer enn 1 av 10 personer): Utvikling av humane antistoffer mot mus som reagerer mot antistoffet i Scintimun (antistoffet fra museceller) med fare for allergisk reaksjon 27
28 Vanlige (kan ramme opptil 1 av 10 personer): Lavt blodtrykk Mindre vanlige (kan ramme opptil 1 av 100 personer): Allergisk reaksjon, som hovent ansikt og elveblest (urtikaria) Sjeldne (kan ramme opptil 1 av personer): Alvorlig allergisk reaksjon med pustevansker eller svimmelhet Muskel- eller leddsmerter Melding av bivirkninger Kontakt lege eller spesialisten i nukleærmedisin dersom du opplever bivirkninger inkludert mulige bivirkninger som ikke er nevnt i dette pakningsvedlegget. Du kan også melde fra om bivirkninger direkte via det nasjonale meldesystemet som beskrevet i Appendix V. Ved å melde fra om bivirkninger bidrar du med informasjon om sikkerheten ved bruk av dette legemidlet. 5. Hvordan du oppbevarer Scintimun Du trenger ikke å oppbevare dette legemidlet. Oppbevaring er spesialistens ansvar og skal skje i egnede lokaler. Oppbevaring av radioaktive legemidler skal være i overensstemmelse med nasjonale retningslinjer for radioaktivt materiale. 6. Innholdet i pakningen og ytterligere informasjon Sammensetningen av Scintimun - Virkestoff er besilesomab (monoklonalt antistoff mot granulocytter fra mus). Ett hetteglass med Scintimun inneholder 1 mg besilesomab - Andre innholdsstoffer (Se avsnitt 2 Scintimun inneholder sorbitol») Scintimun Natriumdihydrogenfosfat, vannfritt Dinatriummonohydrogenfosfat, vannfritt Sorbitol E420 Under nitrogenatmosfære Oppløsningsmiddel for Scintimun 1,1,3,3-propantetrafosfonsyre, tetranatriumsalt-dihydrat (PTP) Tinn(II)klorid-dihydrat Natriumhydroksid/saltsyre Nitrogen Hvordan Scintimun ser ut og innholdet av pakningen Scintimun er et sett for et radioaktivt preparat. Hetteglasset med Scintimun inneholder et hvitt pulver. Hetteglasset med oppløsningsmiddel til Scintimun inneholder et hvitt pulver. Kitet inneholder ett eller flere hetteglass med Scintimun til flere doser og ett eller to hetteglass med oppløsningsmiddel. Ikke alle pakningsstørrelser vil nødvendigvis bli markedsført. 28
29 Innehaver av markedsføringstillatelsen og tilvirker CIS bio international B.P. 32 F Gif-sur-Yvette Cedex Frankrike Dette pakningsvedlegget ble sist oppdatert {MM/ÅÅÅÅ}. Detaljert informasjon om dette legemidlet er tilgjengelig på nettstedet til Det europeiske legemiddelkontoret (The European Medicines Agency): Påfølgende informasjon er bare beregnet på helsepersonell: Fullstendig preparatomtale for Scintimun er gitt som en egen avrivingsdel til slutt i pakningsvedlegget som ligger i pakningen, med den hensikt å gi helsepersonell ytterligere vitenskapelig og praktisk informasjon om administrasjon og bruk av dette radiofarmaka. Det henvises til preparatomtalen. 29
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Scintimun 1 mg preparasjonssett til radioaktive legemidler besilesomab
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Scintimun 1 mg preparasjonssett til radioaktive legemidler besilesomab Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Scintimun 1 mg preparasjonssett til radioaktive legemidler besilesomab Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet. - Ta vare på
Én ml inneholder 1 mg dokusatnatrium (natriumdioktylsulfosuksinat) og 250 mg sorbitol (E 420).
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Klyx (1 mg/ml) / (250 mg/ml) rektalvæske,
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Klyx (1 mg/ml) / (250 mg/ml) rektalvæske,
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet.
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Pyrisept 2. KVALITATIV OG KVANTITATIV
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Pyrisept 2. KVALITATIV OG KVANTITATIV
4.1 Indikasjoner Sporelementtilskudd for å dekke basale til moderat økte behov ved parenteral ernæring.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Addaven, konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Addaven inneholder: 1 ml 1 ampulle (10 ml) Kromklorid (6H2O) 5,33 mikrog
PREPARATOMTALE 1. LEGEMIDLETS NAVN Addaven, konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Addaven inneholder: 1 ml 1 ampulle (10 ml) Kromklorid (6H2O) 5,33 mikrog
Bør bare brukes på gynekologiske- eller fødeavdelinger med nødvendig utrustning. Minprostin skal
 1. LEGEMIDLETS NAVN Minprostin 0,5 mg / 2,5 ml endocervikalgel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Dinoproston (prostaglandin E2) 0,2 mg/ml For fullstendig liste over hjelpestoffer se pkt. 6.1.
1. LEGEMIDLETS NAVN Minprostin 0,5 mg / 2,5 ml endocervikalgel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Dinoproston (prostaglandin E2) 0,2 mg/ml For fullstendig liste over hjelpestoffer se pkt. 6.1.
1. LEGEMIDLETS NAVN. Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. LEGEMIDLETS NAVN Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Kaliumklorid 74,6 mg/ml, tilsvarende 1 mmol/ml Elektrolyttprofilen til 1 ml
1. LEGEMIDLETS NAVN Addex - Kaliumklorid 1 mmol/ml, konsentrat til infusjonsvæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Kaliumklorid 74,6 mg/ml, tilsvarende 1 mmol/ml Elektrolyttprofilen til 1 ml
PREPARATOMTALE. Aktiv ingrediens Mengde 1 ml rekonstituert Soluvit inneholder: Tiaminmononitrat 3,1 mg 0,31 mg (Tilsvarer Vitamin B1 2,5 mg)
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Soluvit, pulver til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 hetteglass Soluvit inneholder: Aktiv ingrediens Mengde 1 ml rekonstituert
PREPARATOMTALE 1. LEGEMIDLETS NAVN Soluvit, pulver til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 hetteglass Soluvit inneholder: Aktiv ingrediens Mengde 1 ml rekonstituert
PREPARATOMTALE. Page 1
 PREPARATOMTALE Page 1 1. LEGEMIDLETS NAVN Oftagel 2,5 mg/g øyegel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Karbomer 974P 2,5 mg/g Hjelpestoff(er) med kjent virkning: benzalkoniumklorid (0,06 mg/g) For
PREPARATOMTALE Page 1 1. LEGEMIDLETS NAVN Oftagel 2,5 mg/g øyegel 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Karbomer 974P 2,5 mg/g Hjelpestoff(er) med kjent virkning: benzalkoniumklorid (0,06 mg/g) For
4. KLINISKE OPPLYSNINGER 4.1 Indikasjoner Urinveisinfeksjoner forårsaket av mecillinamfølsomme mikroorganismer
 1. LEGEMIDLETS NAVN Selexid 1 g pulver til injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hvert hetteglass inneholder: Mecillinam 1 gram For fullstendig liste over hjelpestoffer,
1. LEGEMIDLETS NAVN Selexid 1 g pulver til injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hvert hetteglass inneholder: Mecillinam 1 gram For fullstendig liste over hjelpestoffer,
Doseringen bestemmes av retningslinjene for legemidlet som skal løses opp eller fortynnes.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Sterilt vann B. Braun oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml inneholder: Vann til injeksjonsvæsker 100 ml 3. LEGEMIDDELFORM
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Sterilt vann B. Braun oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml inneholder: Vann til injeksjonsvæsker 100 ml 3. LEGEMIDDELFORM
Eldre Det er ikke nødvendig å justere dosen ved behandling av eldre pasienter.
 1. LEGEMIDLETS NAVN Glucosamin Orifarm 400 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Glukosamin 400 mg (som glukosaminsulfatkaliumklorid). For fullstendig liste over hjelpestoffer
1. LEGEMIDLETS NAVN Glucosamin Orifarm 400 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Glukosamin 400 mg (som glukosaminsulfatkaliumklorid). For fullstendig liste over hjelpestoffer
Hjelpestoffer med kjent effekt: sorbitol (256 mg/ml), metylparahydroksybenzoat (1 mg/ml) og etanol (40 mg/ml)
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Solvipect comp 2,5 mg/ml + 5 mg/ml mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder: Etylmorfinhydroklorid 2,5 mg Guaifenesin 5
PREPARATOMTALE 1. LEGEMIDLETS NAVN Solvipect comp 2,5 mg/ml + 5 mg/ml mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder: Etylmorfinhydroklorid 2,5 mg Guaifenesin 5
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ECOPORC SHIGA injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver 1 ml dose inneholder: Virkestoff: Genetisk modifisert
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ECOPORC SHIGA injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver 1 ml dose inneholder: Virkestoff: Genetisk modifisert
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1/18 1. VETERINÆRPREPARATETS NAVN Neocolipor injeksjonsvæske, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): Per dose på 2 ml: E.coli adhesin F4 (F4ab, F4ac,
VEDLEGG I PREPARATOMTALE 1/18 1. VETERINÆRPREPARATETS NAVN Neocolipor injeksjonsvæske, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): Per dose på 2 ml: E.coli adhesin F4 (F4ab, F4ac,
Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk
 1. LEGEMIDLETS NAVN 1 Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Natriumklorid 9 mg/ml inneholder: Natriumklorid Vann til
1. LEGEMIDLETS NAVN 1 Natriumklorid Fresenius Kabi 9 mg/ml, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml Natriumklorid 9 mg/ml inneholder: Natriumklorid Vann til
PREPARATOMTALE. Hjelpestoff(er) med kjent effekt: Cetylalkohol 1,10 % w/w, stearylalkohol 0,50 % w/w and propylenglykol 2,00 % w/w
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Bettamousse 1mg/g (0,1 %) skum 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 g skum inneholder 1 mg betametason (0,1 %) som valerat Hjelpestoff(er) med kjent effekt: Cetylalkohol
PREPARATOMTALE 1. LEGEMIDLETS NAVN Bettamousse 1mg/g (0,1 %) skum 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 g skum inneholder 1 mg betametason (0,1 %) som valerat Hjelpestoff(er) med kjent effekt: Cetylalkohol
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
Oppløsnings- eller fortynningsmiddel ved tilberedning av injeksjonsvæsker.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold pr. ml:
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold pr. ml:
1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Diprosalic liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
PREPARATOMTALE 1. LEGEMIDLETS NAVN Diprosalic liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Betametasondipropionat tilsvarende betametason 0,5 mg og salisylsyre 20 mg.
Pediatrisk populasjon: Legemidlet bør ikke brukes til barn siden det ikke finnes tilgjengelige sikkerhetsdata.
 1. LEGEMIDLETS NAVN Kaliumklorid Orifarm 750 mg depottabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En depottablett inneholder 750 mg kaliumklorid. For fullstendig liste over hjelpestoffer, se pkt.
1. LEGEMIDLETS NAVN Kaliumklorid Orifarm 750 mg depottabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En depottablett inneholder 750 mg kaliumklorid. For fullstendig liste over hjelpestoffer, se pkt.
Pakningsvedlegg: Informasjon til pasienten. GRANUPAS 4 g enterogranulat para-aminosalisylsyre
 Pakningsvedlegg: Informasjon til pasienten GRANUPAS 4 g enterogranulat para-aminosalisylsyre Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Pakningsvedlegg: Informasjon til pasienten GRANUPAS 4 g enterogranulat para-aminosalisylsyre Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder informasjon
Eldre Det er ikke nødvendig med dosejustering ved behandling av eldre pasienter.
 1. LEGEMIDLETS NAVN Gluxine 625 mg tablett, filmdrasjert 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder glukosaminsulfatnatriumkloridkompleks, tilsvarende 625 mg glukosamin eller 795
1. LEGEMIDLETS NAVN Gluxine 625 mg tablett, filmdrasjert 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder glukosaminsulfatnatriumkloridkompleks, tilsvarende 625 mg glukosamin eller 795
Oppløsnings- og fortynningsvæske til pulvere, konsentrater og oppløsninger til injeksjon.
 1 1. LEGEMIDLETS NAVN Sterile Water Fresenius Kabi, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml oppløsningsvæske inneholder: 100 g vann til injeksjonsvæsker 3.
1 1. LEGEMIDLETS NAVN Sterile Water Fresenius Kabi, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 100 ml oppløsningsvæske inneholder: 100 g vann til injeksjonsvæsker 3.
Vær sikker på at dyret har gjenvunnet normale svelgereflekser før det tilbys fôr og drikke.
 1. VETERINÆRPREPARATETS NAVN Sedastop vet. 5 mg/ml injeksjonsvæske, 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezol 4,27 mg (tilsv. 5,0 mg atipamezolhydroklorid) Hjelpestoff:
1. VETERINÆRPREPARATETS NAVN Sedastop vet. 5 mg/ml injeksjonsvæske, 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Atipamezol 4,27 mg (tilsv. 5,0 mg atipamezolhydroklorid) Hjelpestoff:
PREPARATOMTALE 1. LEGEMIDLETS NAVN. Airapy 100 % medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Airapy 100 % medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Medisinsk luft 100 % ved et trykk på 200 bar (15 C). 3. LEGEMIDDELFORM Medisinsk gass,
PREPARATOMTALE 1. LEGEMIDLETS NAVN Airapy 100 % medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Medisinsk luft 100 % ved et trykk på 200 bar (15 C). 3. LEGEMIDDELFORM Medisinsk gass,
1. VETERINÆRPREPARATETS NAVN
 1. VETERINÆRPREPARATETS NAVN Metomotyl 2,5 mg/ml injeksjonsvæske til katt og hund Metomotyl 5 mg/ml injeksjonsvæske til katt og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 2,5 mg/ml injeksjonsvæske
1. VETERINÆRPREPARATETS NAVN Metomotyl 2,5 mg/ml injeksjonsvæske til katt og hund Metomotyl 5 mg/ml injeksjonsvæske til katt og hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 2,5 mg/ml injeksjonsvæske
1. LEGEMIDLETS NAVN. Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest
 1. LEGEMIDLETS NAVN Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Soluprick Positiv kontroll:
1. LEGEMIDLETS NAVN Soluprick Positiv kontroll, 10 mg/ml, oppløsning til prikktest Soluprick Negativ kontroll, oppløsning til prikktest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Soluprick Positiv kontroll:
1. LEGEMIDLETS NAVN. Hjelpestoff(er) med kjent effekt: Isomalt 1830,0 mg (E953) og 457,6 mg flytende maltitol (E965).
 1. LEGEMIDLETS NAVN Solvivo 0,6 mg/1,2 mg sugetablett med mintsmak Solvivo 0,6 mg/1,2 mg sugetablett med honning- og sitronsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver sugetablett inneholder: amylmetakresol
1. LEGEMIDLETS NAVN Solvivo 0,6 mg/1,2 mg sugetablett med mintsmak Solvivo 0,6 mg/1,2 mg sugetablett med honning- og sitronsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver sugetablett inneholder: amylmetakresol
Voksne og barn over 6 år: Plantebasert legemiddel til bruk som slimløsende middel ved slimhoste.
 1. LEGEMIDLETS NAVN Prospan mikstur 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder 7 mg tørret ekstrakt av Hedera helix L., folium (tilsvarende 35-53 mg tørret eføyblad/ bergfletteblad).
1. LEGEMIDLETS NAVN Prospan mikstur 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml mikstur inneholder 7 mg tørret ekstrakt av Hedera helix L., folium (tilsvarende 35-53 mg tørret eføyblad/ bergfletteblad).
1. VETERINÆRPREPARATETS NAVN. Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Meloksikam 5 mg Hjelpestoff: Etanol
1. VETERINÆRPREPARATETS NAVN Rheumocam 5 mg/ml injeksjonsvæske, oppløsning til storfe og gris. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Meloksikam 5 mg Hjelpestoff: Etanol
1. LEGEMIDLETS NAVN. Medisinsk Luft Air Liquide 100% medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Medisinsk Luft Air Liquide 100% medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Medisinsk luft 100 % ved et trykk på 200 bar (15 C). 3. LEGEMIDDELFORM
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Medisinsk Luft Air Liquide 100% medisinsk gass, komprimert. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Medisinsk luft 100 % ved et trykk på 200 bar (15 C). 3. LEGEMIDDELFORM
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet.
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Kull Abigo 150 mg/ml mikstur, suspensjon
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Kull Abigo 150 mg/ml mikstur, suspensjon
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Proteq West Nile injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose à 1 ml inneholder: Virkestoff: West Nile
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Proteq West Nile injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose à 1 ml inneholder: Virkestoff: West Nile
Overfølsomhet overfor virkestoffene eller overfor noen av hjelpestoffene listet opp i pkt. 6.1.
 1. LEGEMIDLETS NAVN Bacimycin salve 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sinkbacitracin 500 IE/g. Klorheksidinacetat 5 mg/g. For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM
1. LEGEMIDLETS NAVN Bacimycin salve 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sinkbacitracin 500 IE/g. Klorheksidinacetat 5 mg/g. For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM
Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter]
![Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter] Natriumbehov [mmol] = (ønsket nåværende serumnatrium) total kroppsvæske [liter]](/thumbs/39/19534687.jpg) PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 1 mmol/ml konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml konsentrat til infusjonsvæske inneholder:
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 1 mmol/ml konsentrat til infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml konsentrat til infusjonsvæske inneholder:
1. VETERINÆRPREPARATETS NAVN. AviPro THYMOVAC Lyofilisat til bruk i drikkevann 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN AviPro THYMOVAC Lyofilisat til bruk i drikkevann 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose inneholder: Virkestoff: levende kyllinganemivirus (CAV*), stamme Cux-1: 10
1. VETERINÆRPREPARATETS NAVN AviPro THYMOVAC Lyofilisat til bruk i drikkevann 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose inneholder: Virkestoff: levende kyllinganemivirus (CAV*), stamme Cux-1: 10
Lyngonia anbefales ikke til bruk hos barn og ungdom under 18 år (se pkt. 4.4 Advarsler og forsiktighetsregler ).
 1. LEGEMIDLETS NAVN Lyngonia filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver filmdrasjert tablett inneholder: 361-509 mg ekstrakt (som tørket ekstrakt) fra Arctostaphylos uva-ursi
1. LEGEMIDLETS NAVN Lyngonia filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver filmdrasjert tablett inneholder: 361-509 mg ekstrakt (som tørket ekstrakt) fra Arctostaphylos uva-ursi
4.3 Kontraindikasjoner: Overfølsomhet overfor virkestoffet eller overfor noen av hjelpestoffene listet opp i pkt. 6.1.
 1. LEGEMIDLETS NAVN Fucidin impregnert kompress 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Fucidin salve 1,5 g/100 cm 2 tilsvarende natriumfusidat 30 mg/100 cm 2. For fullstendig liste over hjelpestoffer
1. LEGEMIDLETS NAVN Fucidin impregnert kompress 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Fucidin salve 1,5 g/100 cm 2 tilsvarende natriumfusidat 30 mg/100 cm 2. For fullstendig liste over hjelpestoffer
[Version 8, 10/2012] VEDLEGG I PREPARATOMTALE
![[Version 8, 10/2012] VEDLEGG I PREPARATOMTALE [Version 8, 10/2012] VEDLEGG I PREPARATOMTALE](/thumbs/32/15375229.jpg) [Version 8, 10/2012] VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Uniferon 200 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Hver ml inneholder 200
[Version 8, 10/2012] VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Uniferon 200 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Hver ml inneholder 200
Erivedge graviditetsforebyggende program
 Erivedge graviditetsforebyggende program Viktig sikkerhetsinformasjon om graviditetsforebygging og prevensjon for menn og kvinner som tar Erivedge Erivedge kan forårsake alvorlige fosterskader. Erivedge
Erivedge graviditetsforebyggende program Viktig sikkerhetsinformasjon om graviditetsforebygging og prevensjon for menn og kvinner som tar Erivedge Erivedge kan forårsake alvorlige fosterskader. Erivedge
Tabletten med styrke på 10 mg egner seg ikke til barn med en kroppsvekt under 30 kg.
 1. LEGEMIDLETS NAVN Loratadin Orifarm 10 mg tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder 10 mg loratadin. Hjelpestoff med kjent effekt: laktose For fullstendig liste over
1. LEGEMIDLETS NAVN Loratadin Orifarm 10 mg tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder 10 mg loratadin. Hjelpestoff med kjent effekt: laktose For fullstendig liste over
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet.
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Bacimycin pudder 2. KVALITATIV OG KVANTITATIV
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Bacimycin pudder 2. KVALITATIV OG KVANTITATIV
Behandlingsområdet vaskes med såpe og vann og deretter tørkes med håndkle e.l. før påføringen.
 1. LEGEMIDLETS NAVN Wartec 5 mg/ml liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Podofyllotoksin 5 mg/ml For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Liniment,
1. LEGEMIDLETS NAVN Wartec 5 mg/ml liniment, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Podofyllotoksin 5 mg/ml For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Liniment,
Preparatomtale (SPC) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder: Vi polysakkarid fra Salmonella typhi
 1 LEGEMIDLETS NAVN Preparatomtale (SPC) Typherix 25 mikrogram/0,5 ml, injeksjonsvæske, oppløsning. Vaksine mot tyfoidfeber (Vi polysakkarid) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder:
1 LEGEMIDLETS NAVN Preparatomtale (SPC) Typherix 25 mikrogram/0,5 ml, injeksjonsvæske, oppløsning. Vaksine mot tyfoidfeber (Vi polysakkarid) 2 KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 0,5 ml inneholder:
Inaktiverte hele bakterieceller av Haemophilus parasuis serotype 5, stamme 4800: 0,05 mg total nitrogen, induserer 9,1 ELISA enheter *.
 1. VETERINÆRPREPARATETS NAVN Porcilis Glässer Vet. injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose (2 ml) inneholder: Virkestoff(er): Inaktiverte hele bakterieceller
1. VETERINÆRPREPARATETS NAVN Porcilis Glässer Vet. injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 dose (2 ml) inneholder: Virkestoff(er): Inaktiverte hele bakterieceller
Pakningsvedlegg: Informasjon til brukeren. Diproderm øredråper 0,05 %, oppløsning. betametason
 PAKNINGSVEDLEGG Pakningsvedlegg: Informasjon til brukeren Diproderm øredråper 0,05 %, oppløsning betametason Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder
PAKNINGSVEDLEGG Pakningsvedlegg: Informasjon til brukeren Diproderm øredråper 0,05 %, oppløsning betametason Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette legemidlet. Det inneholder
Vaksine mot difteri og tetanus (adsorbert, redusert innhold av antigen).
 1. LEGEMIDLETS NAVN ditebooster, injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot difteri og tetanus (adsorbert, redusert innhold av antigen). 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Pr.
1. LEGEMIDLETS NAVN ditebooster, injeksjonsvæske, suspensjon i ferdigfylt sprøyte Vaksine mot difteri og tetanus (adsorbert, redusert innhold av antigen). 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Pr.
1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer se pkt. 6.1.
 1. LEGEMIDLETS NAVN Weifapenin 50 mg/ml pulver til mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer
1. LEGEMIDLETS NAVN Weifapenin 50 mg/ml pulver til mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml ferdigblandet mikstur inneholder: Fenoksymetylpenicillinkalium 50 mg. For hjelpestoffer
PREPARATOMTALE. Poliovirus type 1 (Brunhilde), type 2 (MEF-1) og type 3 (Saukett), dyrket i Vero-celler, renses og inaktiveres.
 PREPARATOMTALE 1 LEGEMIDLETS NAVN Veropol Injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose = 0,5 ml: Poliovirus type 1, inaktivert Poliovirus type 2,
PREPARATOMTALE 1 LEGEMIDLETS NAVN Veropol Injeksjonsvæske, oppløsning i ferdigfylt sprøyte 2 KVALITATIV OG KVANTITATIV SAMMENSETNING Per dose = 0,5 ml: Poliovirus type 1, inaktivert Poliovirus type 2,
Hypoglykemiske tilstander, f.eks. insulinkoma. Behov for parenteral karbohydrattilførsel.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1
PREPARATOMTALE. Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk. Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
PREPARATOMTALE 1. LEGEMIDLETS NAVN Sterilt vann Baxter Viaflo, oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver pose inneholder 100 % w/v vann til injeksjonsvæsker.
PREPARATOMTALE (SPC) 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig liste over hjelpestoffer se pkt. 6.1.
 PREPARATOMTALE (SPC) 1. LEGEMIDLETS NAVN Weifapenin 400 mg og 650 mg tabletter. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig
PREPARATOMTALE (SPC) 1. LEGEMIDLETS NAVN Weifapenin 400 mg og 650 mg tabletter. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 tablett inneholder: Fenoksymetylpenicillinkalium 400 mg resp. 650 mg. For fullstendig
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Gripovac 3 injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose à 2 ml inneholder: Virkestoffer: Stammer av
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Gripovac 3 injeksjonsvæske, suspensjon til gris 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose à 2 ml inneholder: Virkestoffer: Stammer av
Overfølsomhet overfor ginkgoblad eller overfor ett eller flere av hjelpestoffene listet opp i pkt. 6.1.
 1. LEGEMIDLETS NAVN Ginkgo Biloba, harde kapsler 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 kapsel inneholder 62,5 mg ekstrakt (som tørrekstrakt, raffinert) av Ginkgo biloba L., folium (Ginkgoblad) 35-67:1)
1. LEGEMIDLETS NAVN Ginkgo Biloba, harde kapsler 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 kapsel inneholder 62,5 mg ekstrakt (som tørrekstrakt, raffinert) av Ginkgo biloba L., folium (Ginkgoblad) 35-67:1)
Orale og intestinale Candida-infeksjoner. Som tilleggsbehandling til andre lokalt appliserte legemidler med nystatin som profylakse mot re-infeksjon.
 1. LEGEMIDLETS NAVN Nystimex 100 000 IE/ml mikstur, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 100 000 IE nystatin. Hjelpestoffer: Metylparahydroksybenzoat 1 mg Natrium 1,2 mg/ml,
1. LEGEMIDLETS NAVN Nystimex 100 000 IE/ml mikstur, suspensjon 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 100 000 IE nystatin. Hjelpestoffer: Metylparahydroksybenzoat 1 mg Natrium 1,2 mg/ml,
Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin.
 1. LEGEMIDLETS NAVN Minirin 0,1 mg/ml nesedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin. For fullstendig
1. LEGEMIDLETS NAVN Minirin 0,1 mg/ml nesedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Én ml inneholder 0,1 mg desmopressinacetat tilsvarende 89 mikrogram desmopressin. For fullstendig
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ProteqFlu injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 1ml inneholder: Virkestoffer: Influensa A/eq/Ohio/03
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ProteqFlu injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 1ml inneholder: Virkestoffer: Influensa A/eq/Ohio/03
SPC Soluprick SQ Timotei
 SPC Soluprick SQ Timotei 1. LEGEMIDLETS NAVN Soluprick SQ Timotei 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Virkestoffet er et standardisert allergenekstrakt fra Phleum pratense. Den biologiske
SPC Soluprick SQ Timotei 1. LEGEMIDLETS NAVN Soluprick SQ Timotei 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Virkestoffet er et standardisert allergenekstrakt fra Phleum pratense. Den biologiske
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Acticam 5 mg/ml injeksjonsvæske, oppløsning til hund og katt. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: Meloksikam
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Acticam 5 mg/ml injeksjonsvæske, oppløsning til hund og katt. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: Meloksikam
Oralpasta Hvit til lysgrå, glatt, smørbar, homogen pasta med eple-kanel smak.
 1. VETERINÆRPREPARATETS NAVN Panacur vet. 18,75% oralpasta til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): 1 g inneholder: Fenbendazol 187,5 mg Hjelpestoff(er): Konserveringsmiddel:
1. VETERINÆRPREPARATETS NAVN Panacur vet. 18,75% oralpasta til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): 1 g inneholder: Fenbendazol 187,5 mg Hjelpestoff(er): Konserveringsmiddel:
PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN. Nobivac DHP vet. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING. Virkestoff(er):
 PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Nobivac DHP vet. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): En dose (1 ml) rekonstituert vaksine inneholder: Valpesykevirus, stamme Onderstepoort
PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Nobivac DHP vet. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff(er): En dose (1 ml) rekonstituert vaksine inneholder: Valpesykevirus, stamme Onderstepoort
PREPARATOMTALE. 154 mmol/l 154 mmol/l
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Natriumklorid Braun 9 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Natriumklorid Elektrolyttinnhold:
PREPARATOMTALE 1. LEGEMIDLETS NAVN Natriumklorid Braun 9 mg/ml infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1000 ml infusjonsvæske inneholder: Natriumklorid Elektrolyttinnhold:
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Eurican Herpes 205 pulver og væske til injeksjonsvæske, emulsjon. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Pr 1 ml dose: Hundeherpesvirus
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Eurican Herpes 205 pulver og væske til injeksjonsvæske, emulsjon. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: Pr 1 ml dose: Hundeherpesvirus
Brannskader: Brannsåret skal først renses, og deretter påføres kremen hele det affiserte området i et 3-5 mm tykt lag.
 1. LEGEMIDLETS NAVN Flamazine 10 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sølvsulfadiazin 10 mg/g (1 %) For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM Krem 4. KLINISKE
1. LEGEMIDLETS NAVN Flamazine 10 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sølvsulfadiazin 10 mg/g (1 %) For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM Krem 4. KLINISKE
PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund
 PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PAKNINGSVEDLEGG Veraflox 60 mg og 120 mg tabletter til hund 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PREPARATOMTALE. Accusol 35. Accusol 35. Accusol 35
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Hemofiltrerings-, hemodialyse- og hemodiafiltreringsvæske. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sammensetning Stort kammer A Kalsiumkloriddihydrat Magnesiumkloridheksahydrat
PREPARATOMTALE 1. LEGEMIDLETS NAVN Hemofiltrerings-, hemodialyse- og hemodiafiltreringsvæske. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sammensetning Stort kammer A Kalsiumkloriddihydrat Magnesiumkloridheksahydrat
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN. Ipstyl Autogel 60 mg/90 mg/120 mg injeksjonsvæske oppløsning i ferdigfylt sprøyte lanreotid
 PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ipstyl Autogel 60 mg/90 mg/120 mg injeksjonsvæske oppløsning i ferdigfylt sprøyte lanreotid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet.
PAKNINGSVEDLEGG: INFORMASJON TIL BRUKEREN Ipstyl Autogel 60 mg/90 mg/120 mg injeksjonsvæske oppløsning i ferdigfylt sprøyte lanreotid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke legemidlet.
Hver tablett inneholder natriumalginat 250 mg, natriumhydrogenkarbonat 133,5 mg og kalsiumkarbonat 80 mg.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Galieve tyggetabletter med peppermyntesmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder natriumalginat 250 mg, natriumhydrogenkarbonat 133,5 mg
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Galieve tyggetabletter med peppermyntesmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver tablett inneholder natriumalginat 250 mg, natriumhydrogenkarbonat 133,5 mg
Overfølsomhet overfor virkestoffet eller overfor ett eller flere av hjelpestoffene.
 1. LEGEMIDLETS NAVN Corsodyl 2 mg/ml munnskyllevæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 2 mg klorheksidindiglukonat For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
1. LEGEMIDLETS NAVN Corsodyl 2 mg/ml munnskyllevæske 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder 2 mg klorheksidindiglukonat For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
Kraftige astmaanfall (særlig hos barn). Alvorlige anafylaktiske reaksjoner. Asystole, hjertestans. Overflateblødninger.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Adrenalin 1 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Adrenalintartrat 1,82 mg tilsvarer 1 mg/ml adrenalin. Hjelpestoff med kjent effekt:
PREPARATOMTALE 1. LEGEMIDLETS NAVN Adrenalin 1 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Adrenalintartrat 1,82 mg tilsvarer 1 mg/ml adrenalin. Hjelpestoff med kjent effekt:
Influensavirus overflateantigener, (hemagglutinin og neuraminidase) virosomer, av følgende stammer*:
 PREPARATOMTALE 1. LEGEMIDLETS NAVN INFLEXAL V injeksjonsvæske, suspensjon Vaksine mot influensa (inaktivert, overflateantigen, virosom) Sesongen 2013/2014 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Influensavirus
PREPARATOMTALE 1. LEGEMIDLETS NAVN INFLEXAL V injeksjonsvæske, suspensjon Vaksine mot influensa (inaktivert, overflateantigen, virosom) Sesongen 2013/2014 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Influensavirus
1. LEGEMIDLETS NAVN. Polaramin, 2 mg tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING. Deksklorfeniraminmaleat 2 mg
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Polaramin, 2 mg tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Deksklorfeniraminmaleat 2 mg For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Polaramin, 2 mg tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Deksklorfeniraminmaleat 2 mg For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM
Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin
 1. VETERINÆRPREPARATETS NAVN Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: mikrogram R(+)-Kloprostenol
1. VETERINÆRPREPARATETS NAVN Genestran Vet 75 mikrogram/ml injeksjonsvæske, oppløsning, for storfe, hest og svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml inneholder: Virkestoff: mikrogram R(+)-Kloprostenol
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE 1 Dette legemidlet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning. Se
VEDLEGG I PREPARATOMTALE
 [Version 8, 10/2012] VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Trilyme injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sammensetning av én dose (1 ml): Virkestoffer:
[Version 8, 10/2012] VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN Trilyme injeksjonsvæske, suspensjon til hund 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Sammensetning av én dose (1 ml): Virkestoffer:
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ZACTRAN 150 mg/ml injeksjonsvæske, oppløsning til storfe 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Gamitromycin Hjelpestoff:
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ZACTRAN 150 mg/ml injeksjonsvæske, oppløsning til storfe 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En ml inneholder: Virkestoff: Gamitromycin Hjelpestoff:
Hver kapsel inneholder glukosaminsulfat-kaliumkloridkompleks, tilsvarende 400 mg glukosamin eller 509 mg glukosaminsulfat.
 1. LEGEMIDLETS NAVN Glucosamin Pharma Nord 400 mg kapsel, hard 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver kapsel inneholder glukosaminsulfat-kaliumkloridkompleks, tilsvarende 400 mg glukosamin eller
1. LEGEMIDLETS NAVN Glucosamin Pharma Nord 400 mg kapsel, hard 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver kapsel inneholder glukosaminsulfat-kaliumkloridkompleks, tilsvarende 400 mg glukosamin eller
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Porcilis AR-T DF injeksjonsvæske, suspensjon til svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 2 ml inneholder: Virkestoffer:
VEDLEGG I PREPARATOMTALE 1 PREPARATOMTALE 1. VETERINÆRPREPARATETS NAVN Porcilis AR-T DF injeksjonsvæske, suspensjon til svin 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver dose på 2 ml inneholder: Virkestoffer:
Hypoglykemiske tilstander, f.eks. insulinkoma. Behov for parenteral karbohydrattilførsel.
 1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1 ml inneholder:
1 1. LEGEMIDLETS NAVN Glukose B. Braun 50 mg/ml injeksjonsvæske, oppløsning Glukose B. Braun 500 mg/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 50 mg/ml. 1 ml inneholder:
1. VETERINÆRPREPARATETS NAVN. Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Toltrazuril Hjelpestoffer: Natriumbenzoat (E
1. VETERINÆRPREPARATETS NAVN Baycox Bovis Vet. 50 mg/ml mikstur, suspensjon til kalv 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Virkestoff: Toltrazuril Hjelpestoffer: Natriumbenzoat (E
Hver filmdrasjerte tablett inneholder 120 mg feksofenadinhydroklorid tilsvarende 112 mg feksofenadin.
 1. LEGEMIDLETS NAVN Altifex 120 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver filmdrasjerte tablett inneholder 120 mg feksofenadinhydroklorid tilsvarende 112 mg feksofenadin.
1. LEGEMIDLETS NAVN Altifex 120 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver filmdrasjerte tablett inneholder 120 mg feksofenadinhydroklorid tilsvarende 112 mg feksofenadin.
Pakningsvedlegg: Informasjon til brukeren. Norcuron 10 mg pulver til injeksjonsvæske, oppløsning vekuroniumbromid
 PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren Norcuron 10 mg pulver til injeksjonsvæske, oppløsning vekuroniumbromid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette
PAKNINGSVEDLEGG 1 Pakningsvedlegg: Informasjon til brukeren Norcuron 10 mg pulver til injeksjonsvæske, oppløsning vekuroniumbromid Les nøye gjennom dette pakningsvedlegget før du begynner å bruke dette
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet.
 Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Pyrisept 1 mg/ml, oppløsning 2. KVALITATIV
Dette preparatet har markedsføringstillatelse for både human og veterinær bruk. Preparatomtale for veterinær bruk finnes nederst i dokumentet. 1. LEGEMIDLETS NAVN Pyrisept 1 mg/ml, oppløsning 2. KVALITATIV
Til voksne over 18 år: Syreoverskudd, ulcus pepticum, pyrose, kardialgi og dyspepsi.
 1. LEGEMIDLETS NAVN Titralac 50 mg, tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En tablett inneholder 50 mg kalsiumkarbonat Hjelpestoffer med kjent effekt: Én tablett inneholder hvetestivelse (70
1. LEGEMIDLETS NAVN Titralac 50 mg, tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En tablett inneholder 50 mg kalsiumkarbonat Hjelpestoffer med kjent effekt: Én tablett inneholder hvetestivelse (70
Obstipasjon. Forberedelse før røntgenundersøkelse eller tømming av colon før operative inngrep.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Dulcolax 10 mg stikkpiller 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Bisakodyl 10 mg For fullstendig liste over hjelpestoffer se pkt. 6.1 3. LEGEMIDDELFORM Stikkpille
PREPARATOMTALE 1. LEGEMIDLETS NAVN Dulcolax 10 mg stikkpiller 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Bisakodyl 10 mg For fullstendig liste over hjelpestoffer se pkt. 6.1 3. LEGEMIDDELFORM Stikkpille
PREPARATOMTALE. 1 ml oppløsning inneholder: Dekstran 70 (1,0 mg) og hypromellose (3,0 mg)
 1. LEGEMIDLETS NAVN PREPARATOMTALE Tears Naturale, 1 mg/ml / 3 mg/ml øyedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning inneholder: Dekstran 70 (1,0 mg) og hypromellose (3,0
1. LEGEMIDLETS NAVN PREPARATOMTALE Tears Naturale, 1 mg/ml / 3 mg/ml øyedråper, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml oppløsning inneholder: Dekstran 70 (1,0 mg) og hypromellose (3,0
Klorheksidinglukonat 20 mg/ml (2 %) oppløsning (tilsvarende 500 mg klorheksidinglukonat per pute).
 1. LEGEMIDLETS NAVN Klorheksidin Sage 20 mg/ml impregnert pute 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Klorheksidinglukonat 20 mg/ml (2 %) oppløsning (tilsvarende 500 mg klorheksidinglukonat per pute).
1. LEGEMIDLETS NAVN Klorheksidin Sage 20 mg/ml impregnert pute 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Klorheksidinglukonat 20 mg/ml (2 %) oppløsning (tilsvarende 500 mg klorheksidinglukonat per pute).
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ProteqFlu-Te injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 1ml inneholder: Virkestoffer: Influensa A/eq/Ohio/03
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN ProteqFlu-Te injeksjonsvæske, suspensjon til hest 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En dose à 1ml inneholder: Virkestoffer: Influensa A/eq/Ohio/03
Salven påsmøres 2-3 ganger daglig. Dersom det anlegges beskyttende forbinding, er påsmøring 1 gang daglig som regel tilstrekkelig.
 1. LEGEMIDLETS NAVN Fucidin 2 % salve 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Salve 2 %: 1 g inneh.: Natriumfusidat 20 mg. For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Salve
1. LEGEMIDLETS NAVN Fucidin 2 % salve 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Salve 2 %: 1 g inneh.: Natriumfusidat 20 mg. For fullstendig liste over hjelpestoffer, se pkt. 6.1. 3. LEGEMIDDELFORM Salve
Natriumhydrogenkarbonat B. Braun 167 mmol/l infusjonsvæske, oppløsning. Natriumhydrogenkarbonat B. Braun 500 mmol/l infusjonsvæske, oppløsning
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumhydrogenkarbonat B. Braun 167 mmol/l infusjonsvæske, oppløsning Natriumhydrogenkarbonat B. Braun 500 mmol/l infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumhydrogenkarbonat B. Braun 167 mmol/l infusjonsvæske, oppløsning Natriumhydrogenkarbonat B. Braun 500 mmol/l infusjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV
0,83 g ekstrakt (som nativt ekstrakt) (1 : 12 14) av Althaeae officinalis L., radix (Altearot). Ekstraksjonsmiddel: vann.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Bronwel Comp mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 15 ml (16,7 g) inneholder: 0,12 g ekstrakt (som nativt ekstrakt) (7 13 : 1) av Thymus vulgaris
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Bronwel Comp mikstur, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 15 ml (16,7 g) inneholder: 0,12 g ekstrakt (som nativt ekstrakt) (7 13 : 1) av Thymus vulgaris
En filmdrasjert tablett inneholder 1884,60 mg glukosaminsulfat natriumklorid tilsvarende 1500 mg glukosaminsulfat eller 1178 mg glukosamin.
 1. LEGEMIDLETS NAVN Dolenio 1178 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En filmdrasjert tablett inneholder 1884,60 mg glukosaminsulfat natriumklorid tilsvarende 1500 mg glukosaminsulfat
1. LEGEMIDLETS NAVN Dolenio 1178 mg filmdrasjerte tabletter 2. KVALITATIV OG KVANTITATIV SAMMENSETNING En filmdrasjert tablett inneholder 1884,60 mg glukosaminsulfat natriumklorid tilsvarende 1500 mg glukosaminsulfat
Preparatomtale (SPC) Inneholder også cetylalkohol, stearylalkohol og propylenglykolalginat.
 Preparatomtale (SPC) 1. LEGEMIDLETS NAVN Brevoxyl 40 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 gram inneholder benzoylperoksid 40 mg. Inneholder også cetylalkohol, stearylalkohol og propylenglykolalginat.
Preparatomtale (SPC) 1. LEGEMIDLETS NAVN Brevoxyl 40 mg/g krem 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 gram inneholder benzoylperoksid 40 mg. Inneholder også cetylalkohol, stearylalkohol og propylenglykolalginat.
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Quadramet 1,3 GBq/ml injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml løsning inneholder 1,3 GBq Samarium ( 153 Sm) leksidronampentanatrium
VEDLEGG I PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Quadramet 1,3 GBq/ml injeksjonsvæske, oppløsning. 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Hver ml løsning inneholder 1,3 GBq Samarium ( 153 Sm) leksidronampentanatrium
Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1.
 1. LEGEMIDLETS NAVN Xylocain liniment 3 % 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
1. LEGEMIDLETS NAVN Xylocain liniment 3 % 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: 1 ml liniment inneholder 30 mg lidokain. For fullstendig liste over hjelpestoffer se pkt. 6.1. 3. LEGEMIDDELFORM
PREPARATOMTALE. Duphalac mikstur, oppløsning med fruktsmak inneholder 667 mg laktulose pr. 1 ml. Én 15 ml dosepose inneholder 10 g laktulose.
 PREPARATOMTALE 1. LEGEMIDLETS NAVN Duphalac 667 mg/ml mikstur, oppløsning med fruktsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Duphalac mikstur, oppløsning med fruktsmak inneholder 667 mg laktulose
PREPARATOMTALE 1. LEGEMIDLETS NAVN Duphalac 667 mg/ml mikstur, oppløsning med fruktsmak 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Duphalac mikstur, oppløsning med fruktsmak inneholder 667 mg laktulose
1. VETERINÆRPREPARATETS NAVN. Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING
 1. VETERINÆRPREPARATETS NAVN Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff(er): Buserelinacetat
1. VETERINÆRPREPARATETS NAVN Receptal vet. 4 mikrog/ml injeksjonsvæske, oppløsning 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml injeksjonsvæske, oppløsning inneholder: Virkestoff(er): Buserelinacetat
Oppløsnings- eller fortynningsmiddel ved tilberedning av injeksjonsvæsker.
 PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold
PREPARATOMTALE 1 1. LEGEMIDLETS NAVN Natriumklorid B. Braun 9 mg/ml oppløsningsvæske til parenteral bruk 2. KVALITATIV OG KVANTITATIV SAMMENSETNING 1 ml inneholder: Natriumklorid 9 mg Elektrolyttinnhold
PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt
 PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
PAKNINGSVEDLEGG FOR Onsior 6 mg tabletter til katt 1. NAVN OG ADRESSE PÅ INNEHAVER AV MARKEDSFØRINGSTILLATELSE SAMT PÅ TILVIRKER SOM ER ANSVARLIG FOR BATCHFRIGIVELSE, HVIS DE ER FORSKJELLIGE Innehaver
VEDLEGG I PREPARATOMTALE
 VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN INCURIN 1 mg tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: østriol 1 mg/tablett Se punkt 6.1 for komplett liste over hjelpestoffer.
VEDLEGG I PREPARATOMTALE 1 1. VETERINÆRPREPARATETS NAVN INCURIN 1 mg tablett 2. KVALITATIV OG KVANTITATIV SAMMENSETNING Virkestoff: østriol 1 mg/tablett Se punkt 6.1 for komplett liste over hjelpestoffer.
