Fra molekyl til marked
|
|
|
- Torfinn Børresen
- 8 år siden
- Visninger:
Transkript
1 Fra molekyl til marked Finn Myhren, Clavis Pharma Takk til Marit Liland Sandvold og Wenche Rasch for preklinisk og klinisk support 1
2 Moderne medisin er basert på naturmedisin Naturstoffer (mer eller mindre rene) Ekstrakter - konsentrater + For å behandle, helbrede, lindre +/- For å stimulere og ruse - For å skade og drepe Innslaget av naturprodukter i moderne medisin er fortsatt stort 2
3 Medisin i et historisk perspektiv Den første aspirin Hippokrates beskriver ekstrakter av piletrefamilien mot smerte, plager, feber. Også kjent fra Asia og innfødte i Amerika Ebers papyrusen Beskriver 800 medisinske remedier basert på mineraler, plante- og dyre-ekstrakter 0 År 3
4 Medisin tre klassikere Aspirin Sulfonamider Penicilliner Tradisjon Kunnskap Tilfeldigheter Observasjonsevne Tverrfaglighet 4
5 Fra molekyl til medisin et vendepunkt Inntil ca 1940 har kjemiske produkter blitt introdusert som legemidler uten kjennskap til virkningsmekanismer på molekylært nivå. Dette gjelder for eksempel legemidler som aspirin og efedrin som ble utviklet fra naturprodukter, og produkter som klorokin, mepakrin og andre malariamidler som var hentet fra fargestoffindustrien Oppdagelsen av penicillin, påfølgende strukturoppklaring, begynnende mekanismeforståelse, kjemisk modifisering for å optimalisere et lead product og utvikling av avansert produksjonsteknologi kan stå som et eksempel på begynnelsen til en ny æra i medisinutvikling 5
6 Kjemisk strategi - tidslinjer Fra naturen Tilfeldig/planlagt leting etter aktive produkter i et biologisk mangfold Tester alt mot alt Lager mange produkter og tester alt mot alt. Typisk for store selskap. Litt tilfeldig. Fortsatt litt slik for eksempel innen cancer (NCI) Store bibliotek Basert på fast fase syntese Kombinatorisk kjemi. Lager og tester små mengder av et meget stort antall stoffer. Har ikke innfridd forventningene. In silico Computerbasert modellering kjent 3D-struktur av enzymer, reseptorer og naturlige substrater Håp om 100% selektive og spesifikke produkter 6
7 Tidslinjer fra molekyl til medisin - originalprodukt Klinikk Fase I Fase II Fase III Preklinikk Innledende tox/safety Biologisk effekt, in-vitro/in-vivo GLP tox/safety/farmakokinetikk Langtidsstudier Farmasi Metodeutvikling, GMP, analyser, oppskalering, biprodukter File patentsøknad Validering av prosess og analysemetoder Formuleringsutvikling Kjemi Validering av prosess og analysemetoder Oppskalering, GMP, kvalifisering av biprodukter File patentsøknad Metodeutvikling, syntese og analyse Syntese/karakterisering 100mg 5g 100g 5kg 10++ kg API mengde 7
8 Clavis Cancer Drug Pipeline Clavis Pharma Drug Candidate ELACYT solid tumor (iv) Melanoma Colorectal Cancer Additional PhII in planning ELACYT hematology (iv) Leukemia ELACYT oral CP-4126 solid tumors (iv) All comers CP-4126 oral CP-4200 (iv) Exploratory compounds Parent Drug Feasibility Preclinical Clinical Phase I Clinical Phase II Cytarabine CYTOSAR Gemcitabine GEMZAR Not disclosed various + library of more than 250 additional LVT compounds
9 Hvordan ser rollelisten ut i et lite selskap? I et lite selskap vil normalt alle ha flere oppgaver. Det er noen absolutte kjerneområder som må bekles slik jeg har sett det Basal kunnskap om feltet Fagperson på kjemi, farmasi, preklinikk, tox-safety, klinikk Regulatorisk / QA Investor/børs strategi Et lite selskap eller et virtuelt selskap med få eller ingen laboratoriefasiliteter er helt avhengige av eksterne leverandører Kunne kommunisere med leverandører og myndigheter på ekspertnivå Kamp om ressurser produkt/prosjektchampion?
10 Moderne medisinutvikling en tverrfaglig iterativ prosess Jevnlig tilførsel av ny kunnskap/oppdateringer innen alle felt Arbeid både i sekvens og i parallell på vei til målet Lovverk Kjemi/farmasi Medisin Biologi Hvordan prioritere oppgavene fra A til Å iht viktighet og nødvendighet. Fint å ha alle svar og informasjon tidlig, men heller ikke bruke mer ressurser enn nødvendig for tidlig. Hva er riktig nivå til enhver tid? 10
11 Hvordan planlegge og styre en utvikling Guidelines direktiver er det spesielle føringer for ditt prosjekt? Forestående implementeringer? Rådspørre myndighetene (SLV, EMEA, FDA) Vi foreslår å gjøre følgende.. Fordi Er det akseptabelt for SLV etc Får råd, men det er ingen garanti for at det er automatikk senere i godkjenningsprosessen Vitenskaplige rådgivere - styrerepresentanter Kan gi strategiske råd basert på grundig bransjekunnskap Klinisk utviklingsplan faglig og forretningsmessig grunnlag
12 Klinisk plan og registreringsstrategi Standard klinisk løp til fase 3 eller snarvei Orphan Drug liten indikasjon målt i # tilfelle + Pediatrisk bruk Conditional approval (EU), Fast track accelereted approval (USA) meget alvorlige sykdommer uten godt behandlingstilbud Oppnå markedseksklusivitet utover normal beskyttelsesperiode (OD, PED) Sjekk situasjonen for EU/USA/RoW ikke harmonisert
13 Proof of concept til hvilket formål? Er det en omforent oppfatning av hva POC er? Basert på resultater fra in-vitro/in-vivo modeller Ved slutt fase 2 rkedsføringstillatelse ere selskap / spin-off fra morselskap re selskap / spin-off fra morselskap selge budskapet til joint venture investorer kke lisenstakere rsintroduksjon
14 Valg av startpunkt er en utfordring Egengenererte ideer eller innlisensiering? Velg den rette kandidat Er produktet aktivt? Hvordan virker det? Støtter virkings- og bivirkningsprofil fortsatt utvikling? Hvordan treffe den korrekte beslutning basert på et minimum, men likevel tilstrekkelig antall eksperimenter?
15 Prekliniske utfordringer Finnes det etablerte/prediktive modeller? Ofte akademiske samarbeidsgrupperinger Big pharma selger ikke tjenester Skaffe bevis for at vi har et produkt In-vitro og in-vivo effektstudier Forslag til doseringsregime Aktivitetsprofil Mekanismestudier Bivirkninger (forut for formelle GLP sikkerhetsstudier) Understøtte rasjonale for klinisk utviklingsprogram vil myndighetene akseptere at det grunnlag for studier av produktet i mennesker?
16 Samarbeide med eksterne grupperinger - leverandører Utvalgskriterier Tilgang til modeller Erfaring og tilgjengelighet til personalet Pris - leveringsevne Tidslinjer Personkjemi og personlig engasjement Siste nytt er et bevegelig mål Vitenskap Marked
17 Sprikende mål? Når akademia møter industri kan målene avvike Forståelse av den andre parts mål er viktig Vi må skape en vinn-vinn situasjon Industri Fart Patent og hemmelighold Samsvar med regulatoriske krav Regelverk for klinisk prøvning Markedspotensial Godkjenninger Selskapets beslutninger Akademia Grundighet Publikasjoner og presentasjoner Heller vitenskaplig rasjonale enn behov for et nytt produkt Offentlig støtte og finansiering Verifisering av modellsystem
18 Dialog og god kommunikasjon er viktig Mitt produkt Mine vitenskaplige modeller Robotresultater postboks forskning, OK i noen grad Tolkninger og nyvinninger
19 Produksjon og leveranse av produkt I screeningfasen er alt tillatt av kjemikalier og reaksjoner lite fokus på pris og HMS Sikre substans til innledende preklinikk Ved oppskalering på vei til produksjon her starter alvoret Kvalitet (GMP) og kontroll Råvaretilgang og pris produksjonsmetoder Leveringsevne på kort og lang sikt kontrakter og kvalitetsavtaler Back-up produsent(er) Forventet produksjonspris på produktet (COGS) ved lansering Hvor mye er markedet villig til å betale? Har vi et teknisk vellykket produkt, men en økonomisk flause?
20 Patenter og legemidler
21 Patent en nødvendighet i legemiddelutvikling (?) Et patent er en kontrakt med myndighetene som kompensasjon for at oppfinneren skal la oppfinnelsen komme alle til gode. Er alternativet til patent hemmelighold? Et innvilget patent nekter andre å utnytte oppfinnelsen i kommersiell hensikt, men det gir ikke patenteieren automatisk rett til å utøve oppfinnelsen et patent er ikke en godkjenning av et legemiddel. Harmoniserte internasjonale retningslinjer mht gyldighet 20 år fra prioritetsdato Mulighet for forlenget beskyttelse (SPC / Hatch-Waxman (USA)) Snevrere beskyttelse enn originalpatentet Fotnote: Patent = publikasjon for å sikre rettigheter, men også for å ødelegge for andre la søknaden bli offentliggjort, men dropp forsvar og videreføring generer prior art
22 Hva kreves for å få et patent. Hva kan patenteres Nyhet produktet finnes ikke fra før Oppfinnerhøyde ikke opplagt å kunne utlede oppfinnelsen basert på kjent kunnskap (prior art) for en fagperson Nytteverdi industriell anvendbarhet Kjemisk produkt (new chemical entity = NCE) Farmasøytisk produkt Fremstillingsmetoder Terapeutisk bruk
23 Når er det lov å bryte patenter? Et patent kan fritt benyttes til forskning til dels også på vei til fremtidig kommersialisering av nye produkter Kan være OK med utviklingsarbeide og nødvendige studier for fremtidig søknad om markedsføringstillatelse (MT), men ikke OK med produksjon for lager etc. i påvente av MT Ikke harmoniserte internasjonale regler for dette USA er nokså liberal sjekk med lokale rådgivere Freedom to operate (FTO), handlefrihetsanalyse
24 Videre forskning på andres patenter mulighet for nye produkter og patenter 1) Oral 2) Dermal 3) Inhalasjon Farmasøytisk forskning Anvendelsesområde indikasjon 1).. 2).. 3).. Kjemisk forskning R1 seleksjonspatent Underbygges ved sml. preklinikk Y X R2 R1 = < ( ) > R2 = < ( ) > Spesielt gunstig utvalg
25 Fra fase I klinikk til godkjent medisin 25
26 Definisjon klinisk utprøving En systematisk studie av legemidler til mennesker i den hensikt å skaffe til veie eller etterprøve kunnskaper om legemidlenes effekter eller påvirkning av fysiologisk funksjon, interaksjoner, bivirkninger, opptak, fordeling, metabolisme og utskillelse, eller for å studere deres terapeutiske verdi 26
27 Definisjoner og begreper Investigational New Drug Application (IND) Food and Drug Administration (FDA) European Medicines Agency (EMEA) Marketing Authorisation (MA) (Markedsføringstillatelse, MT) New Drug Application (NDA) Health Authorities (HA, e.g. SLV) Institutional Review Board (IRB), Ethical Committee (EC) 27
28 Meget vanskelig to make it Kun 5 av 5000 forbindelser i preklinikk går videre til fase I klinikk 1 av disse 5 som blir testet i mennesker blir godkjent..og dyrt er det også Millions of 2000$ Pre-Clinical Clinical Total Source: DiMasi et al., J Health Economics 2003;22(2):
29 Fase I - III Fase I (Human Farmakologi) Friske frivillige/kreft pasienter (20-80+) Bivirkningsprofil (safety) Dose/Schedule (Recommended dose (RD), Dose Limiting Toxicity (DLT), Maximum Tolerated Dose (MTD) Farmakokinetikk (PK); absorpsjon, distribusjon, metabolisme og utskillelse av drug Effekt data- hvis mulig (Ph II indikasjon) Fase II (Terapeutisk Eksplorativ) pasienter/ spesielle indikasjoner Effekt Dose/regime Bivirkninger Fase III (Terapeutisk Bekreftende) 1000 (færre også mulig) pasienter Bekrefte /dokumenter funn fra fase II Sammenligne med rutinebehandling (Gold standard) Effekt og bivirkninger 29
30 Clinical Trials - from laboratory to medicine chest Years Test population Purpose Success rate Preclinical testing 3.5 5,000 compounds evaluated Phase I Laboratory & animal studies healthy volunteers/ File IND at FDA, cancer pts Assess HA safety in Europe, IRB/EC & biological Safety & activity dosage, schedule, PK 1 Phase II pts. volunteers Evaluate effectiveness, look for side effects File NDA at FDA. MA in EMEA 5 enter trials Phase III pts. volunteers Verify effectiveness, monitor AR from longterm use 30
31 Hvordan bestemme start dose fase I - kreft studier Note for Guidance on the pre-clinical evaluation of anticancer medicinal products (CPMP/SWP/997/96) A dose devoid of severe toxicity in animal studies USA: Regulatory considerations for preclinical development of anticancer drugs; DeGeorge et al /10 of the dose that causes severe toxicity (or death) in 10% of the rodents on a milligram per meter squared basis, provided that this starting dose does not cause serious irreversible toxicity in a non-rodent species 12.5 mg/kg equals 75 mg/m 2, 1/10th is 7.5 mg/m 2 If the dog is more appropriate, the dose should be one sixth of the highest dose tested in non-rodents that does not cause severe, irreversible toxicity 10 mg/kg equals 200 mg/m 2, 1/6th dose is 33.3 mg/m 2 31
32 Studie endepunkt/objektives Primære og sekundære endepunkt Harde endepunkt can be accurately determined are quantifiable do not depend on subjective impressions are accurately reproducible Eks: overlevelse, respons målt med MR/CT, blodparametre Myke endepunkt tend to evoke less confidence subjective may vary within and between observers suspect reproducibility often more clinically relevant Eks: Quality of Life, pasientdagbøker, styrke av bivirkning 32
Regulatorisk forståelse & Scientific Advice. For Norsk Biotekforum 26.03.2015
 Regulatorisk forståelse & Scientific Advice For Norsk Biotekforum 26.03.2015 Udekket behov! Antibacterial resistance Pandemic influenza Ischemic heart disease Diabetes Cancer Acute stroke HIV/AIDS Tuberculosis
Regulatorisk forståelse & Scientific Advice For Norsk Biotekforum 26.03.2015 Udekket behov! Antibacterial resistance Pandemic influenza Ischemic heart disease Diabetes Cancer Acute stroke HIV/AIDS Tuberculosis
Compassionate use ---og kliniske studier. Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving
 Compassionate use ---og kliniske studier Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Compassionate use - grenseområder Compassionate use: Til en gruppe pasienter Til pasienter som har
Compassionate use ---og kliniske studier Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Compassionate use - grenseområder Compassionate use: Til en gruppe pasienter Til pasienter som har
PRIME. PRIority MEdicines. Legemiddelverket, 10. mai 2016 Marit Hystad seksjonssjef EU koordinering
 PRIME PRIority MEdicines Legemiddelverket, 10. mai 2016 Marit Hystad seksjonssjef EU koordinering Udekket behov! Antibacterial resistance Pandemic influenza Ischemic heart disease Diabetes Cancer Acute
PRIME PRIority MEdicines Legemiddelverket, 10. mai 2016 Marit Hystad seksjonssjef EU koordinering Udekket behov! Antibacterial resistance Pandemic influenza Ischemic heart disease Diabetes Cancer Acute
EMA-samarbeid. Nye regulatoriske ordninger Regulatorisk høstmøte 30. November Jan Petter Akselsen
 EMA-samarbeid Nye regulatoriske ordninger Regulatorisk høstmøte 30. November 2016 Jan Petter Akselsen Tema Nye ordninger i EU-nettverket PRIME er igangsatt Adaptive Pathways AP pilot gjennomført Real world
EMA-samarbeid Nye regulatoriske ordninger Regulatorisk høstmøte 30. November 2016 Jan Petter Akselsen Tema Nye ordninger i EU-nettverket PRIME er igangsatt Adaptive Pathways AP pilot gjennomført Real world
Veiledning og innovasjonsstøtte ved Legemiddelverket. Nytt fra Statens legemiddelverk - Her 30. mai 2017
 Veiledning og innovasjonsstøtte ved Legemiddelverket Nytt fra Statens legemiddelverk - Her 30. mai 2017 Tema Politikk blir til tjenester Systemendring Fra veiledningsplikt til veiledningslyst Nye utfordringer,
Veiledning og innovasjonsstøtte ved Legemiddelverket Nytt fra Statens legemiddelverk - Her 30. mai 2017 Tema Politikk blir til tjenester Systemendring Fra veiledningsplikt til veiledningslyst Nye utfordringer,
Miljøpåvirkning og legemiddelgodkjenning Hva sier regelverket? Steinar Madsen Statens legemiddelverk
 Miljøpåvirkning og legemiddelgodkjenning Hva sier regelverket? Steinar Madsen Statens legemiddelverk Klasser av medisiner Substitusjon og tilskudd Vitaminer, mineraler, hormoner Medisiner som påvirker
Miljøpåvirkning og legemiddelgodkjenning Hva sier regelverket? Steinar Madsen Statens legemiddelverk Klasser av medisiner Substitusjon og tilskudd Vitaminer, mineraler, hormoner Medisiner som påvirker
Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI Jan Petter Akselsen
 Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI 30.03 2017 Jan Petter Akselsen Legemiddelmyndighetene Regulerer; Kliniske studier med legemidler Markedstilgang
Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI 30.03 2017 Jan Petter Akselsen Legemiddelmyndighetene Regulerer; Kliniske studier med legemidler Markedstilgang
Regulatorisk høstmøte 7. okt 2009 Siri Wang Dr Scient Cand Pharm, Seniorrådgiver SLV
 Den europeiske forordningen 1901/2006 Legemidler til barn Regulatorisk høstmøte 7. okt 2009 Siri Wang Dr Scient Cand Pharm, Seniorrådgiver SLV Bruk av legemidler til barn er kjennetegnet ved Færre godkjente
Den europeiske forordningen 1901/2006 Legemidler til barn Regulatorisk høstmøte 7. okt 2009 Siri Wang Dr Scient Cand Pharm, Seniorrådgiver SLV Bruk av legemidler til barn er kjennetegnet ved Færre godkjente
Forskrift om klinisk utprøving: Hva betyr begrepene og hva er annerledes enn helseforskningsloven
 Forskrift om klinisk utprøving: Hva betyr begrepene og hva er annerledes enn helseforskningsloven Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk Hensynet til forsøkspersonenes
Forskrift om klinisk utprøving: Hva betyr begrepene og hva er annerledes enn helseforskningsloven Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk Hensynet til forsøkspersonenes
Mikroalger til medisin; krefthemmere
 Mikroalger til medisin; krefthemmere Kari Skjånes og Hanne Skomedal Bioforsk Jord og Miljø og Plantehelse Agenda Hvorfor mikroalger som krefthemmere Kreftutvikling Potensiale Hva kan utvikles Hvordan utvikle
Mikroalger til medisin; krefthemmere Kari Skjånes og Hanne Skomedal Bioforsk Jord og Miljø og Plantehelse Agenda Hvorfor mikroalger som krefthemmere Kreftutvikling Potensiale Hva kan utvikles Hvordan utvikle
Visjoner for alternativer til dyreforsøk. Jon Inge Erdal Veterinær, dr. scient Utviklingssjef ScanVacc AS
 Visjoner for alternativer til dyreforsøk Jon Inge Erdal Veterinær, dr. scient Utviklingssjef ScanVacc AS ScanVacc AS ScanVacc AS utvikler, dokumenterer og markedsfører veterinære legemidler til bruk på
Visjoner for alternativer til dyreforsøk Jon Inge Erdal Veterinær, dr. scient Utviklingssjef ScanVacc AS ScanVacc AS ScanVacc AS utvikler, dokumenterer og markedsfører veterinære legemidler til bruk på
QP erklæringer: Hva som forventes og eksempler på mangler
 QP erklæringer: Hva som forventes og eksempler på mangler DRA forum 02.05.2017 Jostein Hatlelid Innhold GMP i produksjonskjeden Legemiddelforskriften og QP-erklæring QP-erklæring forventninger og mangler
QP erklæringer: Hva som forventes og eksempler på mangler DRA forum 02.05.2017 Jostein Hatlelid Innhold GMP i produksjonskjeden Legemiddelforskriften og QP-erklæring QP-erklæring forventninger og mangler
Norsk Biotekforum. Forsøksdesign og statistikk i planleggingen av tidligfase kliniske studier. Statistikerens rolle.
 Norsk Biotekforum 12. juni 2008 Forsøksdesign og statistikk i planleggingen av tidligfase kliniske studier. Statistikerens rolle. Trond Haider Sr. statistiker Tidlig fase i klinisk forskning: Fase 0 First
Norsk Biotekforum 12. juni 2008 Forsøksdesign og statistikk i planleggingen av tidligfase kliniske studier. Statistikerens rolle. Trond Haider Sr. statistiker Tidlig fase i klinisk forskning: Fase 0 First
Hvorfor har vi de legemidlene vi har? Karen Marie Ulshagen, Seksjon for legemiddelovervåking
 Hvorfor har vi de legemidlene vi har? Karen Marie Ulshagen, Seksjon for legemiddelovervåking Udekket medisinsk behov Markedsmodellen Endringer Avregistrering Utviklingsprogram Markedsmulighet Legemiddelovervåking
Hvorfor har vi de legemidlene vi har? Karen Marie Ulshagen, Seksjon for legemiddelovervåking Udekket medisinsk behov Markedsmodellen Endringer Avregistrering Utviklingsprogram Markedsmulighet Legemiddelovervåking
Hva vet man om riktig bruk når et nytt legemiddel godkjennes?
 Hva vet man om riktig bruk når et nytt legemiddel godkjennes? Eva Skovlund Statens Legemiddelverk Farmasøytisk institutt, UiO Farmasidagene 2010 MASSE! Men ofte mindre enn vi skulle ønske Til grunn for
Hva vet man om riktig bruk når et nytt legemiddel godkjennes? Eva Skovlund Statens Legemiddelverk Farmasøytisk institutt, UiO Farmasidagene 2010 MASSE! Men ofte mindre enn vi skulle ønske Til grunn for
Godkjenning av prosjekter og kliniske utprøvinger på barn hvordan er SLV s rolle?
 Godkjenning av prosjekter og kliniske utprøvinger på barn hvordan er SLV s rolle? Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk AGENDA Regelverket Søknader til Legemiddelverket
Godkjenning av prosjekter og kliniske utprøvinger på barn hvordan er SLV s rolle? Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk AGENDA Regelverket Søknader til Legemiddelverket
OTC USE IN NORWAY FOR PARACETAMOL, ATC-CODE: N02BE01
 OTC USE IN NORWAY FOR PARACETAMOL, ATC-CODE: N02BE01 To gain OTC prescription status for a medicinal product an application in accordance with A guideline on changing the classification for the supply
OTC USE IN NORWAY FOR PARACETAMOL, ATC-CODE: N02BE01 To gain OTC prescription status for a medicinal product an application in accordance with A guideline on changing the classification for the supply
Legemiddelpakke I nå også i Norge. Regulatorisk høstmøte Ingeniørenes hus, Oslo Onsdag 7.oktober 2009 Sidsel Harby Rådgiver, Statens legemiddelverk
 Legemiddelpakke I nå også i Norge Regulatorisk høstmøte Ingeniørenes hus, Oslo Onsdag 7.oktober 2009 Sidsel Harby Rådgiver, Statens legemiddelverk Agenda DCP Braille (blindeskrift) Usertesting (Lesbarhetstesting)
Legemiddelpakke I nå også i Norge Regulatorisk høstmøte Ingeniørenes hus, Oslo Onsdag 7.oktober 2009 Sidsel Harby Rådgiver, Statens legemiddelverk Agenda DCP Braille (blindeskrift) Usertesting (Lesbarhetstesting)
GCP-forum 11/11/2010 Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving
 Status for legemiddelstudier på barn (i Norge) GCP-forum 11/11/2010 Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Den europeiske forordningen 1901/2006 - Legemidler til barn Intensjon: Bedre
Status for legemiddelstudier på barn (i Norge) GCP-forum 11/11/2010 Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Den europeiske forordningen 1901/2006 - Legemidler til barn Intensjon: Bedre
Antibiotikaresistens - Er det regulatoriske på plass? Farmasidagene 6. nov. 2015 Tove Lill Stendal Statens legemiddelverk
 Antibiotikaresistens - Er det regulatoriske på plass? Farmasidagene 6. nov. 2015 Tove Lill Stendal Statens legemiddelverk Regulatorisk rammeverk Hva er på plass? Hva er utfordringene? ema itt om det regulatoriske
Antibiotikaresistens - Er det regulatoriske på plass? Farmasidagene 6. nov. 2015 Tove Lill Stendal Statens legemiddelverk Regulatorisk rammeverk Hva er på plass? Hva er utfordringene? ema itt om det regulatoriske
Veiledning og innovasjonsstøtte
 Veiledning og innovasjonsstøtte DRA-forum: 28. mars 2019 Jan Petter Akselsen Statens legemiddelverk Ca. 300 ansatte Dekker alle områder innen legemiddelforvaltning Kost/nytte og HTA Full deltakelse i EU
Veiledning og innovasjonsstøtte DRA-forum: 28. mars 2019 Jan Petter Akselsen Statens legemiddelverk Ca. 300 ansatte Dekker alle områder innen legemiddelforvaltning Kost/nytte og HTA Full deltakelse i EU
Dødsårsaker i Norge SSB
 Dødsårsaker i Norge SSB Kreft er nr. 2 som dødsårsak i Norge og nr. 1 i aldersgruppen 40-74 år Dødelighet av kreft og hjerte- og karsykdommer SSB Cancer prognosis development in Norway over the last decades
Dødsårsaker i Norge SSB Kreft er nr. 2 som dødsårsak i Norge og nr. 1 i aldersgruppen 40-74 år Dødelighet av kreft og hjerte- og karsykdommer SSB Cancer prognosis development in Norway over the last decades
Gjennomføring av studier - fra planlegging til avslutning. Line Bjørge
 Gjennomføring av studier - fra planlegging til avslutning Line Bjørge Flere pasienter i kliniske studier!... ønsker regjeringen at pasienter skal gis økte muligheter til å delta i utprøvende behandling.
Gjennomføring av studier - fra planlegging til avslutning Line Bjørge Flere pasienter i kliniske studier!... ønsker regjeringen at pasienter skal gis økte muligheter til å delta i utprøvende behandling.
Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI Jan Petter Akselsen
 Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI 30.03 2017 Jan Petter Akselsen Legemiddelmyndighetene Regulerer; Kliniske studier med legemidler Markedstilgang
Hvordan påvirkes utviklingen av studiedesign på bakgrunn av «Persontilpasset» medisin? LMI 30.03 2017 Jan Petter Akselsen Legemiddelmyndighetene Regulerer; Kliniske studier med legemidler Markedstilgang
DnE som CMO. Vår rolle, kompetanse og tjenester
 DnE som CMO Vår rolle, kompetanse og tjenester Farma Holding AS AS ( DnE) DnE Sverige AB Farmagon AS Eies av Farma Holding AS Fusjonerte med Apotekproduksjon mai 2014 Hovedkontor på Karihaugen i Oslo,
DnE som CMO Vår rolle, kompetanse og tjenester Farma Holding AS AS ( DnE) DnE Sverige AB Farmagon AS Eies av Farma Holding AS Fusjonerte med Apotekproduksjon mai 2014 Hovedkontor på Karihaugen i Oslo,
Legemiddelindustriens rolle i helseforskningen. GCP-forum 29. februar 2012 Monica Kjeken
 Legemiddelindustriens rolle i helseforskningen GCP-forum 29. februar 2012 Monica Kjeken LMI har som mål å styrke forskning, produksjon og næringsutvikling på legemiddelområdet i Norge Norsk grunnforskning
Legemiddelindustriens rolle i helseforskningen GCP-forum 29. februar 2012 Monica Kjeken LMI har som mål å styrke forskning, produksjon og næringsutvikling på legemiddelområdet i Norge Norsk grunnforskning
Fra ord til handling Industrien som forskningsaktør
 Fra ord til handling Industrien som forskningsaktør 20. januar 2015 Monica Larsen Seniorrådgiver R&D and Innovation Kilde: SLV Kliniske studier i Norge vs Europa Kilde: SLV 2. Results: Overview of results
Fra ord til handling Industrien som forskningsaktør 20. januar 2015 Monica Larsen Seniorrådgiver R&D and Innovation Kilde: SLV Kliniske studier i Norge vs Europa Kilde: SLV 2. Results: Overview of results
Innføring i Good Clinical Practice (GCP) og hva er spesielt hos barn?
 Innføring i Good Clinical Practice (GCP) og hva er spesielt hos barn? Martha Colban, Avdelingsleder Avdeling for klinisk forskningsstøtte Virksomhetsområde forskningsstøtte Oslo universitetssykehus HF
Innføring i Good Clinical Practice (GCP) og hva er spesielt hos barn? Martha Colban, Avdelingsleder Avdeling for klinisk forskningsstøtte Virksomhetsområde forskningsstøtte Oslo universitetssykehus HF
Company Presentation. (sfi) 2 karrieredag. 31 October 2012. Knut T. Smerud Founder, Chairman and CEO SMERUD MEDICAL RESEARCH GROUP
 Company Presentation (sfi) 2 karrieredag 31 October 2012 Knut T. Smerud Founder, Chairman and CEO 1 2 AGENDA SMERUD CRO firmaprofil Hva gjør vi? Hvem er vi? Hvor er vi? Stillingstyper for statistikere
Company Presentation (sfi) 2 karrieredag 31 October 2012 Knut T. Smerud Founder, Chairman and CEO 1 2 AGENDA SMERUD CRO firmaprofil Hva gjør vi? Hvem er vi? Hvor er vi? Stillingstyper for statistikere
Statens legemiddelverks rolle i kliniske studier og hva skal det søkes om?
 Statens legemiddelverks rolle i kliniske studier og hva skal det søkes om? Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk AGENDA Regelverket Søknader og rapporter til
Statens legemiddelverks rolle i kliniske studier og hva skal det søkes om? Ingvild Aaløkken Seksjon for preklinikk og klinisk utprøving Statens legemiddelverk AGENDA Regelverket Søknader og rapporter til
Elektroniske pasientjournaler
 Elektroniske pasientjournaler - til glede og besvær Oslo 6. desember 2007 Pål Magnus Nordby CRA Manager AstraZeneca AS Agenda Bakgrunn Journalinnsyn i praksis FDA part 11 Regulering av klinisk utprøving
Elektroniske pasientjournaler - til glede og besvær Oslo 6. desember 2007 Pål Magnus Nordby CRA Manager AstraZeneca AS Agenda Bakgrunn Journalinnsyn i praksis FDA part 11 Regulering av klinisk utprøving
Innovasjonsseminar Hvordan innoverer bedrifter? Eksempler fra subsea og biotech bedrifter
 Innovasjonsseminar Hvordan innoverer bedrifter? Eksempler fra subsea og biotech bedrifter Åpningsuken ved HIB, 26.09.2014 Førsteamanuensis Inger Beate Pettersen, Senter for nyskaping Avdeling for ingeniør-
Innovasjonsseminar Hvordan innoverer bedrifter? Eksempler fra subsea og biotech bedrifter Åpningsuken ved HIB, 26.09.2014 Førsteamanuensis Inger Beate Pettersen, Senter for nyskaping Avdeling for ingeniør-
Statens legemiddelverks rolle Hurtige metodevurderinger av legemidler
 Statens legemiddelverks rolle Hurtige metodevurderinger av legemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi 24. januar 2012 Disposisjon Legemiddelpolitiske mål Hvorfor evaluering?
Statens legemiddelverks rolle Hurtige metodevurderinger av legemidler Elisabeth Bryn avdelingsdirektør Avdeling for legemiddeløkonomi 24. januar 2012 Disposisjon Legemiddelpolitiske mål Hvorfor evaluering?
Gjennom DELING av kunnskap, erfaring, forståelse, engasjement. i størst mulig grad basert på dokumentert viten.
 Gjennom DELING av kunnskap, erfaring, forståelse, engasjement. Bidra til at legemiddelbehandling av barn blir hensiktsmessig og trygg i størst mulig grad basert på dokumentert viten. Bidra til at alle
Gjennom DELING av kunnskap, erfaring, forståelse, engasjement. Bidra til at legemiddelbehandling av barn blir hensiktsmessig og trygg i størst mulig grad basert på dokumentert viten. Bidra til at alle
4/10/2013 IPR: HVORDAN IMMATERIELLE RETTIGHETER IVARETAS I HELSEFORETAKENE. Ole Kristian Hjelstuen
 IPR: HVORDAN IMMATERIELLE RETTIGHETER IVARETAS I HELSEFORETAKENE Ole Kristian Hjelstuen 1 Nyhet: Første børsnotering 9.april 4/10/2013 Serodus har to kardiologiske legemiddelkandidater i fase 2 2 www.inven2.com
IPR: HVORDAN IMMATERIELLE RETTIGHETER IVARETAS I HELSEFORETAKENE Ole Kristian Hjelstuen 1 Nyhet: Første børsnotering 9.april 4/10/2013 Serodus har to kardiologiske legemiddelkandidater i fase 2 2 www.inven2.com
Kunnskapssenteret - hva kan vi tilby psykisk helse feltet?
 Kunnskapsesenterets nye PPT-mal Kunnskapssenteret t - hva kan vi tilby psykisk helse feltet? Fagseminar DM 11.november 2010 Gro Jamtvedt, avdelingsdirektør Kunnskapsesenterets nye PPT-mal Visjon: God kunnskap
Kunnskapsesenterets nye PPT-mal Kunnskapssenteret t - hva kan vi tilby psykisk helse feltet? Fagseminar DM 11.november 2010 Gro Jamtvedt, avdelingsdirektør Kunnskapsesenterets nye PPT-mal Visjon: God kunnskap
Medikamentell Behandling
 www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
www.printo.it/pediatric-rheumatology/no/intro Medikamentell Behandling Versjon av 2016 13. Biologiske legemidler Gjennom bruk av biologiske legemidler har nye behandlingsprinsipper mot revmatisk sykdom
IPR seminar 9. oktober 2008
 IPR seminar 9. oktober 2008 Patenter på legemidler før 1992 Originalprodusentenes syn Vidar Sie MSD (Norge) AS MSDs forretningsstrategi Merck will continue to focus exclusively on our priorities: Turning
IPR seminar 9. oktober 2008 Patenter på legemidler før 1992 Originalprodusentenes syn Vidar Sie MSD (Norge) AS MSDs forretningsstrategi Merck will continue to focus exclusively on our priorities: Turning
Ansvar og oppfølging ved bruk av legemidler utenfor godkjent indikasjon. Gro Ramsten Wesenberg Direktør, Legemiddelverket
 Ansvar og oppfølging ved bruk av legemidler utenfor godkjent indikasjon Gro Ramsten Wesenberg Direktør, Legemiddelverket Innhold: Bakgrunn Definisjoner Hovedutfordringer Hva er mulig fra et regulatorisk
Ansvar og oppfølging ved bruk av legemidler utenfor godkjent indikasjon Gro Ramsten Wesenberg Direktør, Legemiddelverket Innhold: Bakgrunn Definisjoner Hovedutfordringer Hva er mulig fra et regulatorisk
Sakkyndig vurdering av. Strategy Group for Medical Image Science and Visualization. Torfinn Taxt, Universitetet i Bergen, Norge, mars 2008
 Sakkyndig vurdering av Strategy Group for Medical Image Science and Visualization Torfinn Taxt, Universitetet i Bergen, Norge, mars 2008 Innledning Bakgrunn for vurderingen er dokumentene i mappen med
Sakkyndig vurdering av Strategy Group for Medical Image Science and Visualization Torfinn Taxt, Universitetet i Bergen, Norge, mars 2008 Innledning Bakgrunn for vurderingen er dokumentene i mappen med
Implemetering av ICH Q3D «Elemental impurities» LMI kvalitetsdag 15/6-18 Jens Bleich, seniorrådgiver, kvalitetsutredning Område forsyning
 Implemetering av ICH Q3D «Elemental impurities» LMI kvalitetsdag 15/6-18 Jens Bleich, seniorrådgiver, kvalitetsutredning Område forsyning Agenda Implementering av ICH guideline Q3D on elemental impurities
Implemetering av ICH Q3D «Elemental impurities» LMI kvalitetsdag 15/6-18 Jens Bleich, seniorrådgiver, kvalitetsutredning Område forsyning Agenda Implementering av ICH guideline Q3D on elemental impurities
Marc V Ahmed Geriatrisk avdeling, Medisinsk klinikk Oslo universitetssykehus Ullevål Epost: marahm@ous-hf.no
 Marc V Ahmed Geriatrisk avdeling, Medisinsk klinikk Oslo universitetssykehus Ullevål Epost: marahm@ous-hf.no .As death has become less common in our daily lives, it has become harder to consider our own
Marc V Ahmed Geriatrisk avdeling, Medisinsk klinikk Oslo universitetssykehus Ullevål Epost: marahm@ous-hf.no .As death has become less common in our daily lives, it has become harder to consider our own
Gjennomføring av europaparlaments- og rådsforordning (EU) nr. 536/2014 om klinisk utprøving av legemidler til mennesker i norsk rett.
 1 Høringsnotat Gjennomføring av europaparlaments- og rådsforordning (EU) nr. 536/2014 om klinisk utprøving av legemidler til mennesker i norsk rett. 1 Innledning. EØS-komiteen vedtok ved beslutning nr.
1 Høringsnotat Gjennomføring av europaparlaments- og rådsforordning (EU) nr. 536/2014 om klinisk utprøving av legemidler til mennesker i norsk rett. 1 Innledning. EØS-komiteen vedtok ved beslutning nr.
Godkjenning av nye legemidler har vi mistet selvråderetten?
 Kontaktpunktet 23.09.2008 Godkjenning av nye legemidler har vi mistet selvråderetten? Ulike godkjenningsprosedyrer Norges påvirkningsmulighet Jan Petter Akselsen Seksjonssjef Medisinsk seksjon Avdeling
Kontaktpunktet 23.09.2008 Godkjenning av nye legemidler har vi mistet selvråderetten? Ulike godkjenningsprosedyrer Norges påvirkningsmulighet Jan Petter Akselsen Seksjonssjef Medisinsk seksjon Avdeling
Foreldreundersøkelsen
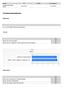 Utvalg År Prikket Sist oppdatert Kampen skole (Høst 2014) Høst 2014 03.12.2014 Foreldreundersøkelsen Bakgrunn Kryss av for hvilket årstrinn barnet går på: Trivsel Barnet mitt trives på skolen 4,7 Barnet
Utvalg År Prikket Sist oppdatert Kampen skole (Høst 2014) Høst 2014 03.12.2014 Foreldreundersøkelsen Bakgrunn Kryss av for hvilket årstrinn barnet går på: Trivsel Barnet mitt trives på skolen 4,7 Barnet
ECHA guidance for etterfølgende brukere. Under revisjon i 2013
 ECHA guidance for etterfølgende brukere Under revisjon i 2013 En veileder om REACH, som forklarer forpliktelsene og hvordan oppfylle dem ECHA oppdaterer veiledninger etter konsultationsrunder Du finner
ECHA guidance for etterfølgende brukere Under revisjon i 2013 En veileder om REACH, som forklarer forpliktelsene og hvordan oppfylle dem ECHA oppdaterer veiledninger etter konsultationsrunder Du finner
Vitenskapelig og etisk vurdering av design og kontrollgruppe
 Vitenskapelig og etisk vurdering av design og kontrollgruppe Stein A. Evensen Tidl leder REK Sør-Øst D Soria Moria 29 august 2013 Hva karakteriserer legemiddelstudier? At de oftest kommer fra legemiddelindustrien
Vitenskapelig og etisk vurdering av design og kontrollgruppe Stein A. Evensen Tidl leder REK Sør-Øst D Soria Moria 29 august 2013 Hva karakteriserer legemiddelstudier? At de oftest kommer fra legemiddelindustrien
Utfordringer og risiko forbundet med anskaffelse av legemidler på godkjenningsfritak
 Utfordringer og risiko forbundet med anskaffelse av legemidler på godkjenningsfritak Line Saxegaard Legemiddelinspektør Statens legemiddelverk Juni 2016 Tema for presentasjonen: Kort om avdeling for tilsyn
Utfordringer og risiko forbundet med anskaffelse av legemidler på godkjenningsfritak Line Saxegaard Legemiddelinspektør Statens legemiddelverk Juni 2016 Tema for presentasjonen: Kort om avdeling for tilsyn
Rammebetingelser - offentlige bestemmelser og kjøreregler:
 Møte Oslo 14.12.2010: Rammebetingelser - offentlige bestemmelser og kjøreregler: Legemidler Steinar Madsen Avdeling for legemiddelinformasjon Et uoversiktelig landskap? Legemidler Naturlegemiddel Kosttilskudd
Møte Oslo 14.12.2010: Rammebetingelser - offentlige bestemmelser og kjøreregler: Legemidler Steinar Madsen Avdeling for legemiddelinformasjon Et uoversiktelig landskap? Legemidler Naturlegemiddel Kosttilskudd
Off label, off licence og compassionate use
 Off label, off licence og compassionate use «regelverket» «forsyningskjeden» LMK 06.09.2017 21.06.17 Høie: Vi har ikke vært gode nok på utprøvende kreftbehandling LOVER BEDRING: Helseminister Bent Høie
Off label, off licence og compassionate use «regelverket» «forsyningskjeden» LMK 06.09.2017 21.06.17 Høie: Vi har ikke vært gode nok på utprøvende kreftbehandling LOVER BEDRING: Helseminister Bent Høie
Sak Hvilke helseeffekter bør være dokumentert før innføring av nye (kreft)legemidler i spesialisthelsetjenesten?
 Møtesaksnummer 08/09 Saksnummer 08/266 Dato 29. januar 2009 Kontaktperson Ånen Ringard Sak Hvilke helseeffekter bør være dokumentert før innføring av nye (kreft)legemidler i spesialisthelsetjenesten? Bakgrunn
Møtesaksnummer 08/09 Saksnummer 08/266 Dato 29. januar 2009 Kontaktperson Ånen Ringard Sak Hvilke helseeffekter bør være dokumentert før innføring av nye (kreft)legemidler i spesialisthelsetjenesten? Bakgrunn
Medisinsk statistikk, KLH3004 Dmf, NTNU 2009. Styrke- og utvalgsberegning
 Styrke- og utvalgsberegning Geir Jacobsen, ISM Sample size and Power calculations The essential question in any trial/analysis: How many patients/persons/observations do I need? Sample size (an example)
Styrke- og utvalgsberegning Geir Jacobsen, ISM Sample size and Power calculations The essential question in any trial/analysis: How many patients/persons/observations do I need? Sample size (an example)
RELIS Regionalt legemiddelinformasjonssenter
 Råd om kildebruk Fagdag 20. sept. 2012 Faggruppen for klinisk farmasi Randi Myhr, RELIS Sør-Øst RELIS Regionalt legemiddelinformasjonssenter Offentlig finansiert virksomhet Spørsmål og svar-tjeneste for
Råd om kildebruk Fagdag 20. sept. 2012 Faggruppen for klinisk farmasi Randi Myhr, RELIS Sør-Øst RELIS Regionalt legemiddelinformasjonssenter Offentlig finansiert virksomhet Spørsmål og svar-tjeneste for
Helsesjekk. en input til usikkerhetsstyring
 Helsesjekk en input til usikkerhetsstyring 2009-07-02 En presentasjon fra Telenor v. Helge Marheim 2 Helge Marheim Usikkerhetstyring Prosessforbedring Metode og teknikker Senior prosjektleder Telenor Norge
Helsesjekk en input til usikkerhetsstyring 2009-07-02 En presentasjon fra Telenor v. Helge Marheim 2 Helge Marheim Usikkerhetstyring Prosessforbedring Metode og teknikker Senior prosjektleder Telenor Norge
DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER
 DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER Beslutninger og erfaringer fra revmatologisk seksjon Drammen Sykehus VVHF Åse S. Lexberg, avdelings overlege, revmatologisk seksjon,
DERFOR HAR VI BYTTET TIL BIOTILSVARENDE LEGEMIDLER PÅ VÅRE PASIENTER Beslutninger og erfaringer fra revmatologisk seksjon Drammen Sykehus VVHF Åse S. Lexberg, avdelings overlege, revmatologisk seksjon,
Effektivisering av store komplekse prosjektleveranser. Agnar Johansen Prosjektleder
 Effektivisering av store komplekse prosjektleveranser Agnar Johansen Prosjektleder La oss begynne med konklusjonen Teknisk Ukeblad, 1. september 2014: Nytt forskningsprogram Norge kan godt, I har skal
Effektivisering av store komplekse prosjektleveranser Agnar Johansen Prosjektleder La oss begynne med konklusjonen Teknisk Ukeblad, 1. september 2014: Nytt forskningsprogram Norge kan godt, I har skal
Spesielle godkjenningsprosedyrer i EU
 Spesielle godkjenningsprosedyrer i EU Rådgivningsmuligheter og forpliktelser sett fra industriens synspunkt Elisabeth Hagen Regulatory Advice Management as 13 November 2008 Norsk Biotekforum, Oslo Innhold
Spesielle godkjenningsprosedyrer i EU Rådgivningsmuligheter og forpliktelser sett fra industriens synspunkt Elisabeth Hagen Regulatory Advice Management as 13 November 2008 Norsk Biotekforum, Oslo Innhold
Kliniske studier - krav til søknader. Marit Grønning, professor, dr.med. REC Western Norway
 Kliniske studier - krav til søknader http://helseforskning.etikkom.no Marit Grønning, professor, dr.med. REC Western Norway Agenda Forskningsetikkloven Helseforskningsloven Sammensetning av REK 9 medlemmer
Kliniske studier - krav til søknader http://helseforskning.etikkom.no Marit Grønning, professor, dr.med. REC Western Norway Agenda Forskningsetikkloven Helseforskningsloven Sammensetning av REK 9 medlemmer
Off-label bruk av legemidler
 Off-label bruk av legemidler Øyvind Melien, kst. avd. sjef/overlege Avd. for klinisk farmakologi, Oslo universitetssykehus, Rikshospitalet Statens legemiddelverk Seminar om legemiddelsikkerhet hos barn
Off-label bruk av legemidler Øyvind Melien, kst. avd. sjef/overlege Avd. for klinisk farmakologi, Oslo universitetssykehus, Rikshospitalet Statens legemiddelverk Seminar om legemiddelsikkerhet hos barn
nye PPT-mal behandlingsretningslinjer
 Nasjonal forskningskonferanse Ny satsing innen muskel- og skjelettskader, sykdommer og plager 15-16 november 2012 Kunnskapsesenterets Implementering av behandlingsretningslinjer nye PPT-mal Gro Jamtvedt,
Nasjonal forskningskonferanse Ny satsing innen muskel- og skjelettskader, sykdommer og plager 15-16 november 2012 Kunnskapsesenterets Implementering av behandlingsretningslinjer nye PPT-mal Gro Jamtvedt,
Like legemidler forskjellig informasjon
 Like legemidler forskjellig informasjon Åpent møte om legemiddelinformasjon, LMI 20. nov 2008 Inger Heggebø Hvordan kan det bli forskjellige preparatomtaler for tilsvarende preparater? 4 veier til en markedsføringstillatelse:
Like legemidler forskjellig informasjon Åpent møte om legemiddelinformasjon, LMI 20. nov 2008 Inger Heggebø Hvordan kan det bli forskjellige preparatomtaler for tilsvarende preparater? 4 veier til en markedsføringstillatelse:
Biosimilars - patentrettslige og regulatoriske problemstillinger
 Foredrag Norsk Biotekforum Møteplass IPR Biosimilars - patentrettslige og regulatoriske problemstillinger 13. september 2012 v/advokat Ingvild Hanssen-Bauer, Wikborg Rein 1 Hva er biosimilars? Biologiske
Foredrag Norsk Biotekforum Møteplass IPR Biosimilars - patentrettslige og regulatoriske problemstillinger 13. september 2012 v/advokat Ingvild Hanssen-Bauer, Wikborg Rein 1 Hva er biosimilars? Biologiske
Vilkår for bruk av nye legemidler før MT
 Helse Sør-Øst RHF Gode og likeverdige helsetjenester til alle som trenger det, når de trenger det, uavhengig av alder, bosted, etnisk bakgrunn, kjønn og økonomi. Vilkår for bruk av nye legemidler før MT
Helse Sør-Øst RHF Gode og likeverdige helsetjenester til alle som trenger det, når de trenger det, uavhengig av alder, bosted, etnisk bakgrunn, kjønn og økonomi. Vilkår for bruk av nye legemidler før MT
Compassionate useregulatoriske. DM-arena
 Compassionate useregulatoriske rammer DM-arena 13.02.2019 Tema Forsøke «rydde» i begrepene! Forskriving Off-label Tilgang på legemidler uten MT Off-licence Compassionate use program - CUP Compassionate
Compassionate useregulatoriske rammer DM-arena 13.02.2019 Tema Forsøke «rydde» i begrepene! Forskriving Off-label Tilgang på legemidler uten MT Off-licence Compassionate use program - CUP Compassionate
Mutual Recognition Agreement for inspeksjoner mellom Norge og USA. Kvalitetsdagen, LMI 15. juni 2018 Inger Heggebø, Legemiddelverket
 Mutual Recognition Agreement for inspeksjoner mellom Norge og USA Kvalitetsdagen, LMI 15. juni 2018 Inger Heggebø, Legemiddelverket Agenda Bakgrunn - MT søknader - endringssøknader Hvordan håndteres en
Mutual Recognition Agreement for inspeksjoner mellom Norge og USA Kvalitetsdagen, LMI 15. juni 2018 Inger Heggebø, Legemiddelverket Agenda Bakgrunn - MT søknader - endringssøknader Hvordan håndteres en
04.11.2014. Ph.d-utdanningen. Harmonisering av krav i Norden
 Ph.d-utdanningen Harmonisering av krav i Norden 2 1 Nasjonalt forskningsdekanmøte i Tromsø, oktober 2014 Nordic Medical Research Councils (NOS-M), november 2014 Prodekanmøte våren 2015 Dekanmøte våren
Ph.d-utdanningen Harmonisering av krav i Norden 2 1 Nasjonalt forskningsdekanmøte i Tromsø, oktober 2014 Nordic Medical Research Councils (NOS-M), november 2014 Prodekanmøte våren 2015 Dekanmøte våren
Spesialistsentrenes rolle i den kliniske forskningen.
 Industri Helsevesen Akademia Pasient Spesialistsentrenes rolle i den kliniske forskningen. Lege Kjetil Høye Medi3 Innlandet AS, Hamar Industri Akademia Helsevesen Pasient Spesialistsentrenes rolle i den
Industri Helsevesen Akademia Pasient Spesialistsentrenes rolle i den kliniske forskningen. Lege Kjetil Høye Medi3 Innlandet AS, Hamar Industri Akademia Helsevesen Pasient Spesialistsentrenes rolle i den
Barneforordningen norsk perspektiv
 Barneforordningen norsk perspektiv - Insentiver i barneforordningen - Legemidler til barn - Hva er situasjonen i Norge? Siri Wang Fagdirektør, PDCO delegat, SLV, Område Tilgang Industrimøte SLV 15. november
Barneforordningen norsk perspektiv - Insentiver i barneforordningen - Legemidler til barn - Hva er situasjonen i Norge? Siri Wang Fagdirektør, PDCO delegat, SLV, Område Tilgang Industrimøte SLV 15. november
NOR/306R T OJ X 92/06, p. 6-9
 NOR/306R0507.00T OJ X 92/06, p. 6-9 COMMISSION REGULATION (EC) No 507/2006 of 29 March 2006 on the conditional marketing authorisation for medicinal products for human use falling within the scope of Regulation
NOR/306R0507.00T OJ X 92/06, p. 6-9 COMMISSION REGULATION (EC) No 507/2006 of 29 March 2006 on the conditional marketing authorisation for medicinal products for human use falling within the scope of Regulation
SeaWalk No 1 i Skjolden
 SeaWalk No 1 i Skjolden August 2011 Luster Kommune Marked I løpet av de neste 10 år er verdens cruisemarked ventet å doble seg. Veksten forventes større i Europa enn i Kariben og USA. Markedet vil lete
SeaWalk No 1 i Skjolden August 2011 Luster Kommune Marked I løpet av de neste 10 år er verdens cruisemarked ventet å doble seg. Veksten forventes større i Europa enn i Kariben og USA. Markedet vil lete
Forslag til nasjonal metodevurdering av pembrolizumab
 Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering av pembrolizumab Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener
Forslagsskjema, Versjon 2 17. mars 2014 Forslag til nasjonal metodevurdering av pembrolizumab Innsendte forslag til nasjonale metodevurderinger vil bli publisert i sin helhet. Dersom forslagsstiller mener
Nycomed - et Takeda-selskap
 Nycomed - et Takeda-selskap DET NYE SELSKAPET I TALL Nr >70 Markeder i verden i #1 12 Japans 30% Nycomeds hvor salg av største årlige Takeda er operative reseptbelagte legemidler farmasøytiske selskap
Nycomed - et Takeda-selskap DET NYE SELSKAPET I TALL Nr >70 Markeder i verden i #1 12 Japans 30% Nycomeds hvor salg av største årlige Takeda er operative reseptbelagte legemidler farmasøytiske selskap
Hvor langt avbrudd kan man ha fra (DOT-)behandling?
 Hvor langt avbrudd kan man ha fra (DOT-)behandling? Odd Mørkve Senter for internasjonal Helse Universitetet i Bergen Landskonferanse om tuberkulose, Oslo 25.03.2011 Eller: hva gjør man ved avbrudd av tuberkulosebehandling?
Hvor langt avbrudd kan man ha fra (DOT-)behandling? Odd Mørkve Senter for internasjonal Helse Universitetet i Bergen Landskonferanse om tuberkulose, Oslo 25.03.2011 Eller: hva gjør man ved avbrudd av tuberkulosebehandling?
Industrien må ha tilgang til helsedata for å kunne levere innovative produkter for fremtidens helsetjenester Er vi klare?
 Odd Arild Lehne, Advisor Innovation Projects, Oslo Medtech Industrien må ha tilgang til helsedata for å kunne levere innovative produkter for fremtidens helsetjenester Er vi klare? Industrien må ha tilgang
Odd Arild Lehne, Advisor Innovation Projects, Oslo Medtech Industrien må ha tilgang til helsedata for å kunne levere innovative produkter for fremtidens helsetjenester Er vi klare? Industrien må ha tilgang
Bakgrunn. KLMED 8006 Anvendt medisinsk statistikk - Vår 2008 Repeterte målinger. Overvekt: løp for livet
 KLMED 8006 Anvendt medisinsk statistikk - Vår 2008 Repeterte målinger Arnt Erik Tjønna og Eirik Skogvoll Institutt for sirkulasjon og bildediagnostikk, Det medisinske fakultet, NTNU Bakgrunn Inaktivitet
KLMED 8006 Anvendt medisinsk statistikk - Vår 2008 Repeterte målinger Arnt Erik Tjønna og Eirik Skogvoll Institutt for sirkulasjon og bildediagnostikk, Det medisinske fakultet, NTNU Bakgrunn Inaktivitet
MeldingsID: Innsendt dato: :01. Instrument: -
 MeldingsID: 249725 Innsendt dato: 24.11.2009 07:01 UtstederID: Utsteder: Instrument: - Marked: Kategori: Informasjonspliktig: Lagringspliktig: Vedlegg: Tittel: Meldingstekst: WEIFA Weifa ASA XOSL INNSIDEINFORMASJON
MeldingsID: 249725 Innsendt dato: 24.11.2009 07:01 UtstederID: Utsteder: Instrument: - Marked: Kategori: Informasjonspliktig: Lagringspliktig: Vedlegg: Tittel: Meldingstekst: WEIFA Weifa ASA XOSL INNSIDEINFORMASJON
Skreddersydd medisin: Dyrt og eksklusivt, eller investering i fremtidig pasient-nytte og bedre helseøkonomi?
 Skreddersydd medisin: Dyrt og eksklusivt, eller investering i fremtidig pasient-nytte og bedre helseøkonomi? Kjetil Taskén Bioteknologisenteret og Norsk senter for molekylærmedisin Universitetet i Oslo
Skreddersydd medisin: Dyrt og eksklusivt, eller investering i fremtidig pasient-nytte og bedre helseøkonomi? Kjetil Taskén Bioteknologisenteret og Norsk senter for molekylærmedisin Universitetet i Oslo
Høringsnotat. Forskrift om farmakogenetiske undersøkelser
 Høringsnotat Helse- og omsorgsdepartementet Forskrift om farmakogenetiske undersøkelser Side 1 av 7 1 Hovedinnhold Helse- og omsorgsdepartementet foreslår i dette høringsnotatet en ny forskrift som skal
Høringsnotat Helse- og omsorgsdepartementet Forskrift om farmakogenetiske undersøkelser Side 1 av 7 1 Hovedinnhold Helse- og omsorgsdepartementet foreslår i dette høringsnotatet en ny forskrift som skal
LEGEMIDDELBRUK I HAVBRUK
 LEGEMIDDELBRUK I HAVBRUK GJELDENDE RETT OG FORVALTNINGSPRAKSIS ADVOKAT LARS SELMAR ALSAKER FINNSNES 12.05.2015 OSLO TØNSBERG BERGEN ÅLESUND TRONDHEIM TROMSØ www.steenstrup.no ADVOKATFIRMAET STEENSTRUP
LEGEMIDDELBRUK I HAVBRUK GJELDENDE RETT OG FORVALTNINGSPRAKSIS ADVOKAT LARS SELMAR ALSAKER FINNSNES 12.05.2015 OSLO TØNSBERG BERGEN ÅLESUND TRONDHEIM TROMSØ www.steenstrup.no ADVOKATFIRMAET STEENSTRUP
Legemiddelindustrien. Hva skal til for å lykkes og hvor er vi om 5 år? Karita Bekkemellem
 Legemiddelindustrien Hva skal til for å lykkes og hvor er vi om 5 år? 10.01.2017 Karita Bekkemellem Hvem er legemiddelindustrien i dag? Bransjeorganisasjon for 60 medlemmer Både internasjonale «Big Pharma»
Legemiddelindustrien Hva skal til for å lykkes og hvor er vi om 5 år? 10.01.2017 Karita Bekkemellem Hvem er legemiddelindustrien i dag? Bransjeorganisasjon for 60 medlemmer Både internasjonale «Big Pharma»
Metodevurderingen har to store metodefeil og kan ikke brukes
 Metodevurderingen har to store metodefeil og kan ikke brukes 1) Legger feilaktig til grunn at ms har så svingende symptomer og plager at behandlingseffekt ikke kan bedømmes uten kontrollgruppe (ikke belegg
Metodevurderingen har to store metodefeil og kan ikke brukes 1) Legger feilaktig til grunn at ms har så svingende symptomer og plager at behandlingseffekt ikke kan bedømmes uten kontrollgruppe (ikke belegg
- A KU T T H J E R T E I N FA R K T S O M E K S E M P E L. Kristin M Aakre Overlege, Hormonlaboratoriet Førsteamanuensis, Universitetet i Bergen
 BESLUTNINGSGRENSER ELLER REFERANSEOMRÅDER: BETYR DET NOKO FOR LABORATORIET? - A KU T T H J E R T E I N FA R K T S O M E K S E M P E L Kristin M Aakre Overlege, Hormonlaboratoriet Førsteamanuensis, Universitetet
BESLUTNINGSGRENSER ELLER REFERANSEOMRÅDER: BETYR DET NOKO FOR LABORATORIET? - A KU T T H J E R T E I N FA R K T S O M E K S E M P E L Kristin M Aakre Overlege, Hormonlaboratoriet Førsteamanuensis, Universitetet
Påstandsforordningen: Muligheter og trusler for næringen? Hvorfor et nytt rammeverk for bruk av påstander?
 Påstandsforordningen: Muligheter og trusler for næringen? Steinar Høie, NHO Mat og Drikke Hvorfor et nytt rammeverk for bruk av påstander? Bedre forbrukerbeskyttelse Et økende antall produkter merkes og
Påstandsforordningen: Muligheter og trusler for næringen? Steinar Høie, NHO Mat og Drikke Hvorfor et nytt rammeverk for bruk av påstander? Bedre forbrukerbeskyttelse Et økende antall produkter merkes og
- Find and fight the cause, not the symptoms. sirnasense. Oktober 2009 Hanne M. Kristensen, CEO. A BMI Company. Member of
 - Find and fight the cause, not the symptoms Oktober 2009 Hanne M. Kristensen, CEO A BMI Company Member of sirna muligheter og utfordringer Muligheter: Skru av uttrykk av proteiner som er relatert til
- Find and fight the cause, not the symptoms Oktober 2009 Hanne M. Kristensen, CEO A BMI Company Member of sirna muligheter og utfordringer Muligheter: Skru av uttrykk av proteiner som er relatert til
Beslutningsstøtte og forskrivningsstøtte
 Beslutningsstøtte og forskrivningsstøtte Thomas Brox Røst Øystein Nytrø Inger Dybdahl Sørby Institutt for datateknikk og informasjonsvitenskap, NTNU Hva er klinisk beslutningsstøtte? Påminnere og advarsler
Beslutningsstøtte og forskrivningsstøtte Thomas Brox Røst Øystein Nytrø Inger Dybdahl Sørby Institutt for datateknikk og informasjonsvitenskap, NTNU Hva er klinisk beslutningsstøtte? Påminnere og advarsler
Bevacizumab ved behandling av ovariecancer. Av Professor Gunnar Kristensen
 Bevacizumab ved behandling av ovariecancer Av Professor Gunnar Kristensen Den amerikanske studiegruppe GOG vurderte i studie GOG218 tillegget av bevacizumab til standard kjemoterapi (karboplatin pluss
Bevacizumab ved behandling av ovariecancer Av Professor Gunnar Kristensen Den amerikanske studiegruppe GOG vurderte i studie GOG218 tillegget av bevacizumab til standard kjemoterapi (karboplatin pluss
Legemiddelstudier på barn
 Legemiddelstudier på barn Ansgar Berg Seksjonsoverlege, Prof. dr med Barneklinikken, Haukeland Universitetssykehus Røros 15 oktober 2013 Nødvendigheten av å inkludere barn i kliniske utprøvninger Barn
Legemiddelstudier på barn Ansgar Berg Seksjonsoverlege, Prof. dr med Barneklinikken, Haukeland Universitetssykehus Røros 15 oktober 2013 Nødvendigheten av å inkludere barn i kliniske utprøvninger Barn
Statens legemiddelverk - visjon og veien videre - Audun Hågå Direktør Statens legemiddelverk
 Statens legemiddelverk - visjon og veien videre - Audun Hågå Direktør Statens legemiddelverk Rammene rundt Del av helseforvaltningen arbeide for overordnede politiske målsetninger, levere på oppgaver i
Statens legemiddelverk - visjon og veien videre - Audun Hågå Direktør Statens legemiddelverk Rammene rundt Del av helseforvaltningen arbeide for overordnede politiske målsetninger, levere på oppgaver i
1. COACHMODELL: GROW... 1 2. PERSONLIG VERDIANALYSE... 2 3. EGENTEST FOR MENTALE MODELLER. (Noen filtre som vi til daglig benytter)...
 Personal og lønn Coaching 1. COACHMODELL: GROW... 1 2. PERSONLIG VERDIANALYSE... 2 3. EGENTEST FOR MENTALE MODELLER. (Noen filtre som vi til daglig benytter).... 3 1. COACHMODELL: GROW Formål: GROW-modellen
Personal og lønn Coaching 1. COACHMODELL: GROW... 1 2. PERSONLIG VERDIANALYSE... 2 3. EGENTEST FOR MENTALE MODELLER. (Noen filtre som vi til daglig benytter).... 3 1. COACHMODELL: GROW Formål: GROW-modellen
Forskning og utvikling hvorfor er kliniske studier et viktig satsingsområde for LMI Katrine Bryne Lov og Bransjekurs 2018
 Forskning og utvikling hvorfor er kliniske studier et viktig satsingsområde for LMI Katrine Bryne Lov og Bransjekurs 2018 Agenda 1. Politiske prosesser 2. Industriens globale pipeline & hva er en klinisk
Forskning og utvikling hvorfor er kliniske studier et viktig satsingsområde for LMI Katrine Bryne Lov og Bransjekurs 2018 Agenda 1. Politiske prosesser 2. Industriens globale pipeline & hva er en klinisk
Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning
 Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning Gustav Gaudernack Immunologisk avdeling Institutt for Kreftforskning Oslo Universitetsykehus-Radiumhospitalet Helse- og omsorgskonferansen
Ny kreftvaksine: Viktigheten av å kommersialisere medisinsk forskning Gustav Gaudernack Immunologisk avdeling Institutt for Kreftforskning Oslo Universitetsykehus-Radiumhospitalet Helse- og omsorgskonferansen
Patent, SPC, dokumentbeskyttelse, markedsbeskyttelse
 Patent, SPC, dokumentbeskyttelse, markedsbeskyttelse Inga Kaasen Advokat og partner i NORDIA, Dr philos i biologi Norsk biotekforum 9.10.2013 Nordia Law Nordisk advokatfirma med kontor i Oslo, Stockholm,
Patent, SPC, dokumentbeskyttelse, markedsbeskyttelse Inga Kaasen Advokat og partner i NORDIA, Dr philos i biologi Norsk biotekforum 9.10.2013 Nordia Law Nordisk advokatfirma med kontor i Oslo, Stockholm,
Hva trenger oppstartsfirmaer for å lykkes?
 Unlocking the potential of innovative medicines Hva trenger oppstartsfirmaer for å lykkes? LMI Regulatorisk høstmøte 8. oktober 2013 Lucy Wabakken, Regulatory Affairs Director, PCI Biotech December, 2011
Unlocking the potential of innovative medicines Hva trenger oppstartsfirmaer for å lykkes? LMI Regulatorisk høstmøte 8. oktober 2013 Lucy Wabakken, Regulatory Affairs Director, PCI Biotech December, 2011
Barn og medisiner - hvordan kan vi teste ut medisiner på barn? Presentasjon basert på informasjon fra Betty Kalikstad av Wenche H Reichelt
 Barn og medisiner - hvordan kan vi teste ut medisiner på barn? Presentasjon basert på informasjon fra Betty Kalikstad av Wenche H Reichelt Betty Kalikstad Barnelege Oslo Universitetssykehus, Gaustad (Rikshospitalet)
Barn og medisiner - hvordan kan vi teste ut medisiner på barn? Presentasjon basert på informasjon fra Betty Kalikstad av Wenche H Reichelt Betty Kalikstad Barnelege Oslo Universitetssykehus, Gaustad (Rikshospitalet)
Patenter på planter og dyr
 Patenter på planter og dyr FNI, 17 august 2010 Bell Batta Torheim Rådgiver, Utviklingsfondet 1. Utviklingsfondets tilnærming 2. Patentpraksis i EPO 3. Initiativ i EU 4. Norsk innsats Utviklingsfondets
Patenter på planter og dyr FNI, 17 august 2010 Bell Batta Torheim Rådgiver, Utviklingsfondet 1. Utviklingsfondets tilnærming 2. Patentpraksis i EPO 3. Initiativ i EU 4. Norsk innsats Utviklingsfondets
Kan kunstig intelligens bidra til økte studier for kreftpasienter?
 Kan kunstig intelligens bidra til økte studier for kreftpasienter? IBM Watson Health Clinical Trial Matching ROAR JOHANSEN KREFTLEGE WATSON HEALTH AGENDA - Kliniske studier - Kreftpasienter - Utfordringer
Kan kunstig intelligens bidra til økte studier for kreftpasienter? IBM Watson Health Clinical Trial Matching ROAR JOHANSEN KREFTLEGE WATSON HEALTH AGENDA - Kliniske studier - Kreftpasienter - Utfordringer
Bruk og behov av Real World Evidence - et pilot prosjekt. Hege Edvardsen, Medical Manager
 Bruk og behov av Real World Evidence - et pilot prosjekt Hege Edvardsen, Medical Manager Agenda Hvorfor RWE Hvilken bruk har industrien av RWE data Hva er utfordringene Pilot samarbeid Samarbeidsklima
Bruk og behov av Real World Evidence - et pilot prosjekt Hege Edvardsen, Medical Manager Agenda Hvorfor RWE Hvilken bruk har industrien av RWE data Hva er utfordringene Pilot samarbeid Samarbeidsklima
Regler om medisinsk fritak fra dopinglisten
 Regler om medisinsk fritak fra dopinglisten 1 Hjemmel Disse Reglene er gitt med hjemmel i NIFs lov 12-2 punkt 4. 2 Virkeområde 1) I henhold til dopingbestemmelsene skal enhver utøver som er medlem av et
Regler om medisinsk fritak fra dopinglisten 1 Hjemmel Disse Reglene er gitt med hjemmel i NIFs lov 12-2 punkt 4. 2 Virkeområde 1) I henhold til dopingbestemmelsene skal enhver utøver som er medlem av et
Høring vedrørende utlevering av parallellimporterte legemidler fra apotek ved reservasjon mot generisk bytte
 Statens legemiddelverk Postboks 63, Kalbakken 0901 OSLO Deres ref. Vår ref. Dato: 10/23139-3 10/180-10/JA/raa 24.06.2011 Høring vedrørende utlevering av parallellimporterte legemidler fra apotek ved reservasjon
Statens legemiddelverk Postboks 63, Kalbakken 0901 OSLO Deres ref. Vår ref. Dato: 10/23139-3 10/180-10/JA/raa 24.06.2011 Høring vedrørende utlevering av parallellimporterte legemidler fra apotek ved reservasjon
